江苏省水稻品质性状遗传和重要基因克隆研究进展
2021-05-19张昌泉冯琳皓顾铭洪刘巧泉
张昌泉,冯琳皓,顾铭洪,刘巧泉
江苏省水稻品质性状遗传和重要基因克隆研究进展
张昌泉,冯琳皓,顾铭洪,刘巧泉
扬州大学农学院植物功能基因组学教育部重点实验室/江苏省作物基因组学和分子育种重点实验室/江苏省粮食作物现代产业技术协同创新中心,扬州 225009
水稻(L.)是保障我国粮食安全和农业可持续发展的主粮作物,江苏是我国重要的水稻种植区。经过40多年的发展,江苏水稻产量和品质性状研究都取得了重要进展。稻米品质性状组成复杂,涉及生产、加工、销售和消费多方面。本文对江苏省水稻几个主要品质性状的遗传研究历程进行了概括,重点对水稻外观品质、蒸煮食味品质和营养品质的遗传调控研究进行了总结。文章介绍了稻米品质性状的经典遗传规律和分子遗传特点,综述了各个品质性状遗传调控相关的重要功能基因。相关研究成果凸显了江苏水稻品质遗传改良基础研究在国内外的重要地位。特别指出,随着水稻功能基因组学的发展和品质性状遗传调控网络的明晰,未来针对特定或复合品质性状的分子设计育种是江苏水稻品质遗传改良研究中要重点推进的方向。
水稻品质性状;遗传规律;外观品质;蒸煮食味品质;营养品质
水稻(L.)是我国最重要的粮食作物。长期以来,为了解决“吃饱饭”问题,水稻高产育种及相关技术获得了重大突破,经历了矮化育种、杂种优势利用和绿色超级稻培育3次飞跃,并成为确保我国“口粮绝对安全”的核心支撑[1]。21世纪以来,随着国民生活水平的提高,育种目标已经从以单一产量为主转移到优质、多抗和高产并重的复合性状,尤其是对稻米品质的提高显得越来越迫切。经过多年品质育种努力,近些年来选育出的水稻品种的稻米品质较早期一些品种有了大幅提高,但对标国际优质大米和消费需求,我国高档优质水稻品种较少,稻米品质水平总体仍然较低[2,3]。
江苏省水稻品种类型丰富,不仅籼、粳稻并存,粳稻中又有中、晚粳之分。江苏是我国主要的粳稻种植区域,约占全国粳稻总种植面积的1/4,其中用于常规粳稻种植的面积约在200万公顷,籼稻种植面积在30万公顷左右[3]。江苏省内涉农研究机构高度重视水稻品质性状的遗传与改良研究。自新中国成立以来,对水稻品质性状的遗传研究大致可分为3个时期。第一个时期为改革开放以前,尽管国外已经开始稻米品质性状的遗传规律和遗传效应探索,但是国内同时期的水稻品质性状遗传研究却很少,主要集中在对一些品种进行简单品质性状的测定方面,尚未开展系统的遗传学研究[4]。第二个时期为改革开放至20世纪末,该阶段以稻米品质性状的经典遗传研究为主,主要是探索稻米品质性状的遗传规律,研究品质性状与母体基因型、细胞质基因型和胚乳基因型的关系。该时期的研究初步明确了一些品质性状如粒形、直链淀粉含量和垩白等的遗传规律,但尚未进行具体的基因克隆与功能研究[5~6]。第三个时期为进入21世纪以来,稻米品质性状的分子遗传研究进入了快速发展阶段[2,7,8];其中前10年,研究主要集中在利用分子标记对一些品质性状进行遗传连锁、关联分析和相关数量性状位点(Quantitative trait loci, QTLs)的定位分析[9~13],同时,也克隆了香味等几个重要品质性状基因[14,15],也有一些利用转基因技术研究品质相关基因效用的进展[16];自2010年以来,稻米品质性状的一些重要基因或等位基因陆续被鉴定,基于功能基因分子标记辅助选择和基因编辑的分子设计育种技术不断推进,一些具有优良食味或特殊营养价值的水稻新品种被不断培育出来,稻米品质遗传改良研究进入了快速发展时期[2,17,18]。
稻米品质性状涉及多方面,就生产加工而言,需要较高的出米率(加工品质);就销售过程而言,优良的稻米外观(外观品质)是决定稻米商品价值的重要因素;而就消费者而言,好吃又健康(蒸煮食味、卫生健康和营养品质)的稻米更具有吸引力[8]。因此,稻米品质性状的遗传和分子调控研究也涉及多个研究方向。本文重点介绍了稻米品质性状遗传规律和遗传模型、以及近些年来在稻米蒸煮食味品质(淀粉合成和香味调控)、外观品质(粒形和垩白)和营养品质(蛋白含量和氨基酸代谢等)等重要品质性状相关基因克隆与功能研究方面取得的进展。
1 稻米品质性状遗传规律和遗传模型
水稻品质性状遗传规律的研究是稻米品质分子遗传改良和育种应用的基础。从遗传组成看,稻米的可食用部分主要为三倍体的胚乳,胚乳的遗传组成和遗传表现非常复杂,通常在F1植株的穗上就存在明显的单粒(F2种子)分离,这使得品质性状的遗传研究较为困难。针对胚乳性状遗传的复杂性,莫惠栋等[5,19]提出了经典的胚乳三倍体遗传模型,基于该模型,其不仅对控制胚乳性状的主效基因的基因型组成和效用进行了推导,同时也对微效基因进行了质量–数量性状遗传基因效应的推导,该模型是后续品质性状遗传和效应研究的重要基础。
稻米品质性状涉及多方面,包括粒形、垩白、直链淀粉含量(Amylose content, AC)、胶稠度(Gel consistency, GC)、糊化温度(Gelatinization temperature, GT)和蛋白质含量(Protein content, PC)等[1,8]。其中粒形是影响稻米碾磨加工品质和外观品质的重要因素,该性状的遗传规律比较明确,其主要受核基因控制。由于粒形调控基因众多且存在复杂的互作关系,早期的研究发现其受单基因、双基因、多基因或微效多基因控制,因而早期以QTL定位研究为主[20~22]。近些年来的研究则多通过突变体或在遗传背景差异较小的遗传群体中开展粒形相关基因的遗传分析、基因定位和克隆等研究[23]。
稻米垩白是影响稻米外观和定级的重要因素,其遗传调控非常复杂,受基因和环境的复合调控。因此,垩白性状的遗传调控研究进展较为缓慢,早期的研究主要以垩白相关QTLs的遗传定位为主[24,25]。基于转录组的研究表明该性状涉及多条代谢通路的互作[26,27]。近些年来,围绕稻米垩白性状的极端类型,如粉质胚乳开展了较多研究,其多为单基因控制的性状,遗传规律简单,通过图位克隆方法即可鉴定突变基因。目前已经定位和克隆了超过16个粉质胚乳相关的基因[28]。
稻米AC、GC和GT是评价蒸煮食味品质的关键指标,这些性状主要由三倍体胚乳的基因型决定,但是每个性状涉及的遗传模式又存在一定区别。其中AC是最重要的指标,其与稻米外观(透明度)、米饭质地、米饭食味和消化特性等性状密切相关(图1A)。AC的调控基因是较早被克隆的[29],有关该性状的遗传效应已有很多研究,发现高AC相对糯稻或低AC表现为完全显性,但是相对中等AC表现为不完全显性遗传[30]。实际上稻米AC遗传调控非常复杂,除了主效基因外,还有很多微效基因位点调控AC[13,31]。稻米GC与米饭质地密切相关,其主要受显性单基因控制,但是基于不同遗传群体的研究表明也有一些微效位点参与GC的调控[32]。后来的研究表明基因是GC的主效调控位点,一些淀粉合成酶编码基因如、和也能微调GC[13]。稻米GT主要影响米饭的蒸煮时间,主要由同一基因位点的不同等位类型控制,基因的显性效应表现为高GT>中GT>低GT。除了主效基因外,还存在微效基因的修饰作用[33]。随后的研究证实可溶性淀粉合成酶II-3编码基因()是控制GT的主效基因,同时,、、和也参与了GT的调控[13]。
蛋白质含量(PC)既是评价稻米营养品质的重要指标,也是影响稻米蒸煮食味品质的重要因素。稻米中的储藏蛋白根据其溶解性的差异可分为碱溶性的谷蛋白(glutelin)、醇溶性的醇溶蛋白(prolamin)、盐溶性的球蛋白(globulin)和水溶性的白蛋白(albumin),其中的谷蛋白含量最高,占胚乳总蛋白的80%以上[34]。从稻米PC在品种间的分布看,其表现为连续分布,但从亚群分布看,籼型稻米的PC通常高于粳型稻米[35]。稻米PC的遗传调控也非常复杂,研究发现其表现为显性和细胞质效应,低PC对高PC为部分显性,除了几对主效基因外,一些微效基因也参与了PC的调控,其属于典型的由多基因控制的数量性状[36]。此外,研究发现PC与种植环境还存在复杂的互作,这进一步增加了开展PC遗传研究的难度[37~39]。因此,多年来围绕稻米PC的研究多集中在相关QTL位点的遗传定位方面。
随着水稻基因组重测序技术的发展和相关品质基因信息的丰富,利用分子标记开展稻米品质形成遗传调控网络的研究逐渐深入。早期的研究通常是利用分子标记对特定的品质性状进行遗传定位分析,这一类研究多以定位品质相关QTL为主,如上述涉及的AC以及米饭延伸等性状QTL的定位研究[32,37,38,40]。随后,基于等位基因特异分子标记的关联分析被用来研究不同淀粉合成相关基因的组合与稻米品质性状的关系。Tian等[13]系统分析了影响稻米蒸煮食味品质的淀粉合成酶相关基因()的组合效用,发现和能够协同调控AC、GC和GT,其中对AC和GC起主效作用,对GT是微效的。而对GT起主效作用,对AC和GC起微效作用。和分别对GC和GT发挥微效作用,和共同对GC和GT起微效作用,而、、和共同影响AC。在糯稻背景下,Yan等[41]进一步分析了不同单倍型与稻米淀粉粘滞性(RVA)特征值间的关系,表明不同之间也是通过互作来协同调控稻米的糊化特性。Fan等[42]利用近等基因系验证了的不同等位类型在籼稻背景下对稻米品质的影响,表明籼型来源的等位基因对稻米品质影响最大。此外,Li等[43]利用染色体片段代换系在8个环境下分析了稻米理化特性和蒸煮食味品质之间的关系,基于分子标记分析,检测到132个加性效应QTLs,其中56个QTLs能够被重复检出,并且存在典型的QTL簇。Zhao等[44]利用210个分子标记(部分等位基因特异标记)对253份水稻种质的11个品质性状进行了关联分析,在籼稻和粳稻中分别检测到33和30个位点与品质性状关联,其中多个位点与已知的淀粉合成酶相关基因存在重叠。Yao等[45]利用分子标记分析了Wx背景下可溶性淀粉合成酶基因的等位变异组合以及对稻米品质的效应,发现不同来源的和均对稻米品质指标如AC、GT和GC有显著的影响。上述研究表明稻米品质性状是由多基因多位点参与的复杂调控网络,并且各性状以及各调控位点间均存在明显的相关性,这为品质性状遗传调控网络的全面深入解析带来了挑战。
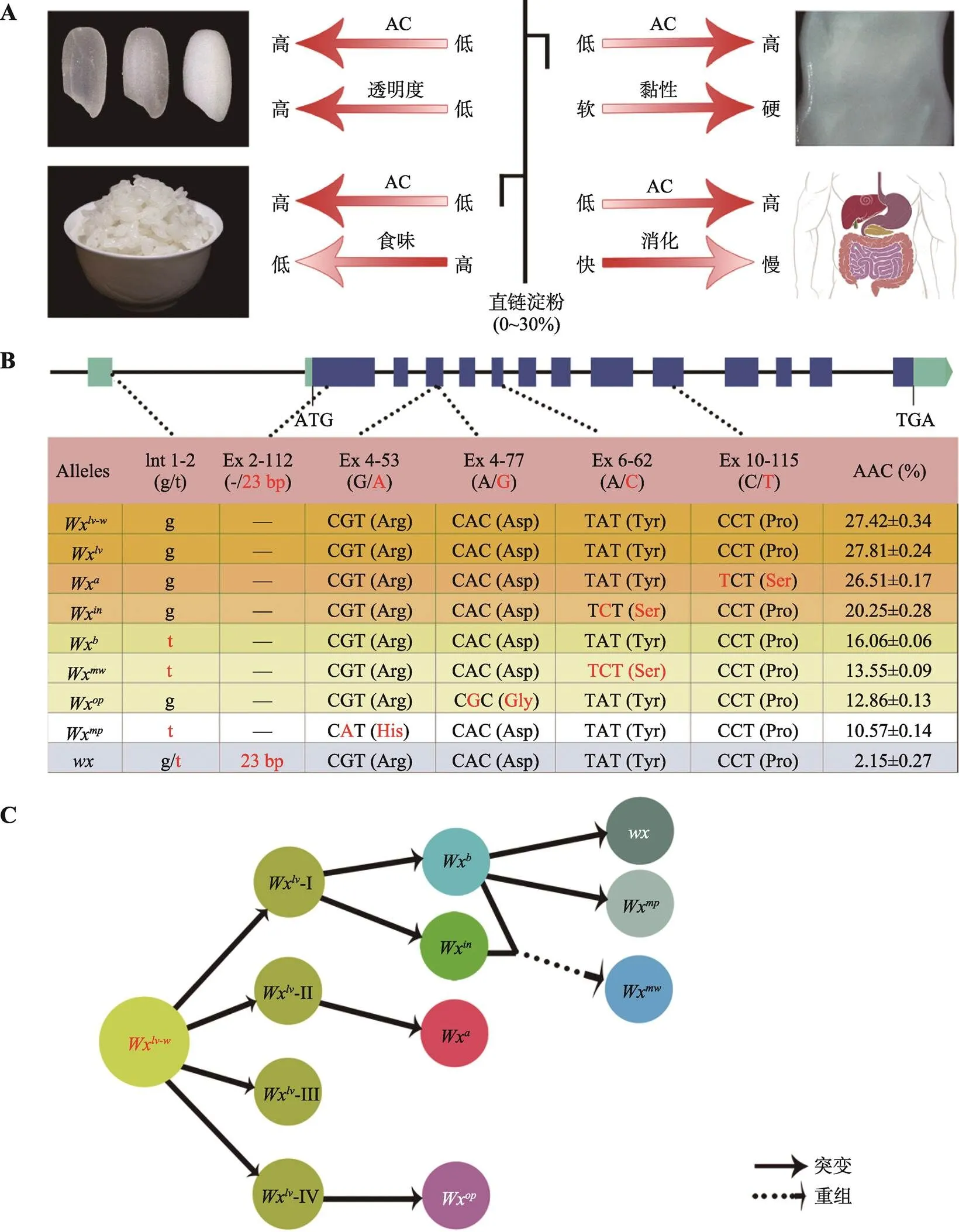
图1 水稻直链淀粉含量与稻米品质性状的相关性及Wx基因的等位变异和遗传分化
A:稻米直链淀粉含量与品质性状的相关性;B:基因的结构与功能等位变异类型;C:不同等位类型的可能演变途径;AC:直链淀粉含量(Amylose content);AAC:表观直链淀粉含量(Apparent amylose content)。
2 稻米蒸煮食味品质重要基因克隆
稻米蒸煮食味品质主要与香味、淀粉组成和结构等因素有关。在香味研究方面,Chen等[14]成功克隆了控制稻米香味物质2-乙酰-1-吡咯啉(2-AP)的基因,证明其为香味控制的主效基因。在稻米淀粉合成代谢方面的研究已有很多,大量的直接或间接参与淀粉合成调控的基因已经被克隆(表1)[8,46]。早期的研究多为利用转基因技术分析一些淀粉合成相关基因的效用,如利用反义RNA技术成功创建了系列低AC的水稻品系[16,47,48]。Wang等[49]通过对转基因系的品质分析,发现AC与稻米RVA谱存在密切的关联。此外,Zhang等[50]基于对基因编码蛋白GBSSI的定点修饰研究表明AC与稻米透明度和GT正相关。也有一些利用RNA干扰技术开展的研究,如Wei等[51~53]对和基因的下调表达,创建了高抗性淀粉水稻新品系;Li等[54]对在不同遗传背景下进行了下调表达,发现其与基因协同调控稻米蒸煮食味品质;Li等[55]也对进行了RNA干扰,创建了具有极低AC且稻米透明的新型优良食味软米,该研究为后续改良当下低AC半糯稻米的外观品质提供了重要线索。此外,也有对控制GT的()基因进行的RNA干扰研究,陈专专等[56]发现下调表达不同等位基因对稻米品质的影响存在明显区别。在进行遗传修饰研究的同时,也有一些对品质性状位点定位和克隆的研究。如Zhang等[31]利用染色体片段代换系鉴定了4个能在高温下提高基因剪切效率的QTLs。基于同一套染色体片段代换系,其又对在不同环境下能微调AC的位点进行了精细定 位[57]。Chen等[58]基于种质资源筛查和关联分析,鉴定了控制低GT的等位基因ALK,并利用近等基因系证明了其对稻米品质改良的潜在价值。此外,Chen等[59]进一步构建了同一背景下不同和等位基因的组合系,表明两者协同调控稻米蒸煮食味品质。Zhang等[60]在控制高GT的ALK近等基因系中鉴定了1个能够提高GT的ALK等位基因,证明其能够进一步提高稻米GT。Tang等[61]通过图位克隆技术克隆了控制籽粒灌浆的ADP葡萄糖焦磷酸化酶大亚基编码基因,发现其功能缺失会严重阻碍淀粉在胚乳中的积累。
基因是控制稻米直链淀粉含量的最重要基因。Liu等[15]通过图位克隆方式从一份云南软米种质中鉴定了Wx等位基因,发现其广泛分布在云南一带的优质软米品种中。目前该等位基因已在一些优质南方水稻品种选育中得到了广泛应用。Zhang等[62]通过种质资源筛查和图位克隆方式,鉴定了基因的祖先等位基因Wx,发现其广泛存在于野生稻中,证明当下栽培稻中的各种等位类型均由其通过不同突变方式进化而来,栽培稻中AC的广泛变异与不同的等位类型直接相关(图1,B和C)。此外,Zhang等[63]也克隆了一个稀有的等位基因Wx,发现其可能是在水稻驯化过程中由Wx和Wx同源重组而来;Wx所控制的AC为13%左右,其对稻米蒸煮食味品质和外观品质均有显著的改善效果。事实上,在水稻品质育种过程中,一些品种尤其是籼稻品种已经通过选择控制中低AC的Wx等位基因替代控制高AC的Wx等位基因完了品质的一次改良。在此过程中育种家可能忽略了Wx等位基因的作用,因为该基因在籼稻中也能较Wx显著改良稻米的蒸煮食味品质[64]。在基因克隆研究的同时,也有利用CRISPR/Cas9技术对品质基因编辑的探索,一些研究者针对基因启动子区的关键顺式作用元件和编码区功能位点进行了编辑,获得了多个微调AC的新等位类型[18,65,66]。
除了直接参与淀粉合成调控外,一些间接调控淀粉代谢或胚乳发育的基因也有很多被克隆(表1)。编码一个未知功能蛋白,其含有质体定位信号和淀粉结合结构域,突变后会造成明显的粉质表型,并且稻米总淀粉含量降低。进一步的分析表明该蛋白可能介导了异淀粉酶ISA1与淀粉粒的结合[67]。FLO7也编码一个未知功能蛋白,该蛋白定位于淀粉体基质中,功能缺失会造成显著的胚乳外周粉质表型,同时也会造成胚乳外周AC降低和支链淀粉结构改变[68]。Duan等[69]克隆了果糖6-磷酸1-磷酸转移酶β亚基编码基因,表明其突变会造成严重的粉质胚乳,粒厚和千粒重也显著下降。进一步的分析发现其可能通过调控糖代谢方式调控水稻胚乳淀粉积累OsBT1编码了一个ADP-葡萄糖转运蛋白,其定位在淀粉体质膜上,突变会造成明显的心白表型,同时也导致总淀粉和AC下降,其可能通过调控多个淀粉合成相关基因的表达参与淀粉代谢调控[70]。OsPKpα1编码一个丙酮酸激酶,该酶在淀粉体基质中发挥作用,突变体具有明显的心白,脂肪酸含量、总淀粉含量和AC均显著下降[71]。OsNDUFA9编码一个线粒体复合体I(泛醌氧化还原酶)亚基,其突变后不仅抑制种胚发育,还导致了粉质胚乳,总淀粉含量和千粒重均显著下降。随后的分析表明该基因是胚发育和淀粉积累所依赖的[72]。编码了一个质体定位的热休克蛋白OsHsp70cp-2,突变后导致明显的粉质胚乳,其可能通过与内膜转运复合体Tic共同调控淀粉体中蛋白的转运而影响胚乳淀粉积累[73]。编码一种与亲磷脂酸磷脂酶A1同源的磷脂酶样蛋白质,其定位于细胞质基质和细胞内膜。其突变会造成皱缩的粉质胚乳,胚乳中脂质和磷脂含量增加,总淀粉和AC显著下降。研究发现其可能通过调控胚乳中半乳糖脂的合成而参与脂质和淀粉代谢的协同调控[74]。编码一个依赖NAD的胞质苹果酸脱氢酶CMDH,其突变导致ATP含量降低,淀粉合成相关酶活性减弱,出现皱缩的粉质胚乳表型。过量表达该基因后能够显著增加胚乳淀粉的积累而增加粒量[28]。和是NAC转录因子家族成员,单基因的突变不影响淀粉的合成,但双突变后会造成严重的粉质表型,随后的分析表明2个基因可能通过调控一些淀粉和储藏蛋白合成而影响胚乳淀粉的积累[75]。在胚乳发育调控方面,Chen等[76]鉴定了对高温敏感的印记基因,发现其在胚乳发育早期的胚乳细胞化过程中发挥作用。E等[77]分析了水稻中8个胚乳特异表达的核因子NF-Ys,发现其可能以复合体的形式参与胚乳的发育进程,其中敲除后能够严重影响种子的灌浆造成皱缩的粉质表型。随后,Niu等[78]的研究证实转录因子能够与和互作调控种子发育早期的胚乳细胞化进程以及调控淀粉合成酶相关基因的表达。
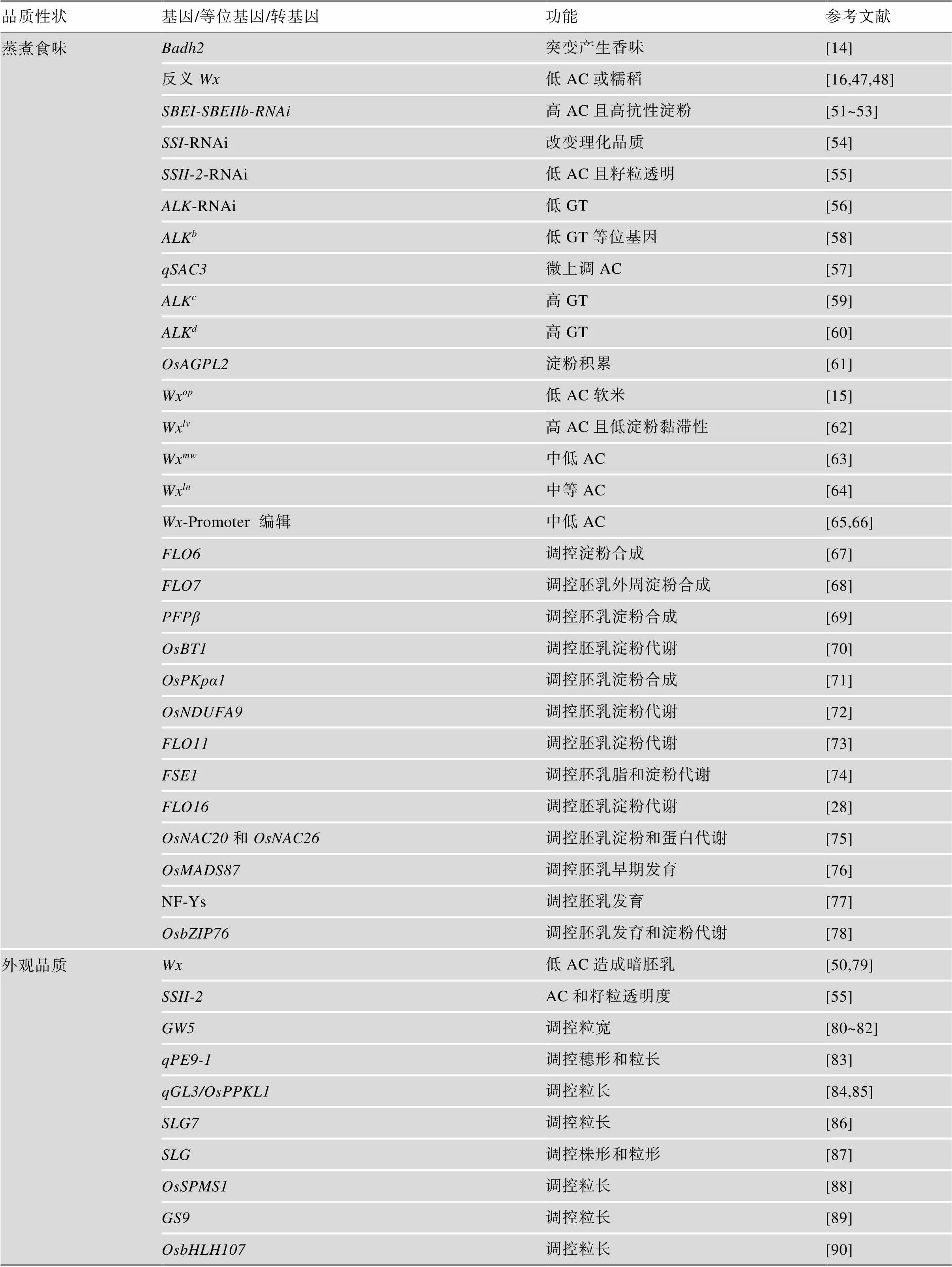
表1 已克隆的稻米品质性状重要基因及其应用研究

续表
3 稻米外观品质重要基因克隆
稻米外观品质主要涉及籽粒透明度和垩白,其中垩白又与粒形密切相关,一般细长籽粒的垩白粒率和垩白度较低。稻米透明度的形成较为复杂,目前可以明确的是稻米透明度与水分含量和AC密切相关,其中AC是最关键的影响因素。极端低AC的糯稻都是不透明的蜡质表型,而低AC的半糯类稻米(也称软米)多为暗胚乳或云雾状胚乳表型。通过淀粉粒断面扫描电镜观察,发现胚乳透明度与单个淀粉粒内部的空腔数目和大小有关,因此也是调控籽粒透明度的关键基因[50,79]。Li等[55]的研究发现下调表达后能够极显著的降低AC(低于半糯类稻米),但是其对应的籽粒透明度未改变,说明其可能在改良低AC半糯类稻米透明方面具有重要应用潜力。
近些年水稻粒形基因的克隆和遗传调控研究发展迅速,已经克隆了大量粒形相关基因,如、、、、、和等[23]。江苏在该领域的研究也取得了很多进展(表1)。Wan等[80]首先利用染色体片段代换系将控制粒宽和长宽比的主效QTL精细定位在很小的区间。Weng等[81]进一步克隆了该QTL即,发现存在于宽粒品种中的1212 bp缺失与粒宽性状关联。随后的研究表明GW5蛋白能与油菜素内酯信号途径中的一个关键激酶GSK2直接互作,其能够抑制GSK2下游两个转录因子BZR1和DLT的活性,使得非磷酸化状态的BZR1与DLT积累并进入细胞核中,调控BR下游响应基因表达,进而调控水稻粒型等生长发育过程[82]。编码一个功能未知的植物特有蛋白,主要在幼嫩组织中表达,该基因主要影响穗轴、一次和二次枝梗的伸长,不影响穗原基的发生,携带功能性的植株粒形变长[83]。是一个粒长负调控因子,其编码一个含Kelch结构域的PP2A蛋白磷酸酶(OsPPKL1),其通过调控细胞周期蛋白T1;3而控制籽粒大小[84]。随后的研究表明能够与GSK3/SHAGGY-Like家族激酶OsGSK3互作,后者又能与BR信号通路关键转录因子OsBZR1互作并通过磷酸化状态的改变来调控BR信号通路和水稻粒长[85]。也负调控籽粒长度,携带功能型的植株具有较长的籽粒,由于其主要调控粒长而不影响粒重,是稻米粒形和外观品质改良的有利基因资源[86]。SLG编码一个预测的类似BAHD酰基转移酶蛋白,是维持油菜素内酯平衡的一个重要调控因子,以同聚体形式发挥功能。其功能缺失突变体植株籽粒变窄,叶倾角变大[87]。是亚精胺合酶编码基因之一,其下调表达后能够显著增加粒长,也能提高单株产量[88]。编码一种未知保守功能域的蛋白,其通过调控细胞分裂来调节粒形。蛋白互作分析表明GS9蛋白和卵形家族蛋白OsOFP14和OsOFP8之间能够互作并且受OsGSK2激酶调节,该基因独立于已知的稻米粒形调控通路,能够与和基因叠加来调控稻米粒形,是培育细长型稻米的重要基因资源[89]。OsbHLH107是一个核定位的转录因子,其过量表达能够通过增加籽粒长轴上细胞的数目来增加粒长,而敲除该基因后会导致较短的籽粒[90]。编码水稻B类型G蛋白的γ亚基,其主要通过GA途径负调控粒形,突变体籽粒在增长的同时粒重也显著增加[91]。赤霉素诱导表达基因是赤霉素应答的正调控因子,下调表达该基因会造成株高、粒长和产量下降,而过量表达后能够显著增加株高、粒长和粒宽[92]。编码液泡转化酶的基因主要在液泡腔内发挥作用,其通过调控糖转运和淀粉积累等方式影响植株粒形和产量[93]。Lan等[94]的研究发现转录因子OsWRKY36能够增强SLR1 (GA信号抑制因子)的转录,并且能够防止SLR1通过GA途径被降解,从而调控株高和粒形。Cheng等[95]发现水稻中不依赖于受精的胚乳自主发生基因和在调控种子发育中的功能发生了分化,过量表达或者敲除均能够导致种子变小,而敲除造成胚乳细胞化受阻而无法正常发育。在粒形基因克隆的同时,Zhang等[96]根据14个粒形基因的功能位点开发了21个基于凝胶电泳的功能性分子标记对这些基因进行了分型和群体检测,这为后续水稻粒形和外观品质改良提供了有用的分子标记资源。
4 稻米营养品质重要基因克隆
稻米营养品质的一些研究多以蛋白质和氨基酸代谢调控为主。蛋白质代谢主要涉及蛋白质含量和转运调控两方面,其中又以谷蛋白的研究为主,已经克隆了一批相关调控基因(表1)。在谷蛋白含量调控方面,早期的研究集中在低谷蛋白含量基因位点的遗传定位分析,如Jiang等[97]从168个品种中筛选获得了3个低谷蛋白突变体W3660、W204和W379。Wang等[98]进一步对W3660中控制低谷蛋白含量的位点进行了精细定位,发现的下调表达可能是造成低谷蛋白的重要原因。Yang等[99]利用染色体片段代换系精细定位了PC含量QTL,发现来自籼稻Habataki的能够显著降低稻米PC随后,其利用另一套染色体片段代换系鉴定了2个稳定的PC调控QTLs,并证明OsGluA2是其中一个QTL位点的候选基因。进一步的分析发现OsGluA2启动子的一个SNP变异是造成品种间谷蛋白含量变异的重要原因[100]。此外,在谷蛋白转运调控方面克隆了很多基因。编码一个蛋白质二硫键异构酶,负责谷蛋白分子内和分子间二硫键的形成,其突变后导致谷蛋白不能从内质网(ER)输出,而影响种子发育[101]。/编码一个小分子量跨膜蛋白,其能与内衣被组分COPII (coat protein complex II)的Sec23蛋白互作调控COPII的组装,从而控制谷蛋白的ER输出[102]。编码一个内膜系统碱化因子,其通过对内膜系统pH值稳态调节参与蛋白前体致密囊泡(DV)的发生和靶向运输调控[103]。作为一个分子开关,通过与GTP结合态(活性态)和GDP结合态(非活性态)间的循环,调控谷蛋白囊泡的运输[104];而编码的bGPA2蛋白是GPA1的鸟核苷酸激活因子GEF (Guanine nucleotide exchange factor),其能够将非活性态的GPA1-GDP转化为活性态的GPA1-GTP[105];另外,编码的GPA3蛋白能与GPA2互作,负责招募GPA2于DV膜上,且GPA3-GPA2- GPA1形成复合体,协同调控谷蛋白的后高尔基体分选[106]。最近的研究发现了GPA1/Rab5a的效应蛋白GPA5,其为包含PHOX结构域的脂质结合蛋白,能够与PI(3)P磷脂特异结合,并通过与CORVET (class C core vacuole/endosome tethering)栓系复合体和SNARE (soluble NSF attachment protein receptor)蛋白VAMP721互作,介导DV囊泡与蛋白体PBII的膜融合[107]。
赖氨酸是稻米中的第一限制必需氨基酸,也是影响稻米营养品质的重要因素。在高等植物中赖氨酸主要通过天冬氨酸代谢通路合成,在该通路中有2个受反馈抑制调节的关键酶,即天冬氨酸激酶(AK)和二氢吡啶羧酸合酶(DHPS)。苏氨酸和赖氨酸能够反馈抑制的表达,赖氨酸单独也能抑制的表达。同时,当赖氨酸含量提高后,会增加赖氨酸分解关键酶赖氨酸-酮戊二酸还原酶/酵母氨酸脱氢酶(LKR/SDH)的活性而加快赖氨酸的降解[108]。因此,通过表达外源富含赖氨酸的蛋白或者针对內源基因进行反馈抑制遗传修饰是提高稻米赖氨酸含量的重要方式。Liu等[109]通过过量表达来自四棱豆中富含赖氨酸的基因,使得水稻种子赖氨酸含量提高了30%。Long等[110]在抑制/表达的同时,转入细菌来源的对反馈抑制不敏感的和,使得稻米中的自由赖基酸含量提高了60倍。Wong等[111]通过过量表达内源赖氨酸含量丰富的组蛋白RLRH1和RLRH2,使稻米赖氨酸含量提高了35%。Yang等[112,113]对获得的无选择标记的高赖氨酸水稻进行的品质评价和小鼠饲喂研究表明,高赖氨酸性状的获得对稻米其它品质指标影响较小,同时,高赖氨酸稻米对小鼠的生长和健康情况较为有利。此外,Yang等[114]通过代谢组等分析发现高赖氨酸水稻糙米的暗棕色的表型是由5-羟色胺的积累造成的,进一步的分析表明赖氨酸分解代谢中的2-氨基脂肪酸升高可能在茉莉酸信号通路和5-羟色胺积累之间的联系中起关键作用。近期,Yang等[115]对水稻内源的AK和DHPS进行了定点氨基酸修饰,发现修饰后的两个酶对赖氨酸的反馈抑制均降低;将其分别导入水稻中,发现其能够分别提高自由赖氨酸含量至6.6倍和21.7倍,而将其在/下调表达系共同表达后能够提高自由赖氨酸含量高达58.5倍。
5 江苏水稻品质分子遗传改良策略
江苏省水稻生产主要以粳稻为主。自2000年以来,在粳稻选育过程中开始重视稻米品质的改良,注意选用优质材料作为杂交育种的亲本。多年来育成了一批品质达到一级优质稻谷标准的品种。同时,在优良食味水稻培育方面更是形成了江苏特色品种,以“南粳”系列为代表的半糯粳稻品种多次在全国稻米食味品质评比中获奖。然而江苏水稻在国内外缺乏高端有影响力和竞争力的优质品种[2,17]。由于稻米品质本身由多个性状组成,各品质性状间、品质与环境以及品质与产量性状间均存在复杂的互作关系,这导致稻米品质的遗传改良中难以兼顾所有性状[8,39]。江苏半糯类稻米尽管食味较好,由于其暗胚乳的特性导致了“好吃不好看”缺陷的存在。此外,江苏稻区在水稻灌浆期时有极端高温事件发生,这不仅造成了较高的稻米垩白而且也降低了稻米的食味品质[8,116]。当前江苏水稻优质育种的常用策略之一是借助分子标记有针对性的对半糯基因Wx进行辅助选择,同时也兼顾香味基因的分子标记辅助选择。从国内外优质稻米品种和品牌发展趋势来看,江苏水稻品质改良应当继续坚持推进当下的优良食味品种选育的特色路线,通过产业化和品牌化来不断加强特色品种的影响力。在此基础上,育种家应当重视当下特色品种的自身缺陷,一方面通过引入粒形调控基因如等能够适度拉长粒形的基因来降低稻米的垩白;另一方面,也应当尝试通过引入新的等位基因如Wx或者能够适度上调直链淀粉含量的基因位点如来微调稻米直链淀粉含量,在保证稻米优良食味品质的前提下进一步改善半糯类稻米的透明度。在常规水稻品种选育方面,育种家同样需要关注稻米的外观品质改良,同时,也可以尝试通过选择OsGluA2等能够调控稻米蛋白质含量的优异等位基因来培育具有较低蛋白质含量的品种来改善稻米食味品质。在其它方面,育种家也应当关注消费者对稻米多样化的需求,加强功能性品种如低谷蛋白水稻的培育和推广以满足特殊人群的需要。
6 结语与展望
育种技术的发展和优质新品种的培育为我国粮食安全和农业可持续发展提供了重要保障。随着分子遗传学的发展,基因组选择技术和转基因技术越来越成熟,一大批的品质基因被鉴定出来,稻米品质的遗传调控网络也越来越清晰。尽管传统的常规育种和分子标记辅助选择育种一直是水稻品质育种的主流方向,但是基于当下丰富的有利基因信息,开展分子设计育种,有针对性的实现稻米品质性状的精准改良是未来水稻品质遗传育种的发展方向。因此,江苏省的水稻品质遗传改良应立足于育种现实,一方面在已有基础上进一步对稻米品质进行升级,如针对半糯品种的暗胚乳缺陷,通过引入新的基因或利用基因编辑等技术在保证优良食味的前提下进一步提高稻米的透明度。另一方面,基于消费者多样化的需求,应努力推进具有特殊营养价值或特殊人群需求的功能性新品种的开发。
[1] Wu B, Hu W, Xing YZ. The history and prospect of rice genetic breeding in China., 2018, 40(10): 841–857.吴比, 胡伟, 邢永忠. 中国水稻遗传育种历程与展望, 遗传, 2018, 40(10): 841–857.
[2] Zhang CQ, Zhao DS, Li QF, Gu MH, Liu QQ. Progresses in research on cloning and functional analysis of key genes involving in rice grain quality., 2016, 49(22): 4267–4283.张昌泉, 赵冬生, 李钱峰, 顾铭洪, 刘巧泉. 稻米品质性状基因的克隆与功能研究进展.中国农业科学, 2016, 49(22): 4267–4283.
[3] Wang CL, Zhang YD, Zhu Z, Chen T, Zhao QY, Zhong WG, Yang J, Yao S, Zhou LH, Zhao L, Li YS. Research progress on the breeding of japonica super rice varieties in Jiangsu Province, China., 2017, 16(5): 992–999.
[4] Mo HD. Quality improvement of rice grain in China., 1993, 26(4): 8–14.莫惠栋. 我国稻米品质的改良. 中国农业科学, 1993, 26(4): 8–14.
[5] Mo HD, Xu CW. Genetic analysis for qualitative- quantitative traits III. Endosperm characters under triploid genetic control., 1994, 20(5): 513–519.莫惠栋, 徐辰武. 质量–数量性状的遗传分析Ⅲ. 受三倍体遗传控制的胚乳性状. 作物学报, 1994, 20(5): 513–519.
[6] Li X, Mo HD, Wang AM, Xu CW, Zhu YH, Yu HX. Genetic expression for quality traits of rice grain in japonica hybrids., 1999, 13(4): 197–204.李欣, 莫惠栋, 王安民, 徐辰武, 朱毅华, 于恒秀. 粳型杂种稻米品质性状的遗传表达. 中国水稻科学, 1999, 13(4): 1197–204.
[7] Fitzgerald MA, McCouch SR, Hall RD. Not just a grain of rice: the quest for quality., 2009, 14(3): 133–139.
[8] Zhou H, Xia D,He YQ. Rice grain quality-traditional traits for high quality rice and health-plus substances., 2020, 40(1): 1–17.
[9] Yan CJ, Xu CW, Yi CD, Liang GH, Zhu LH, Gu MH. Genetic analysis of gelatinization temperature in rice via microsatellite (SSR) markers., 2001, 28(11): 1002–1005.严长杰, 徐辰武, 裔传灯, 梁国华, 朱立煌, 顾铭洪. 利用SSR标记定位水稻糊化温度的QTLs. 遗传学报, 2001, 28(11): 1002–1005.
[10] Li ZF, Wan JM, Xia JF, Zhai HQ. Mapping quantitative trait loci underlying appearance quality of rice grains (L)., 2003,30(3): 251– 259.李泽福, 万建民, 夏加发, 翟虎渠. 水稻外观品质的数量性状基因位点分析. 遗传学报, 2003,30(3): 251– 259.
[11] Zhu CL, Jiang L, Zhang WW, Wang CM, Zhai HQ, Wan JM. Identifying QTLs for thermo-tolerance of amylose content and gel consistency in rice., 2006, 20(3): 248–252.朱昌兰, 江玲, 张文伟, 王春明, 翟虎渠, 万建民. 稻米直链淀粉含量和胶稠度对高温耐性的QTL分析. 中国水稻科学, 2006, 20(3): 248–252.
[12] Li Y, Wang JK, Qiu LJ, Ma YZ, Li XH, Wan JM. Crop molecular breeding in china: current status and perspectives., 2010, 36(9): 1425–1430.黎裕, 王建康, 邱丽娟, 马有志, 李新海, 万建民. 中国作物分子育种现状与发展前景. 作物学报, 2010, 36(9): 1425–1430.
[13] Tian ZX, Qian Q, Liu QQ, Yan MX, Liu XF, Yan CJ, Liu GF, Gao ZY, Tang SZ, Zeng DL, Wang YH, Yu JM, Gu MH, Li JY. Allelic diversities in rice starch biosynthesis lead to a diverse array of rice eating and cooking qualities., 2009, 106(51): 21760–21765.
[14] Chen SH, Yang Y, Shi WW, Ji Q, He F, Zhang ZD, Cheng ZK, Liu XN, Xu ML., encoding betaine aldehyde dehydrogenase, inhibits the biosynthesis of 2-acetyl-1-pyrroline, a major component in rice fragrance., 2008, 20(7): 1850–1861.
[15] Liu LL, Ma XD, Liu SJ, Zhu CL, Jiang L, Wang YH, Shen Y, Ren YL, Dong H, Chen LM, Liu X, Zhao ZG, Zhai HQ, Wan JM. Identification and characterization of a novelallele from a Yunnan rice landrace., 2009, 71(6): 609–626.
[16] Liu QQ, Wang ZY, Chen XH, Cai XL, Tang SZ, Yu HX, Zhang JL, Hong MM, Gu MH. Stable inheritance of the antisensegene in transgenic rice with reduced amylose level and improved quality., 2003, 12(1): 71–82.
[17] Zhao CF, Yue HL, Huang SJ, Zhou LH, Zhao L, Zhang YD, Chen T, Zhu Z, Zhao QY, Yao S, Liang WH, Lu K, Wang CL. Eating quality and physicochemical properties in nanjing rice varieties., 2019, 52(5): 909–920.赵春芳, 岳红亮, 黄双杰, 周丽慧, 赵凌, 张亚东, 陈涛, 朱镇, 赵庆勇, 姚姝, 梁文化, 路凯, 王才林. 南粳系列水稻品种的食味品质与稻米理化特性. 中国农业科学, 2019, 52(5): 909–920.
[18] Huang LC, Sreenivasulu N, Liu QQ.editing: Old meets new., 2020, 25(10): 963–966.
[19] Mo HD. Genetic models and generation means for endosperm traits., 1989, 16(2): 111– 117.莫惠栋. 胚乳性状的遗传模型和世代平均数. 遗传学报, 1989, 16(2): 111–117.
[20] Gong LH, Gao ZY, Ma BJ, Qian Q. Progress in genetic research into grain shape in rice., 2011, 46(6): 597–605.宫李辉, 高振宇, 马伯军, 钱前. 水稻粒形遗传的研究进展. 植物学报, 2011, 46(6): 597–605.
[21] Wan XY, Liu SJ, Wang CM, Jiang L, Zhai HQ, Atsushi Y, Wan JM. Stable expression of QTL for grain shape of milled rice (L.) using a CSSLs population., 2004, 31(11): 1275–1283.
[22] Wan XY, Wan JM, Jiang L, Wang JK, Zhai HQ, Weng JF, Wang HL, Lei CL, Wang JL, Zhang X, Cheng ZJ, Guo XP. QTL analysis for rice grain length and fine mapping of an identified QTL with stable and major effects., 2006, 112(7): 1258–1270.
[23] Azizi P, Osman M, Hanafi MM, Sahebi M, Rafii MY, Taheri S, Harikrishna JA, Tarinejad AR, Mat Sharani S, Yusuf MN. Molecular insights into the regulation of rice kernel elongation., 2019, 39(7): 904–923.
[24] Guo T, Liu XL, Wan XY, Weng JF, Liu SJ, Liu X, Chen MJ, Li JJ, Su N, Wu FQ, Cheng ZJ, Guo XP, Lei CL, Wang JL, Jiang L, Wan JM. Identification of a stable quantitative trait locus for percentage grains with white chalkiness in rice ()., 2011, 53(8): 598–607.
[25] Liu XL, Wan XY, Ma XD, Wan JM. Dissecting the genetic basis for the effect of rice chalkiness, amylose content, protein content, and rapid viscosity analyzer profile characteristics on the eating quality of cooked rice using the chromosome segment substitution line population across eight environments., 2011, 54(1): 64–80.
[26] Zhou LJ, Jiang L, Zhai HQ, Wan JM. Current status and strategies for improvement of rice grain chalkiness., 2009, 31(6): 563–572.周立军, 江玲, 翟虎渠, 万建民. 水稻垩白的研究现状与改良策略. 遗传, 2009, 31(6): 563–572.
[27] Liu XL, Guo T, Wan XY, Wang HY, Zhu MZ, Li AL, Su N, Shen YY, Mao BG, Zhai HQ, Mao L, Wan JM. Transcriptome analysis of grain-filling caryopses reveals involvement of multiple regulatory pathways in chalky grain formation in rice., 2010, 11: 730.
[28] Teng X, Zhong MS, Zhu XP, Wang CM, Ren YL, Wang YL, Zhang H, Jiang L, Wang D, Hao YY, Wu MM, Zhu JP, Zhang X, Guo XP, Wang YH, Wan JM. FLOURY ENDOSPERM16 encoding a NAD-dependent cytosolic malate dehydrogenase plays an important role in starch synthesis and seed development in rice., 2019, 17(10): 1914–1927.
[29] Wang ZY, Wu ZL, Xing YY, Zheng FG, Guo XL, Zhang WG, Hong MM. Nucleotide sequence of ricegene., 1990, 18(19): 5898.
[30] Xu CW, Mo HD, Ao Y. Maximum likelihood method for the qualitative-quantitative inheritance of endosperm traits and its application in the genetic analysis for amylose content inrice.,2000, 33(2): 23–29.徐辰武, 莫惠栋, 敖雁. 胚乳性状质量–数量遗传的极大似然鉴别方法及其应用. 中国农业科学, 2000, 33(2): 23–29.
[31] Zhang H, Duan L, Dai JS, Zhang CQ, Li J, Gu MH, Liu QQ, Zhu Y. Major QTLs reduce the deleterious effects of high temperature on rice amylose content by increasing splicing efficiency ofpre-mRNA., 2014, 127(2): 273–282.
[32] Huang ZL, Tan XL, Xu CW, Vanavichit A. Molecular mapping QTLs for gel consistency in rice (L.)., 2000, 33(6): 1–5.黄祖六, 谭学林, 徐辰武, Vanavichit A. 稻米胶稠度基因位点的标记和分析. 中国农业科学, 2000, 33(6): 1–5.
[33] Li X, Tang SZ. Inheritance of gelatinization temperature in japonica rice., 1995, 16(1): 15–20.李欣, 汤述翥. 粳稻米糊化温度的遗传研究. 江苏农学院学报, 1995, 16(1): 15–20.
[34] Liu QQ, Zhou LH, Wang HM, Gu MH. Advances on biosynthesis of rice seed storageproteins in molecular biology., 2008, 6(1): 1–15.刘巧泉, 周丽慧, 王红梅, 顾铭洪. 水稻种子贮藏蛋白合成的分子生物学研究进展. 分子植物育种, 2008, 6(1): 1–15.
[35] Zhou LH, Liu QQ, Zhang CQ, Xu Y, Tang SZ, Gu MH. Variation and distribution of seed storage protein content and composition among different rice varieties., 2009, 35(5): 884–891.周丽慧, 刘巧泉, 张昌泉, 徐勇, 汤述翥, 顾铭洪. 水稻种子蛋白质含量及组分在品种间的变异与分布. 作物学报, 2009, 35(5): 884–891.
[36] Xu CW, Zhang AH, Zhu QS. Genetic analysis of quality traits in rice crosses betweenand., 1996, 22(5): 530–534.徐辰武, 张爱红, 朱庆森. 籼粳杂交稻米品质性状的遗传分析. 作物学报, 1996, 22(5): 530–534.
[37] Weng JF, Wan XY, Wu XJ, Wang HL, Zhai HQ, Wan JM. Stable expression of QTL for AC and PC of milled rice (L) using a CSSL population., 2006, 32(1): 14–19.翁建锋, 万向元, 吴秀菊, 王海莲, 翟虎渠, 万建民. 利用CSSL群体研究稻米AC和PC相关QTL表达稳定性. 作物学报, 2006, 32(1): 14–19.
[38] Zhang WW, Bi JC, Chen LM, Zheng LN, Ji SL, Xia YM, Xie K, Zhao ZG, Wang YH, Liu LL, Jiang L, Wan JM. QTL mapping for crude protein and protein fraction contents in rice (L.)., 2008, 48(2): 539–547.
[39] Huang SJ, Zhao CF, Zhu Z, Zhou LH, Zheng QH, Wang CL. Characterization of eating quality and starch properties of twoalleles japonica rice cultivars under different nitrogen treatments.,2020, 19(4): 988–998.
[40] Wang CL. Substitutional mapping the cooked rice elongation by using chromosome segment substitution lines in rice., 2013, 4(13): 107–115.
[41] Yan CJ, Tian ZX, Fang YW, Yang YC, Li J, Zeng SY, Gu SL, Xu CW, Tang SZ, Gu MH. Genetic analysis of starch paste viscosity parameters in glutinous rice (L.)., 2011, 122(1): 63–76.
[42] Fan XY, Guo M, Li RD, Yang YH, Liu, M., Zhu Q, Tang SZ, Gu MH, Xu RG, Yan CJ. Allelic variations in the soluble starch synthase II gene family result in changes of grain quality and starch properties in rice (L.)., 2017, 155(1): 129–140.
[43] Li JJ, Zhang WW, Wu HK, Guo T, Liu XL, Wan XY, Jin JS, Hanh TTT, Thoa NTN, Chen MJ, Liu SJ, Chen LM, Liu X, Wang JK, Zhai HQ, Wan JM. Fine mapping of stable QTLs related to eating quality in rice (L.) by CSSLs harboring small target chromosomal segments., 2011, 61(4): 338–346.
[44] Zhao CF, Zhao L, Zhao QY, Chen T, Yao S, Zhu Z, Zhou LH, Nadaf AB, Liang WH, Lu K, Zhang YD, Wang CL. Genetic dissection of eating and cooking qualities in different subpopulations of cultivated rice (L.) through association mapping., 2020, 21(1): 119.
[45] Yao S, Zhang YD, Liu YQ, Zhao CF, Zhou LH, Chen T, Zhao QY, Pillay B, Wang CL. Effects of soluble starch synthase genes on eating and cooking quality in semi waxy japonica rice withWx., 2020, 2(1): 1–12.
[46] Zhu JH, Yu WW, Zhang CQ, Zhu YJ, Xu JL, Li EP, Gilbert RG, Liu QQ. New insights into amylose and amylopectin biosynthesis in rice endosperm., 2020, 230: 115656.
[47] Liu QQ, Yu HX, Chen XH, Cai XL, Tang SZ, Wang ZY, Gu MH. Field performance of transgenic indica hybrid rice with improved cooking and eating quality by down-regulation ofgene expression., 2005, 16(3): 199–208.
[48] Yu HX, Liu QQ, Xu L, Lu MF, Yang XJ, Gong ZY, Cai XL, Zhang YS, Zhang CQ, Wang ZY, Gu MH. Quality characteristics and field performance of selectable marker-free transgenic rice with antisensegene and improved quality derived from the elite parents of hybrid indica rice., 2009, 50(3): 370–375.
[49] Wang XQ, Yin LQ, Shen GZ, Xu L, Liu QQ. Determination of amylose content and its relationship with rva profile within genetically similar cultivars of rice (L. ssp.)., 2010, 9(8): 1101–1107.
[50] Zhang CQ, Chen SJ, Ren XY, Lu Y, Liu DR, Cai XL, Li QF, Gao JP, Liu QQ. Molecular structure and physicochemical properties of starches from rice with different amylose contents resulting from modification of OsGBSSI activity., 2017, 65(10): 2222–2232.
[51] Wei CX, Qin FL, Zhu LJ, Zhou WD, Chen YF, Wang YP, Gu MH, Liu QQ. Microstructure and ultrastructure of high-amylose rice resistant starch granules modified by antisense RNA inhibition of starch branching enzyme., 2010, 58(2): 1224–1232.
[52] Zhu LJ, Gu MH, Meng XL, Cheung SCK, Yu HX, Huang J, Sun Y, Shi YC, Liu QQ. High-amylose rice improves indices of animal health in normal and diabetic rats., 2012, 10(3): 353–362.
[53] Wang J, Hu P, Lin LS, Chen ZC, Liu QQ, Wei CX. Gradually decreasing Starch Branching Enzyme Expression is responsible for the formation of heterogeneous starch granules., 2018, 176(1): 582–595.
[54] Li QF, Liu XY, Zhang CQ, Jiang L, Ji , Zhong M, Fan XL, Gu MH, Liu QQ. Rice soluble starch synthase I: allelic variation, expression, function, and interaction with., 2018, 9: 1591.
[55] Li QF, Huang LC, Chu R, Li J, Jiang MY, Zhang CQ, Fan XL, Yu HX, Gu MH, Liu QQ. Down-regulation ofgene expression results in novel low-amylose rice with soft, transparent grains., 2018, 66(37): 9750–9760.
[56] Chen ZZ, Li XF, Zhong M, Ge JQ, Fan XL, Zhang CQ, Liu QQ. Grain quality as affected by down-regulation of expression of differentalleles in indica rice (L.)., 2019, 33(6): 513–522.陈专专, 李先锋, 仲敏, 葛家奇, 范晓磊, 张昌泉, 刘巧泉. 籼稻背景下抑制不同等位基因表达对稻米品质的影响. 中国水稻科学, 2019, 33(6): 513–522.
[57] Zhang H, Zhou LH, Xu H, Wang LC, Liu HJ, Zhang CQ, Li QF, Gu MH, Wang CL, Liu QQ, Zhu Y. Thelocus from indica rice effectively increases amylose content under a variety of conditions., 2019, 19(1): 275.
[58] Chen ZZ, Lu Y, Feng LH, Hao WZ, Li C, Yang Y, Fan XL, Li QF, Zhang CQ, Liu QQ. Genetic dissection and functional differentiation ofALKandALK, two natural alleles of thegene, responding to low gelatinization temperature in rice., 2020, 13(1): 39.
[59] Chen ZZ, Yang Y, Feng LH, Sun Y, Zhang CQ, Fan XL, Li QF, Liu QQ. Effects of different combinations ofandmain alleles on rice grain quality., 2020, 34(3): 228–236.陈专专, 杨勇, 冯琳皓, 孙晔, 张昌泉, 范晓磊, 李钱峰, 刘巧泉.与主要等位基因不同组合对稻米品质的影响. 中国水稻科学, 2020, 34(3): 228–236.
[60] Zhang CQ, Yang YY, Chen ZZ, Chen F, Pan LX, Lu Y, Li QF, Fan XL, Sun ZZ, Liu QQ. Characteristics of grain physicochemical properties and the starch structure in rice carrying a mutatedgene., 2020, 68(47): 13950–13959.
[61] Tang XJ, Peng C, Zhang J, Cai Y, You XM, Kong F, Yan HG, Wang GX, Wang L, Jin J, Chen WW, Chen XG, Ma J, Wang P, Jiang L, Zhang WW, Wan JM. ADP-glucose pyrophosphorylase large subunit 2 is essential for storage substance accumulation and subunit interactions in rice endosperm., 2016, 249: 70–83.
[62] Zhang CQ, Zhu JH, Chen SJ, Fan XL, Li QF, Lu Y, Wang M, Yu HX, Yi CD, Tang SZ, Gu MH, Liu QQ.Wx, the ancestral allele of ricegene., 2019, 12(8): 1157–1166.
[63] Zhang CQ, Yang Y, Chen SJ, Liu XJ, Zhu JH, Zhou LH, Lu Y, Li QF, Fan XL, Tang SZ, GuMH, Liu QQ. A rareallele coordinately improves rice eating and cooking quality and grain transparency., 2020. https://doi:10.1111/jipb. 13010.
[64] Yang Y, Lu Y, Guo SQ, Shi ZH, Zhao J, Fan XL, Li QF, Liu QQ, Zhang CQ. Improvement of rice eating quality and physicochemical properties by intro-gression ofWxallele in indica varieties., 2019, 45(11): 1628–1637.杨勇, 陆彦, 郭淑青, 石仲慧, 赵杰, 范晓磊, 李钱峰, 刘巧泉,张昌泉. 籼稻背景下导入Wx等位基因改良稻米食味和理化品质. 作物学报, 2019, 45(11): 1628– 1637.
[65] Huang LC, Li, QF, Zhang CQ, Chu R, Gu ZW, Tan HY, Zhao DS, Fan XL, Liu QQ. Creating novelalleles with fine-tuned amylose levels and improved grain quality in rice by promoter editing using CRISPR/Cas9 system., 2020, 18(11): 2164–2166.
[66] Xu Y, Lin QP, Li XF, Wang FQ, Chen ZH, Wang J, Li WQ, Fan FJ, Tao YJ, Jiang YJ, Wei XD, Zhang R, Zhu QH, Bu QY, Yang J, Gao CX. Fine-tuning the amylose content of rice by precise base editing of thegene., 2020, 19(1): 11–13.
[67] Peng C, Wang YH, Liu F, Ren YL, Zhou KN, Lv J, Zheng M, Zhao SL, Zhang L, Wang CM, Jiang L, Zhang X, Guo XP, Bao YQ, Wan JM.encodes a CBM48 domain-containing protein involved in compound granule formation and starch synthesis in rice endosperm., 2014, 77(6): 917–930.
[68] Zhang L, Ren YL, Lu BY, Yang CY, Feng ZM, Liu Z, Chen J, Ma WW, Wang Y, Yu XW, Wang YL, Zhang WW, Wang YH, Liu SJ, Wu FQ, Zhang X, Guo XP, Bao YQ, Jiang L, Wan JM.encodes a regulator of starch synthesis and amyloplast development essential for peripheral endosperm development in rice., 2016, 67(3): 633–647.
[69] Duan EC, Wang YH, Liu LL, Zhu JP, Zhong MS, Zhang H, Li SF, Ding BX, Zhang X, Guo XP, Jiang L, Wan JM. Pyrophosphate: fructose-6-phosphate 1-phosphotransferase (PFP) regulates carbon metabolism during grain filling in rice., 2016, 35(6): 1321–1331.
[70] Li SF, Wei XJ, Ren YL, Qiu JH, Jiao GA, Guo XP, Tang SQ, Wan JM, Hu PS.encodes an ADP-glucose transporter involved in starch synthesis and compound granule formation in rice endosperm., 2017, 7: 40124.
[71] Cai Y, Zhang WW, Jin J, Yang XM, You XM, Yan HG, Wang L, Chen J, Xu JH, Chen WW, Chen XG, Ma J, Tang XJ, Kong F, Zhu XP, Wang GX, Jiang L, Terzaghi W, Wang CM, Wan JM.encodes a plastidic pyruvate kinase that affects starch biosynthesis in the rice endosperm., 2018, 60(11): 1097–1118.
[72] Hu TT, Tian YL, Zhu JP, Wang YL, Jing RN, Lei J, Sun YL, Yu YF, Li JF, Chen XL, Zhu XP, Hao YY, Liu LL, Wang YH, Wan JM.encoding a mitochondrial complex I subunit is essential for embryo development and starch synthesis in rice., 2018, 37(12): 1667–1679.
[73] Zhu XP, Teng X, Wang YL, Hao YY, Jing RN, Wang YF, Liu Y, Zhu JP, Wu MM, Zhong MS, Chen XL, Zhang YY, Zhang WW, Wang CM, Wang YH, Wan JM.encoding a plastid heat shock protein 70 is essential for amyloplast development in rice., 2018, 277: 89–99.
[74] Long WH, Wang YL, Zhu SS, Jing W, Wang YH, Ren YL, Tian YL, Liu SJ, Liu X, Chen LM, Wang D, Zhong MS, Zhang YY, Hu TT, Zhu JP, Hao YY, Zhu XP, Zhang WW, Wang CM, Zhang WH, Wan JM. FLOURY SHRUNKEN ENDOSPERM1 connects phospholipid metabolism and amyloplast development in rice., 2018, 177(2): 698–712.
[75] Wang J, Chen ZC, Zhang Q, Meng SS, Wei CX. The NAC transcription factors OsNAC20 and OsNAC26 regulate starch and storage protein synthesis., 2020, 184(4): 1775–1791.
[76] Chen C, Begcy K, Liu K, Folsom JJ, Wang Z, Zhang C, Walia H. Heat stress yields a unique MADS box transcription factor in determining seed size and thermal sensitivity., 2016, 171(1): 606–622.
[77] E ZG, Li TT, Zhang HY, Liu ZH, Deng H, Sharma S, Wei XF, Wang L, Niu BX, Chen C. A group of nuclear factor Y transcription factors are sub-functionalized during endosperm development in monocots., 2018, 69(10): 2495–2510.
[78] Niu BX, Deng H, Li TT, Sharma S, Yun QB, Li QR, E ZG, Chen C. OsbZIP76 interacts with OsNF-YBs and regulates endosperm cellularization in rice (). J Integr Plant Biol, 2020, 62(12): 1983–1996.
[79] Zhang L, Zhao LL, Zhang J, Cai XL, Liu QQ, Wei CX. Relationships between transparency, amylose content, starch cavity, and moisture of brown rice kernels., 2019, 90: 102854.
[80] Wan XY, Weng JF, Zhai HQ, Wang JK, Lei CL, Liu XL, Guo T, Jiang L, Su N, Wan JM. Quantitative trait loci (QTL) analysis for rice grain width and fine mapping of an identified QTL allelein a recombination hotspot region on chromosome 5., 2008, 179(4): 2239–2252.
[81] Weng JF, Gu SH, Wan XY, Gao H, Guo T, Su N, Lei CL, Zhang X, Cheng ZJ, Guo XP, Wang JL, Jiang L, Zhai HQ, Wan JM. Isolation and initial characterization of, a major QTL associated with rice grain width and weight., 2008, 18(12): 1199–1209.
[82] Liu JF, Chen J, Zheng XM, Wu FQ, Lin QB, Heng YQ, Tian P, Cheng ZJ, Yu XW, Zhou KN, Zhang X, Guo XP, Wang JL, Wang HY, Wan JM.acts in the brassinosteroid signalling pathway to regulate grain width and weight in rice., 2017, 3: 17043.
[83] Zhou Y, Zhu JY, Li ZY, Yi CD, Liu J, Zhang HG, Tang SZ, Gu MH, Liang GH. Deletion in a quantitative trait geneassociated with panicle erectness improves plant architecture during rice domestication., 2009, 183(1): 315–324.
[84] Zhang XJ, Wang JF, Huang J, Lan HX, Wang CL, Yin CF, Wu YY, Tang HJ, Qian Q, Li JY, Zhang HS. Rare allele ofassociated with grain length causes extra-large grain and a significant yield increase in rice., 2012, 109(52): 21534–21539.
[85] Gao XY, Zhang JQ, Zhang XJ, Zhou J, Jiang ZS, Huang P, Tang ZB, Bao YM, Cheng JP, Tang HJ, Zhang WH, Zhang HS, Huang J. Rice qGL3/OsPPKL1 functions with the GSK3/SHAGGY-like kinase OsGSK3 to modulate brassinosteroid signaling., 2019, 31(5): 1077–1093.
[86] Zhou Y, Miao J, Gu HY, Peng XR, Leburu M, Yuan FH, Gu HW, Gao Y, Tao YJ, Zhu JY, Gong ZY, Yi CD, Gu MH, Yang ZF, Liang GH. Natural variations inregulate grain shape in rice., 2015, 201(4): 1591–1599.
[87] Feng ZM, Wu CY, Wang CM, Roh J, Zhang L, Chen J, Zhang SZ, Zhang H, Yang CY, Hu JL, You XM, Liu X, Yang XM, Guo XP, Zhang X, Wu FQ, Terzaghi W, Kim SK, Jiang L, Wan JM.controls grain size and leaf angle by modulating brassinosteroid homeostasis in rice., 2016, 67(14): 4241–4253.
[88] Tao YJ, Wang J, Miao J, Chen J, Wu SJ, Zhu JY, Zhang DP, Gu HW, Cui H, Shi SY, Xu MY, Yao YL, Gong ZY, Yang ZF, Gu MH, Zhou Y, Liang GH. The spermine synthase OsSPMS1 regulates seed germination, grain size, and yield., 2018, 178(4): 1522–1536.
[89] Zhao DS, Li QF, Zhang CQ, Zhang C, Yang QQ, Pan LX, Ren XY, Lu J, Gu MH, Liu QQ.acts as a transcriptional activator to regulate rice grain shape and appearance quality., 2018, 9(1): 1240.
[90] Yang XM, Ren YL, Cai Y, Niu M, Feng ZM, Jing RN, Mou CL, Liu X, Xiao LJ, Zhang X, Wu FQ, Guo XP, Jiang L, Wan JM. Overexpression of, a member of the basic helix-loop-helix transcription factor family, enhances grain size in rice (L.)., 2018, 11(1): 41.
[91] Miao J, Yang ZF, Zhang DP, Wang YZ, Xu MB, Zhou LH, Wang J, Wu SJ, Yao YL, Du X, Gu FF, Gong ZY, Gu MH, Liang GH, Zhou Y. Mutation of, which encodes a type B heterotrimeric G protein γ subunit, increases grain size and yield production in rice., 2019, 17(3): 650–664.
[92] Li XB, Shi SY, Tao QD, Tao YJ, Miao J, Peng XR, Li C, Yang ZF, Zhou Y, Liang GH.positively regulates grain size and yield in rice ()., 2019, 286: 17–27.
[93] Xu XY, Ren YL, Wang CM, Zhang H, Wang F, Chen J, Liu X, Zheng TH, Cai MH, Zeng ZQ, Zhou L, Zhu SS, Tang WJ, Wang JL, Guo XP, Jiang L, Chen SH, Wan JM.encodes a vacuolar acid invertase that affects grain size by altering sugar metabolism in rice., 2019, 38(10): 1273–1290.
[94] Lan J, Lin QB, Zhou CL, Ren YK, Liu X, Miao R, Jing RN, Mou CL, Nguyen T, Zhu XJ, Wang Q, Zhang X, Guo XP, Liu SJ, Jiang L, Wan JM. Small grain and semi-dwarf 3, a WRKY transcription factor, negatively regulates plant height and grain size by stabilizing SLR1 expression in rice., 2020, 104(4–5): 429–450.
[95] Cheng XJ, Pan MY, E ZG, Zhou Y, Niu BX, Chen C. Functional divergence of two duplicated Fertilization independent endosperm genes in rice with respect to seed development. Plant J, 2020, 104(1):124–137.
[96] Zhang L, Ma B, Bian Z, Li XY, Zhang CQ, Liu JY, Li Q, Liu QQ, He ZH. Grain size selection using novel functional markers targeting 14 genes in rice., 2020, 13(1): 63.
[97] Jiang SM, Zhu SS, Liu SJ, Jiang L, Wan JM. Screening and genetic analysis of rice glutelin mutant., 2003, 30(7): 641–645.江绍玫, 朱速松, 刘世家, 江玲, 徐朗莱, 万建民. 水稻谷蛋白突变体的筛选及遗传分析. 遗传学报, 2003, 30(7): 641–645.
[98] Wang YH, Liu SJ, Ji SL, Zhang WW, Wang CM, Jiang L, Wan JM. Fine mapping and marker-assisted selection (MAS) of a low glutelin content gene in rice., 2005, 15(8): 622–630.
[99] Yang YH, Guo M, Li RD, Shen L, Wang W, Liu M, Zhu Q, Hu Z, He QW, Xue Y, Tang SZ, Gu MH, Yan CJ. Identification of quantitative trait loci responsible for rice grain protein content using chromosome segment substitution lines and fine mapping ofin rice (L.)., 2015, 35(5): 1–9.
[100] Yang YH, Guo M, Sun SY, Zou YL, Yin SY, Liu YN, Tang SZ, Gu MH, Yang ZF, Yan CJ. Natural variation ofis involved in grain protein content regulation in rice., 2019, 10(1): 1949.
[101] Han XH, Wang YH, Liu X, Jiang L, Ren YL, Liu F, Peng C, Li JJ, Jin XM, Wu FQ, Wang JL, Guo XP, Zhang X, Cheng ZJ, Wan JM. The failure to express a protein disulphide isomerase-like protein results in a floury endosperm and an endoplasmic reticulum stress response in rice., 2012, 63(1): 121–130.
[102] Wang YH, Liu F, Ren YL, Wang YL, Liu X, Long WH, Wang D, Zhu JP, Zhu XP, Jing RN, Wu MM, Hao YY, Jiang L, Wang CM, Wang HY, Bao YQ, Wan JM. GOLGI TRANSPORT 1B regulates protein export from the endoplasmic reticulum in rice endosperm cells., 2016, 28(11): 2850–2865.
[103] Zhu JP, Ren YL, Wang YL, Liu F, Teng X, Zhang YY, Duan EC, Wu MM, Zhong MS, Hao YY, Zhu XP, Lei J, Wang YF, Yu YF, Pan T, Bao YQ, Wang YH, Wan JM. OsNHX5-mediated pH homeostasis is required for post-Golgi trafficking of seed storage proteins in rice endosperm cells., 2019, 19(1): 295.
[104] Wang YH, Ren YL, Liu X, Jiang L, Chen LM, Han XH, Jin MN, Liu SJ, Liu F, Lv J, Zhou KN, Su N, Bao YQ, Wan JM. OsRab5a regulates endomembrane organization and storage protein trafficking in rice endosperm cells., 2010, 64(5): 812–824.
[105] Liu F, Ren YL, Wang YH, Peng C, Zhou KN, Lv J, Guo XP, Zhang X, Zhong MS, Zhao SL, Jiang L, Wang HY, Bao YQ, Wan JM. OsVPS9A functions cooperatively with OsRAB5A to regulate post-Golgi dense vesicle- mediated storage protein trafficking to the protein storage vacuole in rice endosperm cells., 2013, 6(6): 1918–1932.
[106] Ren YL, Wang YH, Liu F, Zhou KN, Ding Y, Zhou F, Wang Y, Liu K, Gan L, Ma WW, Han XH, Zhang X, Guo XP, Wu FQ, Cheng ZJ, Wang JL, Lei CL, Lin QB, Jiang L, Wu CY, Bao YQ, Wang HY, Wan JM.encodes a regulator of post-Golgi vesicular traffic essential for vacuolar protein sorting in rice endosperm., 2014, 26(1): 410–425.
[107] Ren YL, Wang YH, Pan T, Wang YL, Wang YF, Gan L, Wei ZY, Wang F, Wu MM, Jing RN, Wang JC, Wan GX, Bao XH, Zhang BL, Zhang PC, Zhang Y, Ji Y, Lei CL, Zhang X, Cheng ZJ, Lin QB, Zhu SS, Zhao ZC, Wang J, Wu CY, Qiu LJ, Wang HY, Wan JM.Encodes a Rab5a effector required for post-golgi trafficking of rice storage proteins., 2020, 32(3): 758–777.
[108] Yang QQ, Zhao DS, Liu QQ. Connections between amino acid metabolisms in plants: lysine as an example., 2020, 11: 928.
[109] Liu X, Zhang CC, Wang XR, Liu QQ, Yuan DY, Pan G, Sun SSM, Tu JM. Development of high-lysine rice via endosperm-specific expression of a foreign LYSINE RICH PROTEIN gene., 2016, 16(1): 147.
[110] Long XH, Liu QQ, Chan ML, Wang Q, Sun SSM. Metabolic engineering and profiling of rice with increased lysine., 2013, 11(4): 490–501.
[111] Wong HW, Liu Q, Sun SSM. Biofortification of rice with lysine using endogenous histones., 2015, 87(3): 235–248.
[112] Yang QQ, Zhang CQ, Chan ML, Zhao DS, Chen JZ, Wang Q, Li QF, Yu HX, Gu MH, Sun SSM, Liu QQ. Biofortification of rice with the essential amino acid lysine: molecular characterization, nutritional evaluation, and field performance., 2016, 67(14): 4285– 4296.
[113] Yang QQ, Suen PK, Zhang CQ, Mak WS, Gu MH, Liu QQ, Sun SSM. Improved growth performance, food efficiency, and lysine availability in growing rats fed with lysine-biofortified rice., 2017, 7(1): 1389.
[114] Yang QQ, Zhao DS, Zhang CQ, Wu HY, Li QF, Gu MH, Sun SSM, Liu QQ. A connection between lysine and serotonin metabolism in rice endosperm., 2018, 176(3): 1965–1980.
[115] Yang QQ, Yu WH, Wu HY, Zhang CQ, Sun SSM, Liu QQ. Lysine biofortification in rice by modulating feedback inhibition of aspartate kinase and dihydrodipicolinate synthase., 2020. DOI: 10.1111/pbi.13478.
[116] Zhang CQ, Zhou LH, Zhu ZB, Lu HW, Zhou XZ, QianYT, Li QF, Lu Y, Gu MH, Liu QQ. Characterization of grain quality and starch fine structure of two Japonica rice () cultivars with good sensory properties at different temperatures during the filling stage., 2016, 64(20): 4048–4057.
Progress on inheritance and gene cloning for rice grain quality in Jiangsu province
Changquan Zhang, Linhao Feng, Minghong Gu, Qiaoquan Liu
In China, rice (L.) is a major cereal crop of great importance maintaining the food security and sustainable agricultural development. Jiangsu is one of the main provinces for rice production. After more than 40 years of development, the yield and quality of rice grain have made great progress. Rice grain quality is a complex trait involving production, processing, marketing and consumption of the grain. In this review, we summarize the progress on the genetic basis of main grain quality traits in the rice variety breeding in Jiangsu province and point out the achievement of each milestone.With a focus on the genetic regulation of grain appearance, eating and cooking quality and nutritional quality, we describe the classic genetic rules and molecular basis of rice grain quality traits and review the function of major genes that regulate corresponding traits. The genetics and improvement of grain quality achieved in Jiangsu province was highlighted on the domestic and international rice breeding programs.In particular, with the advance of breeding conception in terms of functional genomics and genetic regulatory networks, the specific molecular design for grain quality improvement will be the future direction of rice genetic breeding program of Jiangsu Province.
rice grain quality traits; inheritance; appearance quality; eating and cooking quality; nutritional quality
2020-11-28;
2021-01-29
国家自然科学基金(编号:31825019, 31872860);江苏省科技计划(编号:BE2018357, CX(20)3004)[Supported by the National Natural Science Foundation of China (Nos. 31825019, 31872860), and Programs from Jiangsu Government (Nos. BE2018357, CX(20)3004)]
张昌泉,博士,副教授,研究方向:水稻品质遗传改良。E-mail: cqzhang@yzu.edu.cn
刘巧泉,博士,教授,研究方向:水稻品质遗传改良。E-mail: qqliu@yzu.edu.cn
10.16288/j.yczz.20-324
2021/2/1 15:23:53
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210201.1134.009.html
(责任编委: 储成才)
