四种糖基化酰基血红蛋白色素的牢固度研究
2021-05-19梁欣梅安攀宇李燮昕李维张淼王鑫
梁欣梅,安攀宇,李燮昕,李维,张淼,王鑫
(1.四川旅游学院 食品学院,成都 610100;2.南昌大学 食品学院,南昌 330027)
现阶段的肉品加工常用亚硝酸盐使产品得到玫瑰红色[1-2]。但亚硝酸盐在酸性条件下会生成亚硝酸,其分解产生的亚硝基与胺反应产生致癌物亚硝胺[3-4],使产品的安全性降低。为满足健康生活的需要,寻找低硝或无硝的发色剂、着色剂用于食品加工中具有重要意义。
现已有研究人员对畜禽血液中的血红蛋白进行利用,研制出糖基化亚硝基血红蛋白,以部分取代亚硝酸盐的方式对产品进行着色,取得了一定成果[5-6]。但糖基化亚硝基血红蛋白热加工程度低、稳定性不佳、分散性不强,仍添加有亚硝酸盐,故其安全性和生产应用有待进一步研究[7]。
将糖基化亚硝基血红蛋白改进,以酰基取代亚硝基,制得的糖基化酰基血红蛋白成为新的亚硝酸盐替代物研究目标。朱培培[8]、杨慧娟等[9]、欧秀琼等[10]对糖基化酰基血红蛋白的制备、稳定性和在中式香肠中的应用进行了研究。结果表明,糖基化酰基血红蛋白用于香肠制品中能起到着色和降低亚硝酸盐残留量的作用,发展空间极大。
色素牢固度是指被染色对象经染色后色调稳定性或色素对环境变化的抵抗能力,是衡量色素品质的指标,其主要取决于色素的理化性质及被染色物质的性质[11]。现已有不少学者对糖基化酰基血红蛋白的制作及应用做出了研究,但对其牢固度却缺少探讨研究。对糖基化酰基血红蛋白的牢固度进行研究,有助于其加工应用的发展[12]。本实验研究了4种不同糖基的糖基化酰基血红蛋白的牢固度,了解其在不同环境条件下的稳定性,能为进一步开发利用这类色素提供理论依据。
1 材料与方法
1.1 器材及仪器
1.1.1 材料及试剂
猪血:市售,成都市龙泉驿区农贸市场。
柠檬酸三钠、甘油、ZnSO4、CuSO4、MgSO4:天津市致远化学试剂有限公司;所有试剂均为分析纯。
烟酰胺、D-异抗坏血酸钠、D-果糖、蔗糖、葡萄糖、壳聚糖:味多美食品配料有限公司;所用配料均为食品级。
1.1.2 实验仪器
JA2003电子天平 上海舜宇恒平科学仪器有限公司;pH-100A手持pH计、LC-LX-HR165A高速冷冻离心机、DE-101T磁力搅拌器 上海力辰仪器科技有限公司;FD-1A-50真空冷冻干燥机 上海贺帆仪器有限公司;752N紫外分光光度计 上海菁华有限公司;HH-420电热恒温水浴锅 上海天壹瑞有限公司。
1.2 实验设计及方法
1.2.1 糖基化酰基血红蛋白的制备
参照欧秀琼等的方法,略作改动。
1.2.1.1 原料预处理
新鲜猪血,加0.8%柠檬酸三钠作抗凝处理,3~6层纱布过滤除杂,放入4 ℃冰箱中冷藏,静置待用。
1.2.1.2 制备血细胞
静置后的猪血,用高速冷冻离心机在4000 r/min、15 min的条件下进行离心处理,去除上层血浆,得到血细胞。向血细胞中加入等体积蒸馏水,混匀搅拌约4 h,细胞壁破裂,释放出血红蛋白。加入1%的D-异抗坏血酸钠后将血红蛋白溶液放入-20 ℃条件下保藏备用。
1.2.1.3 酰基化
将冷冻的血红蛋白溶液于室温解冻,加10 mg/mL甘油、1%烟酰胺充分搅拌,用0.05%柠檬酸溶液调节pH至7左右,置于4 ℃、避光条件下反应24 h得到酰基化血红蛋白液。
1.2.1.4 糖基化
将酰基化血红蛋白液与0.5%的糖溶液等体积混匀(葡萄糖、蔗糖、果糖、壳聚糖),调节pH至7左右,在50 ℃条件下水浴保温10 min,得到糖基化酰基血红蛋白溶液。
1.2.1.5 冷冻干燥
将糖基化酰基血红蛋白溶液过滤,除去未反应及变性凝固的血红蛋白,分装后于-48 ℃条件下冻硬。冻硬后的溶液用真空冷冻干燥机进行干燥,得到糖基化酰基血红蛋白。
1.2.2 糖基化酰基血红蛋白色素牢固度研究
将据比尔定律A=a×b×c,吸光度与被测物质的含量呈线性关系,选用吸光度值的改变来表征糖基化酰基血红蛋白经不同理化步骤处理后所显现的各种理化性质的变化。紫外扫描图得到糖基化酰基血红蛋白的吸收峰,在540 nm波长下测定色素的吸光度,以吸光度变化来衡量糖基化酰基血红蛋白的牢固度[13]。
1.2.2.1 光照对糖基化酰基血红蛋白的影响
参照李飞等[14]研究光照对糖基化亚硝基血红蛋白稳定性影响的方法,略作改动。4种糖基化酰基血红蛋白各取3.0 g 2份置于塑封袋中,放入棕色玻璃广口瓶和透明玻璃广口瓶中,将棕色玻璃广口瓶置于室温黑暗条件下,透明玻璃广口瓶在同室温LED灯(距光源18 cm,5 W自然光)照射下储藏,观察其色泽变化情况。每隔一段时间各取适量制成质量分数为1%的溶液(0,3,6,9,12,15 d),10倍稀释后在波长为540 nm处红色物质存在吸收峰处测定其吸光度值。记录数据,每个样品重复测定3次取平均值,下同。
1.2.2.2 金属离子对糖基化酰基血红蛋白的影响
参照李飞研究金属离子对糖基化亚硝基血红蛋白稳定性影响的方法,略作改动。4种糖基化酰基血红蛋白各取0.2 g,分别与20 mL质量浓度为1.0 mg/mL的各类金属离子(MgSO4、ZnSO4、CuSO4)溶液混合均匀,密封后置于避光条件下,在不同时间点(0,0.5,1,1.5,2,2.5,3 h)观察样品的颜色变化,取上清液稀释10倍,于波长540 nm处测定吸光度值。
1.2.2.3 pH对糖基化酰基血红蛋白的影响
参照邢绍平等[15]研究pH对含蔗糖的糖基化亚硝基血红蛋白稳定性影响的方法,略作改动。取蒸馏水,用0.5 mol/L的氢氧化钠溶液和1 mol/L的盐酸溶液调节出不同pH值的溶液(5.0,6.0,7.0,8.0,9.0),用调节好pH值的溶剂配制出相应的质量分数为1%的糖基化酰基血红蛋白溶液,在室温条件下放置30 min后,观察溶液颜色变化,测其在540 nm处的吸光度值。
1.2.2.4 氧化剂对糖基化酰基血红蛋白的影响
参照郑立红研究氧化剂对亚硝基血红蛋白稳定性影响的方法,略作改动。在20 mL不同浓度的过氧化氢溶液中(H2O2浓度分别为0%、0.03%、0.3%、1%、1.5%、3%,按10倍变化来设置浓度差。通过前期预实验发现,因0.3%与3%浓度跨度过大,中间浓度变化影响无法反映,故在期间增设1%和1.5%便于观察吸光度值变化趋势),各加入0.2 g糖基化酰基血红蛋白,配成质量分数为1%的溶液。置于室温条件下制分别反应0,10,20,30,40,50,60 min后观察样品颜色变化,每个时间点取1 mL溶液做10倍稀释后,测其在540 nm下的吸光度值。
1.2.2.5 温度对糖基化酰基血红蛋白的影响
参照欧秀琼研究温度对糖基化酰基血红蛋白稳定性影响的方法,略作改动。将制得的4种糖基化酰基血红蛋白都配制成质量分数为5%的溶液,分别于40,50,70,90,100 ℃条件下水浴加热,并分别在加热时间为0,10,20,30 min时各取1 mL样品液,做102倍稀释后,于波长540 nm处测定溶液的吸光度值。
1.3 统计分析
1.3.1 溶液吸光度变化率计算
通过计算糖基化酰基血红蛋白溶液经条件处理前后的吸光度值变化率,可以反映出糖基化酰基血红蛋白键与键之间结合的牢固程度。吸光度变化率按下式计算:
1.3.2 吸光度值热图和层次聚类分析
对溶液的吸光度值制作热图并做层次聚类分析,可以对实验数据进行质量控制并直观地展现研究对象吸光度值的差异变化情况[16]。热图中通过设置不同颜色带随物质含量的变化而变化[17-18],可直观地反映出各样本组内或组间吸光度值的重复性及变化快慢等情况。
1.3.3 数据统计分析
每个样品实验重复3次,测定出的吸光度值结果均用平均值表示。采用软件IBM SPSS Statistics 23进行显著性差异分析,采用MeV软件制作热图并做聚类分析,图或表通过Microsoft Word和Microsoft Excel制作。
2 结果与分析
2.1 光照对糖基化酰基血红蛋白的影响
由图1~图4可知,光照条件下,随着时间的延长,4种糖基化酰基血红蛋白的吸光度值均呈现出下降趋势。这是因为受光照影响,糖基化酰基血红蛋白中的亚铁离子被氧化为高铁离子,故糖基化酰基血红蛋白出现由红色变为红褐色的现象,溶液中红色物质含量降低,褐色物质增加,由于褐色物质的吸光度吸收峰所需的波长与红色不同,故溶液在540 nm处的吸光度值降低。

图1 光照对壳聚糖糖基化酰基血红蛋白的影响Fig.1 The effect of light on chitosan glycosylated acyl-hemoglobin注:图中标注的不同字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),下同。字母下的数字下脚标表示不同的组别,例:“1”表示黑暗条件下吸光度差异性,“2”表示光照条件下吸光度差异性,下同。

图2 光照对葡萄糖糖基化酰基血红蛋白的影响Fig.2 The effect of light on glucose glycosylated acyl-hemoglobin

图3 光照对蔗糖糖基化酰基血红蛋白的影响Fig.3 The effect of light on sucrose glycosylated acyl-hemoglobin

图4 光照对果糖糖基化酰基血红蛋白的影响Fig.4 The effect of light on fructose glycosylated acyl-hemoglobin
由表1可知,光照15 d果糖糖基化酰基血红蛋白的吸光度变化率最小。结合图5,根据吸光度值变化对样品进行层次聚类分析,结果表明:将样品分为两类时,果糖糖基化酰基血红蛋白被单独归为一类,说明果糖糖基化酰基血红蛋白的吸光度值变化明显有别于另外3种糖基化酰基血红蛋白。热图中,顶端颜色带从左到右的颜色变化为由浅色带的白色逐渐转变为深色带的黑色,表明吸光度值由小变大,稳定性由弱到强。随着光照时间的延长,壳聚糖、蔗糖、葡萄糖分别为糖源的糖基化酰基血红蛋白溶液吸光度值热图的颜色变化均由深色带跨越到浅色带,而果糖糖基化血红蛋白溶液的吸光度值热图颜色始终处于深色带,这可能是由于果糖为糖基的酰基血红蛋白结合形成的化学键更牢固,耐光性更强。则在光照条件下果糖糖基化酰基血红蛋白的牢固度明显优于另外3种糖基化酰基血红蛋白,较另外3种溶液的吸光度值,其下降幅度最小。

表1 光照对4种糖基化酰基血红蛋白溶液吸光度值变化率的影响Table 1 The effect of light on the change rates of absorbance values of four glycosylated acyl-hemoglobin solution
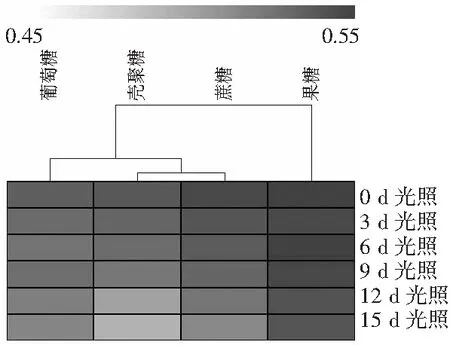
图5 光照条件下4种糖基化酰基血红蛋白牢固度比较Fig.5 The comparison of stability of four glycosylated acyl-hemoglobins under light conditions注:颜色指示带上下限值的选择依据软件分析结果来设定,下同。
由图1~图4和图6可知,随着时间的延长,在黑暗条件下4种糖基化酰基血红蛋白溶液的吸光度值均无大幅度下降,热图颜色变化均处于深色带。结合表1可知,4种糖基化酰基血红蛋白在黑暗条件下吸光率的变化幅度均较小,故4种糖基化酰基血红蛋白均可在避光条件下稳定保藏。

图6 避光条件下4种糖基化酰基血红蛋白牢固度的比较Fig.6 The comparison of stability of four glycosylated acyl-hemoglobins under dark conditions
综上所述,4种糖基化酰基血红蛋白在黑暗条件下性质稳定,牢固度较好;在光照条件下果糖糖基化酰基血红蛋白稳定性良好,牢固度最佳。
2.2 金属离子对糖基化酰基血红蛋白的影响
由图7~图14可知,在0 h处,测定各溶液的吸光度值存在较大差异,由此可见带重金属离子的盐溶液对糖基化酰基血红蛋白的溶解度有影响,且因金属离子种类不同影响大小各异;此外,不同金属离子与糖基化酰基血红蛋白的反应速率可能存在差异,也会造成吸光度值差异。

表2 金属离子对4种糖基化酰基血红蛋白溶液吸光度值变化率的影响Table 2 The effect of different metal ions on the change rates of absorbance values of four glycosylated acyl-hemoglobin solution

图7 金属离子对壳聚糖糖基化酰基血红蛋白的影响Fig.7 The effect of different metal ions on chitosan glycosylated acyl-hemoglobin注:图中标注的不同字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),下同。字母下的数字下脚标表示不同的组别,例:“1”表示镁离子条件下吸光度差异性,“2”表示无金属离子条件下吸光度差异性,“3”表示铜离子条件下吸光度差异性,“4”表示锌离子条件下吸光度差异性,下同。

图8 金属离子对葡萄糖糖基化酰基血红蛋白的影响Fig.8 The effect of different metal ions on glucose glycosylated acyl-hemoglobin

图9 金属离子对蔗糖糖基化酰基血红蛋白的影响Fig.9 The effect of different metal ions on sucrose glycosylated acyl-hemoglobin

图10 金属离子对果糖糖基化酰基血红蛋白的影响Fig.10 The effect of different metal ions on fructose glycosylated acyl-hemoglobin
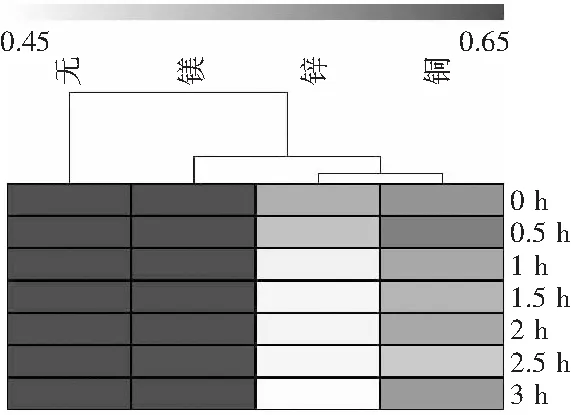
图11 金属离子对壳聚糖糖基化酰基血红蛋白稳定性的影响Fig.11 The effect of different metal ions on the stability of chitosan glycosylated acyl-hemoglobin

图12 金属离子对葡萄糖糖基化酰基血红蛋白稳定性的影响Fig.12 The effect of different metal ions on the stability of glucose glycosylated acyl-hemoglobin

图13 金属离子对蔗糖糖基化酰基血红蛋白稳定性的影响Fig.13 The effect of different metal ions on the stability of sucrose glycosylated acyl-hemoglobin

图14 金属离子对果糖糖基化酰基血红蛋白稳定性的影响Fig.14 The effect of different metal ions on the stability of fructose glycosylated acyl-hemoglobin
由图7~图11可知,对于4种不同糖源糖基化的血红蛋白而言,带Cu2+和Zn2+的溶液吸光度值在起始位置处远低于对照组;再结合图12~图14,在同样的吸光度值颜色变化带内,带Cu2+和Zn2+的溶液吸光度值的热图颜色变化均处于吸光度值较低的灰白色带内。故Cu2+和Zn2+对糖基化酰基血红蛋白的溶解度影响很大,使糖基化酰基血红蛋白的溶解度降低,牢固度下降,稳定性变差。
由图7~图11可知,带Mg2+的溶液中,其0 h的吸光度值与对照组基本无异,但随着时间的延长,受Mg2+的影响,溶解在溶液中的溶质逐渐被分解,吸光度值趋于下降趋势。由图12~图14可知,热图显示虽受Mg2+影响溶液的吸光度值有起伏波动,但整个实验过程中热图的颜色变化与对照组相似,始终处于黑灰色吸光度值较高的颜色带,由此可知4种糖基化酰基血红蛋白对Mg2+的耐受能力较好,对其牢固度影响较小。
综上所述,Cu2+和Zn2+对4种糖基化酰基血红蛋白的牢固度影响较大,生产过程中要避免加入;对Mg2+的耐受能力更佳,对比热图发现蔗糖糖基化酰基血红蛋白和壳聚糖糖基化酰基血红蛋白对Mg2+的耐受能力更强,对牢固度影响最小,溶质分解度更小。
2.3 pH对糖基化酰基血红蛋白的影响
就蛋白质的稳定性而言,pH的变化会对其造成影响。当溶液的pH达到蛋白质的等电点时,蛋白质所带净电荷会变为零,降低静电斥力,此时疏水性强的蛋白质分子物质就会相互吸引,形成沉淀析出,溶质的溶解度下降。
由图15可知,当pH在5~9变化时,壳聚糖糖基化酰基血红蛋白和葡萄糖糖基化酰基血红蛋白随pH的变化吸光度值波动幅度较大。对于蔗糖糖基化酰基血红蛋白溶液和果糖糖基化酰基血红蛋白溶液,随着pH的变化,溶液吸光度值变化平缓,无明显的波峰或波谷,可见这两种糖基化酰基血红蛋白无论在何种酸碱环境下其溶解度变化都不大,稳定性良好。

图15 pH对4种糖基化酰基血红蛋白的影响Fig.15 The effect of pH value on four glycosylated acyl-hemoglobins注:图中标注的不同字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),下同。字母下的数字下脚标表示不同的组别,例:“1”表示壳聚糖类吸光度差异性,“2”表示葡萄糖类吸光度差异性,“3”表示蔗糖类吸光度差异性,“4”表示果糖类吸光度差异性。
由图16可知,样品作聚类分析分为三类时,果糖糖基化酰基血红蛋白和蔗糖糖基化酰基血红蛋白被归为一类,另两种分别为一类。从热图颜色带的变化可以看出,果糖糖基化酰基血红蛋白和蔗糖糖基化酰基血红蛋白的稳定性更佳,其中蔗糖糖基化酰基血红蛋白的吸光度值热图颜色变化在整个实验过程中均处于高水平的黑灰色带,则其稳定性是4种糖基化酰基血红蛋白中最佳的。热图显示:壳聚糖糖基化酰基血红蛋白和葡萄糖糖基化酰基血红蛋白的颜色变化带很宽,从黑灰色带跨越至灰白色带,故这两种糖基化酰基血红蛋白随pH值的变化对牢固度的影响明显,极不稳定。

图16 pH对4种糖基化酰基血红蛋白牢固度的影响Fig.16 The effect of pH value on the stability of four glycosylated acyl-hemoglobins
2.4 氧化剂对糖基化酰基血红蛋白的影响
综上所述,对于糖基化酰基血红蛋白,选取的糖基不同对不同pH的耐受能力也不同。就本实验中选取的4种糖基而言,蔗糖或果糖作为糖基优酰基血红蛋白的牢固度更佳,受酸碱环境变化的影响更小。
由图17~图20可知,反应时间相同时,随着H2O2的浓度增加,4种糖基化酰基血红蛋白溶液的吸光度值均变化较大,呈下降趋势。当H2O2的浓度一定时,随着反应时间的延长,不同浓度的H2O2条件下,溶液的吸光度值变化差异明显。结合表3,当H2O2的浓度在0%~0.3%时,随着反应时间的延长,4种糖基化酰基血红蛋白溶液的吸光度值变化均较小,稳定性良好。当H2O2浓度>0.3%时,随着反应时间的延长,吸光度值下降明显,变化率上升,溶液有沉淀析出,溶液颜色由红变黑,说明H2O2的浓度越大,反应时间越长,对4种糖基化酰基血红蛋白的牢固度影响越大。

图17 不同浓度H2O2溶液对壳聚糖糖基化酰基血红蛋白的影响Fig.17 The effect of H2O2 solution on chitosan glycosylated acyl-hemoglobin注:图中标注的不同字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),下同。字母下的数字下脚标表示不同的组别,例:“1”表示0%条件下吸光度差异性,“2”表示0.03%条件下吸光度差异性,“3”表示0.3%条件下吸光度差异性,依次编号,下同。

图18 不同浓度H2O2溶液对葡萄糖糖基化酰基血红蛋白的影响Fig.18 The effect of H2O2 solution on glucose glycosylated acyl-hemoglobin

图19 不同浓度H2O2溶液对蔗糖糖基化酰基血红蛋白的影响Fig.19 The effect of H2O2 solution on sucrose glycosylated acyl-hemoglobin

续 表
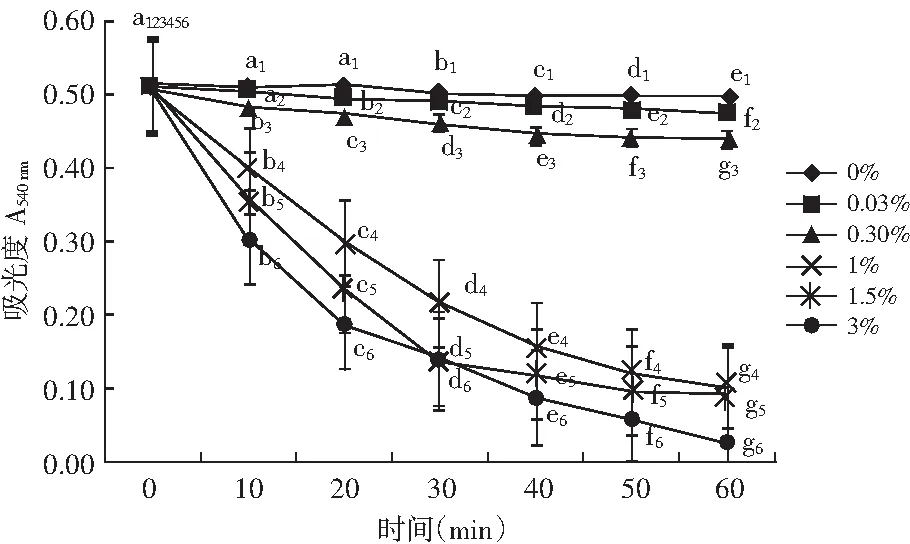
图20 不同浓度H2O2溶液对果糖糖基化酰基血红蛋白的影响Fig.20 The effect of H2O2 solution on fructose glycosylated acyl-hemoglobin

表3 不同浓度H2O2溶液对4种糖基化酰基血红蛋白溶液吸光度变化率的影响Table 3 The effect of H2O2 solution on the change rates of absorbance values of four glycosylated acyl-hemoglobin solution
结合图21~图24可知,对溶液中不同H2O2浓度处理的吸光度值结果做聚类分析,当分为两类时,0%、0.03%、0.3%被归为了一类,1%、1.5%、3%被归为了一类;热图结果显示,在0%~0.3%浓度范围内,吸光度值处于黑灰色带,而在1%~3%的浓度范围内,颜色变化跨越了整个颜色带,跨度较大,吸光度值降低迅速。

图21 不同浓度H2O2溶液对壳聚糖糖基化酰基血红蛋白溶液吸光度值的影响Fig.21 The effect of H2O2 solution on the absorbance values of chitosan glycosylated acyl-hemoglobin solution

图22 不同浓度H2O2溶液对葡萄糖糖基化酰基血红蛋白溶液吸光度值的影响Fig.22 The effect of H2O2 solution on the absorbance values of glucose glycosylated acyl-hemoglobin solution

图23 不同浓度H2O2溶液对蔗糖糖基化酰基血红蛋白溶液吸光度值的影响Fig.23 The effect of H2O2 solution on the absorbance values of sucrose glycosylated acyl-hemoglobin solution

图24 不同浓度H2O2溶液对果糖糖基化酰基血红蛋白溶液吸光度值的影响Fig.24 The effect of H2O2 solution on the absorbance values of fructose glycosylated acyl-hemoglobin solution
综上所述,氧化剂对糖基化酰基血红蛋白牢固度有影响,可能是因为血红蛋白分子与氧气结合,破坏了酰基化形成的化学键,化学键发生断裂,所以稳定性降低。结果显示:当H2O2在0%~0.3%范围内时,对4种糖基化酰基血红蛋白的牢固度影响较小,性质保持稳定,但当超过0.3%以后对化学键的破坏力度较大,牢固度迅速下降。故4种糖基化酰基血红蛋白有一定的抗氧化能力但不强,由此可知在生产运用时要尽量避免使用强氧化剂,同时储藏时要尽量达到在无氧条件下保藏。
2.5 温度对糖基化酰基血红蛋白的影响
由图25~图28可知,加热时间不变,加热温度的变化对4种糖基化酰基血红蛋白的影响明显。随着温度的升高,吸光度值先升高后降低,结果显示,在低于70 ℃范围内,4种溶液的吸光度值均较高。温度超过70 ℃后,吸光度值下降,主要是因为温度值达到了蛋白质变性温度,蛋白质发生变性凝固,溶液中出现红褐色沉淀,溶质减少,溶液的吸光度值降低。当温度不变时,随着加热时间延长,不同温度条件下溶液的吸光度值变化各异。

图25 不同温度对壳聚糖糖基化酰基血红蛋白的影响Fig.25 The effect of different temperatures on chitosan glycosylated acyl-hemoglobin注:图中标注的不同字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),下同。字母下的数字下脚标表示不同的组别,例:“1”表示40 ℃条件下吸光度差异性,“2”表示50 ℃条件下吸光度差异性,“3”表示70 ℃条件下吸光度差异性,依次编号,下同。

图26 不同温度对葡萄糖糖基化酰基血红蛋白的影响Fig.26 The effect of different temperatures on glucose glycosylated acyl-hemoglobin

图27 不同温度对蔗糖糖基化酰基血红蛋白的影响Fig.27 The effect of different temperatures on sucrose glycosylated acyl-hemoglobin

图28 不同温度对果糖糖基化酰基血红蛋白的影响Fig.28 The effect of different temperatures on fructose glycosylated acyl-hemoglobin
由表4可知,温度低于70 ℃时,随着加热时间的延长,溶液的吸光度值变化率较小,溶液的吸光度值稳定;当温度高于70 ℃时,随着加热时间的延长,蛋白质变性逐渐加剧,溶液的吸光度值随之下降,吸光度值变化率急剧增大,温度越高,变化率增加的幅度越大。
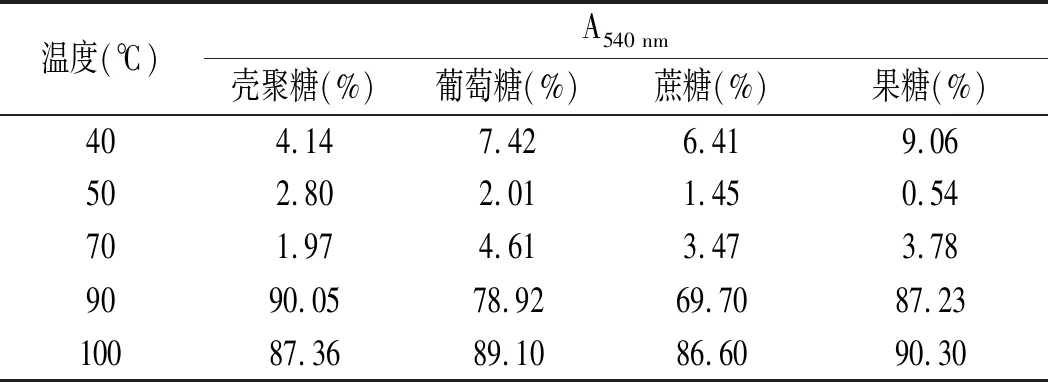
表4 不同加热温度对4种糖基化酰基血红蛋白溶液吸光度值变化率的影响Table 4 The effect of different temperatures on the change rates of absorbance values of four glycosylated acyl-hemoglobin solution
由图29~图32可知,对加热温度进行聚类分析分为两类时,40,50,70 ℃的结果被归为一类,另一类为90 ℃和100 ℃;热图的结果显示,在40~70 ℃的加热范围内,吸光度值处于较高水平的黑灰色带,而90 ℃和100 ℃的颜色带跨越度较大,由黑色跨至了白色,由此可知分为两类时40~70 ℃的加热范围内为糖基化酰基血红蛋白牢固度更佳、稳定性更好的一类。

图29 不同温度对壳聚糖糖基化酰基血红蛋白稳定性的影响Fig.29 The effect of different temperatures on the stability of chitosan glycosylated acyl-hemoglobin
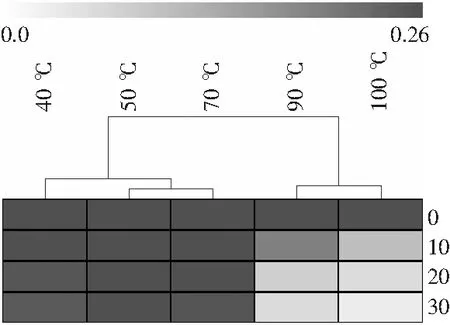
图30 不同温度对葡萄糖糖基化酰基血红蛋白稳定性的影响Fig.30 The effect of different temperatures on the stability of glucose glycosylated acyl-hemoglobin

图31 不同温度对蔗糖糖基化酰基血红蛋白稳定性的影响Fig.31 The effect of different temperatures on the stability of sucrose glycosylated acyl-hemoglobin

图32 不同温度对果糖糖基化酰基血红蛋白稳定性的影响Fig.32 The effect of different temperatures on the stability of fructose glycosylated acyl-hemoglobin
综上所述,温度对糖基化酰基血红蛋白的牢固度有显著影响,当温度低于70 ℃时,化学键结合牢固,稳定性良好;当温度高于70 ℃时,蛋白质易发生变性,溶液吸光度值降低。故糖基化酰基血红蛋白在一定的热加工时间内具有一定的耐热性,其加工温度不宜过高,由此可考虑在热加工完成后添加使用,这样产品着色效果会更佳。在石飞云等[19]关于亚硝基血红蛋白合成及其应用的研究中,关于温度选择的结论为不宜超过60 ℃;在何平关于糖基化亚硝基血红蛋白的合成及应用研究中显示温度为50 ℃时,吸光度最大,高于此温度时,产物的吸光度值下降;在王东等[20]关于新型肉制品着色剂亚硝基血红蛋白色素的研究中显示亚硝基血红蛋白色素具有一定耐热性,但建议在40 ℃以下使用。综上研究结论说明糖基化酰基血红蛋白的热处理温度更优于亚硝基血红蛋白。
3 结论
通过单因素实验对4种糖基化酰基血红蛋白的牢固度进行了考察。结果表明,经糖基化的酰基血红蛋白,血红蛋白的稳定性得到优化。使用不同的糖源作糖基,对酰基血红蛋白的牢固度会造成差异,结果如下:
4种糖基化酰基血红蛋白在黑暗条件下性质稳定;果糖糖基化酰基血红蛋白较另外3种血红蛋白在光照条件下共价键结合得更牢固稳定性更佳。故糖基化酰基血红蛋白宜在避光条件下储藏,如需在光照下使用,则以果糖糖基化酰基血红蛋白为佳。
Mg2+对4种糖基化酰基血红蛋白的溶解度和牢固度影响最小,除此之外,包括Cu2+和Zn2+在内的重金属离子在加工过程中应尽量避免接触。
pH对糖基化酰基血红蛋白的影响因糖基的不同而不同。本实验中选取的4种糖基,蔗糖或果糖为糖基的酰基血红蛋白受pH变化的影响小,其牢固度更佳。
H2O2在0%~0.3%的范围内时,对4种糖基化酰基血红蛋白的牢固度影响较小,故4种糖基化酰基血红蛋白有一定的抗氧化能力但不强,故生产运用时避免大量使用强氧化剂。
生产及加工温度<70 ℃时化学键结合最牢固,随着温度的升高、时间的延长,色素稳定性良好。
