罗非鱼皮蛋白多肽-Fe2+结合物的制备及性质分析
2021-05-19林善婷李来好杨贤庆陈胜军吴燕燕
林善婷,胡 晓,李来好,杨贤庆,陈胜军,吴燕燕,黄 卉,荣 辉
(1.南京农业大学无锡渔业学院,江苏 无锡 214081;2.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点研究室,广东 广州 510300)
罗非鱼(Oreochromis niloticus)因其具有生长快、病害少、肉质鲜美、蛋白质含量高等特点,是联合国粮农组织向世界各国推广的经济养殖鱼类之一。我国罗非鱼资源丰富,其养殖产量和出口量稳居世界前列[1]。然而,罗非鱼加工产品主要以冻全鱼和冷冻鱼片为主,产品结构单一,精深加工水平及高值化利用率不高,且罗非鱼加工过程中会产生约60%~70%的富含蛋白质的加工副产物,如鱼皮、鱼鳞、鱼头、鱼骨、鱼肉碎屑等,其加工副产物大多用作饲料、肥料或直接废弃,其优质的蛋白资源未得到充分开发与利用[2]。
铁元素是人体中血红素及大多数酶类的构成成分,参与氧气的运输及机体细胞代谢,在维持人体正常造血功能以及增强神经/免疫系统功能中起重要作用,当体内缺乏铁元素时易导致贫血、食欲不振、生长缓慢,尤其是孕期铁元素缺乏的孕妇易导致胎儿早产,增加母婴死亡风险等[3]。铁元素缺乏是世界上最常见且普遍的营养缺乏症,据世界卫生组织统计,在全球范围内,几乎一半的6~59 个月的儿童以及1/3的育龄妇女患有缺铁性贫血症[4]。
Fe2+结合活性肽是指具有结合Fe2+活性的肽类物质,其与Fe2+结合后形成的肽-Fe2+结合物,在肠道中可提高并保持Fe2+的溶解度,提高Fe2+在肠道中的生物利用度[5]。目前,已有研究证明鹰嘴豆[6]、核桃[7]、绿豆[8]以及蛋清[9]、酪蛋白[10]、鳕鱼皮[11-13]、鳀鱼肌肉[14]等蛋白酶解物多肽具有Fe2+结合活性,而对于罗非鱼皮酶解物多肽(tilapia skin protein peptides,TSPP)的Fe2+结合活性研究尚少。因此,本研究以罗非鱼加工副产物之一的罗非鱼皮为原料,制备Fe2+结合活性肽及其肽-Fe2+结合物,并探究其结合过程中结构和活性的变化,为进一步制备膳食铁元素补充剂打下基础,也可提高罗非鱼加工副产物的高值化利用率,提高我国罗非鱼产业的经济效益以及在国际市场上的竞争力。
1 材料与方法
1.1 材料与试剂
罗非鱼皮 广东百维生物科技有限公司;胰蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶、酪蛋白 合肥博美生物科技有限公司;菲啰嗪 上海阿拉丁生化科技股份有限公司;无水硫酸亚铁(FeSO4)、乙酸钠(CH3COONa)、冰醋酸(CH3COOH)、磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)(均为分析纯) 上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、溴化钾(KBr)(色谱级) 美国Sigma公司;ABTS总抗氧化能力测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
凯氏定氮仪 丹麦福斯分析仪器公司;水浴恒温振荡器 金坛市精达仪器制造厂;自动电位滴定仪 瑞士万通公司;SUNRISE吸光酶标仪 瑞士TECAN公司;荧光分光光度计 美国VARIAN公司;紫外-可见分光光度计、红外光谱仪、高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 TSPP的制备
鱼皮解冻洗净,参照Zhang Yufeng等[15]的方法并稍作修改,按1∶10(g/mL)的比例加入0.05 mol/L的NaOH溶液,室温下搅拌浸泡30 min后流水洗至中性,随后按1∶10(g/mL)的比例加入0.05 mol/L的HCl溶液,室温搅拌浸泡10 min后流水洗至中性,沥干,鱼皮打浆,浆液置于60 ℃恒温水浴加热5 h后,10 000 r/min离心20 min,取上清液,记下胶液的质量,凯氏定氮法测定胶液中蛋白含量。
取一定质量的罗非鱼皮胶液,加入质量分数2%(按胶液蛋白含量为基底)的蛋白酶,在其各自最优的酶解条件(表1)下酶解1、2、4、6、8 h,期间保持pH值稳定,酶解完成后沸水浴加热15 min灭酶,冷却后抽滤,10 000 r/min离心10 min,取上清液冷冻干燥即为TSPP。
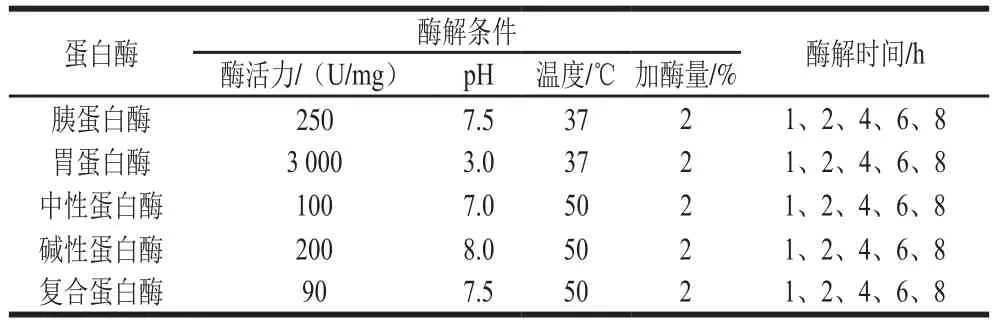
表1 不同蛋白酶的酶解条件Table 1 Optimal enzymatic conditions for the proteases tested in this study
1.3.2 水解度及Fe2+结合率的测定
利用凯氏定氮法测定鱼皮总氮质量M1(g),自动电位滴定法测定酶解液中氨基态氮的质量M2(g),水解度按式(1)计算:

Fe2+结合率通过菲咯嗪比色法测得,参照Wu Haohao等[14]的方法并稍作修改,利用乙酸钠缓冲液(0.2 mol/L,pH 5.0)配制5 mg/mL的样品溶液,取700 μL样品溶液与100 μL硫酸亚铁溶液(0.2 mmol/L)混合于96 孔板中,37 ℃保温2 h后,加入200 μL菲咯嗪溶液(5 mmol/L),室温下放置10 min后,用酶标仪读取562 nm波长处的吸光度,将酪蛋白的胰蛋白酶酶解物及谷胱甘肽作为阳性对照[14],Fe2+结合率按式(2)计算:
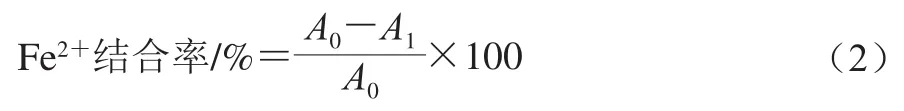
式中:A0为加等体积水的吸光度;A1为加样品后的吸光度。
1.3.3 TSPP与Fe2+结合条件的优化
以结合时间120 min、pH 5、温度37 ℃为基础结合条件,测定不同结合时间(15、30、60、90、120、150、180、210、240 min)、pH值(4、5、6、7)、温度(4、25、37、60 ℃)对结合率的影响。
1.3.4 TSPP与Fe2+结合过程中荧光光谱扫描
分别将在不同条件下完成结合反应的样品溶液进行荧光光谱扫描,激发波长为275 nm,发射光谱扫描范围为290~500 nm,间距为0.2 nm。
1.3.5 TSPP与TSPP-Fe2+结合物的紫外光谱扫描
分别将乙酸钠缓冲液(0.2 mol/L,pH 5)、0.2 mol/L的FeSO4溶液(过滤前后)、5 mg/mL的TSPP溶液、TSPP+FeSO4溶液(过滤前后)以及5 mg/mL的TSPP-Fe2+结合物溶液进行紫外光谱扫描。
1.3.6 TSPP及TSPP-Fe2+结合物的红外光谱扫描
分别将TSPP、TSPP-Fe2+结合物与溴化钾按1∶5的质量比进行研磨压片,进行红外光谱扫描。
1.3.7 分子质量分布的测定
采用高效体积排阻色谱法测定肽的分子质量分布,参照Guo Lidong等[12]方法并略作修改,流动相为乙腈(含0.1%三氟乙酸)-水(含0.1%三氟乙酸)体积比20∶80,检测波长为214 nm,进样体积20 μL(2 mg/mL),流速0.5 mL/min。不同相对分子质量标准样品(细胞色素C,Mr12 400;杆菌肽,Mr6 511.44;抑肽酶,Mr1 422.69;氧化型谷胱甘肽,Mr612.63;还原型谷胱甘肽,Mr307.3)用流动相配制成质量浓度为2 mg/mL的标准品混合液,0.22 μm微孔滤膜过滤后进样,将制备的混合标准品样品在色谱条件下分析,以相对保留时间(t)为横坐标,分子质量对数(lgMr)为纵坐标制作标准曲线,相同的条件下检测TSPP样品,根据样品的保留时间,对照标准曲线的结果,计算样品的分子质量分布。
1.3.8 氨基酸含量的测定
参考GB/T 5009.124—2003《食品中氨基酸的测定》。
1.3.9 TSPP及TSPP-Fe2+结合物抗氧化能力的测定
1.3.9.1 DPPH自由基清除能力的测定
参照Lu Xin等[16]方法并略作修改,准确吸取1.00 mL的TSPP样品溶液(5 mg/mL)与1.00 mL的DPPH-乙醇溶液(0.15 mmol/L,用95%的乙醇溶液溶解)混匀,在室温下避光反应30 min,于517 nm波长处测定溶液吸光度As,空白组为1 mL 95%乙醇溶液代替DPPH溶液,加入1 mL样液混合,在517 nm波长处测定吸光度Ab,对照组为1 mL的DPPH溶液加上1 mL 95%乙醇溶液,在517 nm波长处测定其吸光度Ac,以谷胱甘肽作阳性对照,DPPH自由基清除率按式(3)计算:
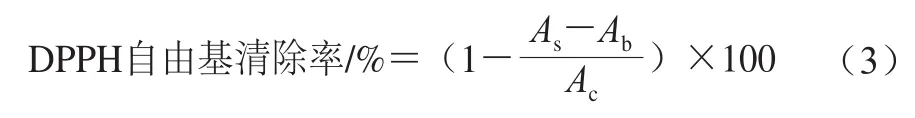
1.3.9.2 Trolox等效抗氧化能力的测定
参照试剂盒说明书测定样品的Trolox等效抗氧化能力。
1.4 数据统计与分析
实验数据使用SPSS 20.0 软件进行统计分析,结果用表示,结果间的差异性采用单因素方法分析(one-way ANOVA),随后进行Tukey多重比较,P<0.05,差异显著;采用Origin 9软件作图。
2 结果与分析
2.1 TSPP的Fe2+结合活性
由图1可知,在5 种蛋白酶作用下,罗非鱼皮蛋白水解度均随酶解时间的延长而逐渐增大。5 种蛋白酶对罗非鱼皮蛋白水解度由小到大依次为胃蛋白酶<胰蛋白酶<碱性蛋白酶<中性蛋白酶<复合蛋白酶,其中复合蛋白酶8 h的水解度最高,为26.39%。由图2可知,罗非鱼皮蛋白经胰蛋白酶酶解(1~8 h)得到的TSPP其Fe2+结合率均高于其他4 种蛋白酶的酶解物,且胰蛋白酶2 h的酶解物TSPP其Fe2+结合率最高((83.47±0.1)%),且显著高于酪蛋白酶解物(46.66±0.68)%和谷胱甘肽(17.71±0.46)%(P<0.05)。
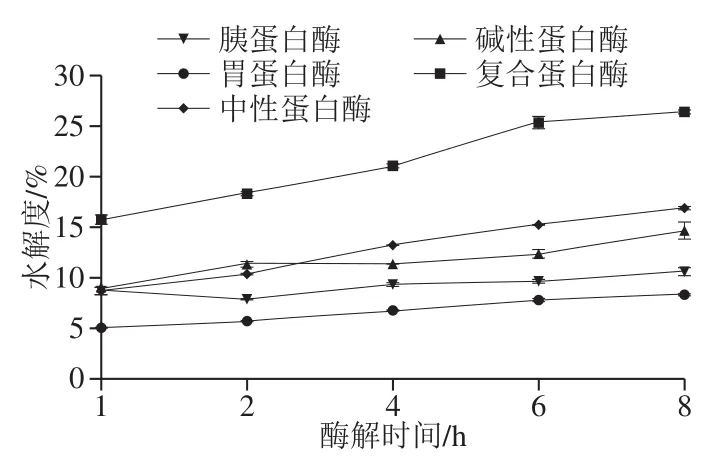
图1 不同蛋白酶的水解度随时间的变化Fig. 1 Changes in degree of hydrolysis of tilapia skin protein during hydrolysis with different proteases
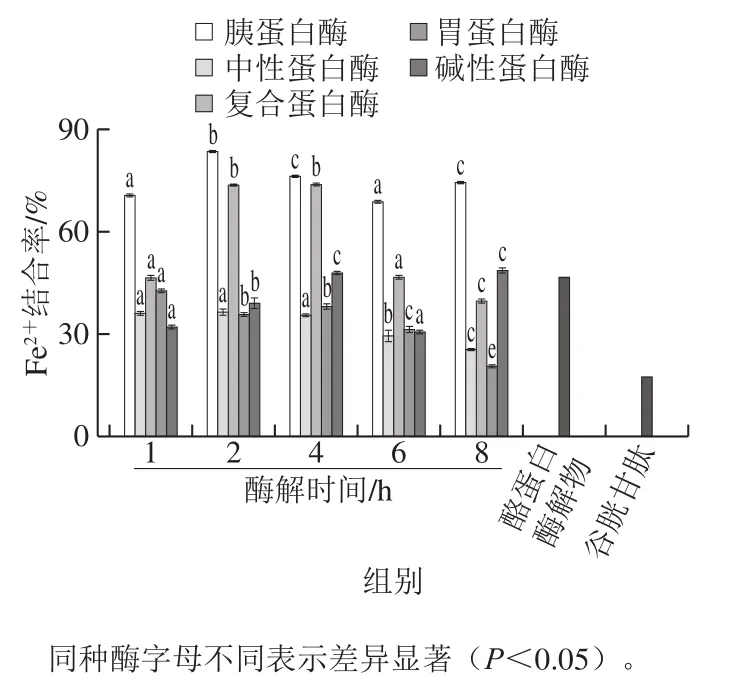
图2 各酶解物TSPP的Fe2+结合率Fig. 2 Fe2+-chelating rates of hydrolysates with different hydrolysis times
综合Fe2+结合能力及水解度趋势可知,TSPP的Fe2+结合能力不随水解度的增加而增加,酶解时间短不能完全酶解蛋白,而酶解时间过长,生成的游离氨基酸增加,降低结合活性。不同蛋白酶具有不同的酶活力及酶切位点,其对蛋白的水解程度不同,进而影响酶解物TSPP的分子质量大小、氨基酸组成及氨基酸序列,胰蛋白酶作为肽链内切酶,主要作用于肽链中精氨酸或赖氨酸残基的羧基端[17]。根据图2结果,胰蛋白酶2 h的酶解物TSPP具有最高的Fe2+结合活性,因此选取胰蛋白酶2 h的TSPP进行下一步的实验。
2.2 TSPP与Fe2+结合条件的确定
TSPP与Fe2+的配位结合反应受pH值、温度、时间等因素的影响。由图3可知,当pH值为7时,TSPP与Fe2+的结合率极低;当pH值小于7时,结合率在结合反应的前90 min随结合时间的延长而大幅度上升,且pH值为5时的结合率高于pH值为4和6的结合率;而在结合反应的90~180 min内,结合率无显著性变化,即结合反应基本完成,最佳的反应pH值为5,时间为90 min。在一定pH值范围内,随着pH值升高,TSPP与Fe2+的结合率升高,当pH值大于7时结合率降低,原因是在低pH值条件下,H+易与Fe2+竞争供电子基团,不利于TSPP-Fe2+结合物的生成,而在高pH值条件下,羟基易与供电子基团争夺Fe2+而形成氢氧化物沉淀[18]。
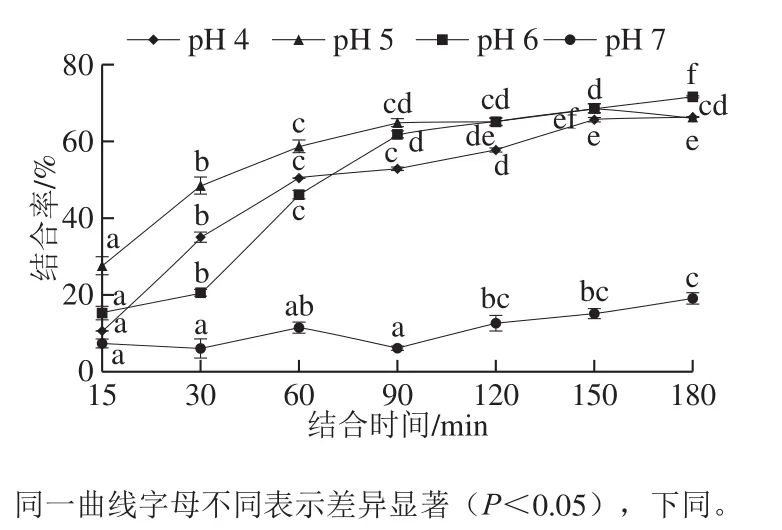
图3 不同pH值条件下结合率随时间的变化Fig. 3 Changes in Fe2+-chelating rate over time under different pH conditions
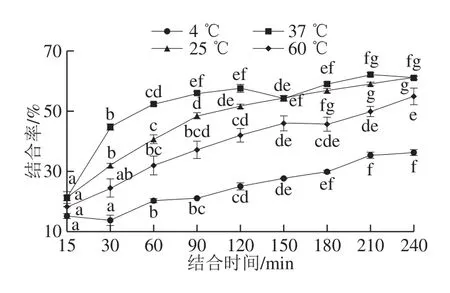
图4 不同温度条件下结合率随时间的变化Fig. 4 Changes in Fe2+-chelating rate over time under different temperature conditions
温度既能够引起TSPP构象的改变[19],又能够影响配位基团与金属离子结合反应的热力学参数[20]。在不同温度条件下,TSPP的Fe2+结合率随着反应时间的动态变化如图4所示,在一定范围内,随着温度的升高,结合率升高,当温度为37 ℃时,结合率最高,当温度高于37 ℃时,结合率降低,即升高或降低温度均造成鳀鱼TSPP-Fe2+结合能力的下降,该结果与Wu Haohao等[14]的结果一致。
因此,综合pH值、温度及时间考虑,pH 5、温度37 ℃、反应时间90 min为最佳结合反应条件。
2.3 TSPP与Fe2+结合过程的荧光光谱分析
在蛋白质二级结构的研究中,内源性荧光发射强度的下降是典型的肽链折叠后的现象,且当正电基团靠近肽链酪氨酸残基的苯环结构时,蛋白质内源性荧光光谱会发生红移[21]。图5为激发波长为275 nm时,TSPP与Fe2+结合反应过程的荧光发射光谱变化(290~500 nm)。由图5A可知,随着TSPP与Fe2+结合反应的进行,TSPP的内源性荧光强度逐渐下降,尤其是在结合反应的0~90 min内,荧光强度明显降低,且光谱发生了一定的红移;90~150 min内,荧光强度下降的幅度明显减小,说明90 min后结合反应基本完成。由图5B可知,当结合反应的pH值为5时,TSPP的内源性荧光强度最低,说明在此pH值条件下,TSPP结合了Fe2+,多肽链发生了折叠,且TSPP的内源性荧光强度由小到大依次为pH 5<pH 6<pH 4<pH 7。如图5C所示,当结合反应的温度为37 ℃,反应完成后TSPP的内源性荧光强度最低。综上可知,当反应的pH值为5、温度为37 ℃、反应时间为90 min时,TSPP的内源性荧光强度基本达到最低,即结合反应基本完成,与2.2节结果一致,即最佳的结合条件为:pH 5、温度37 ℃、时间90 min。
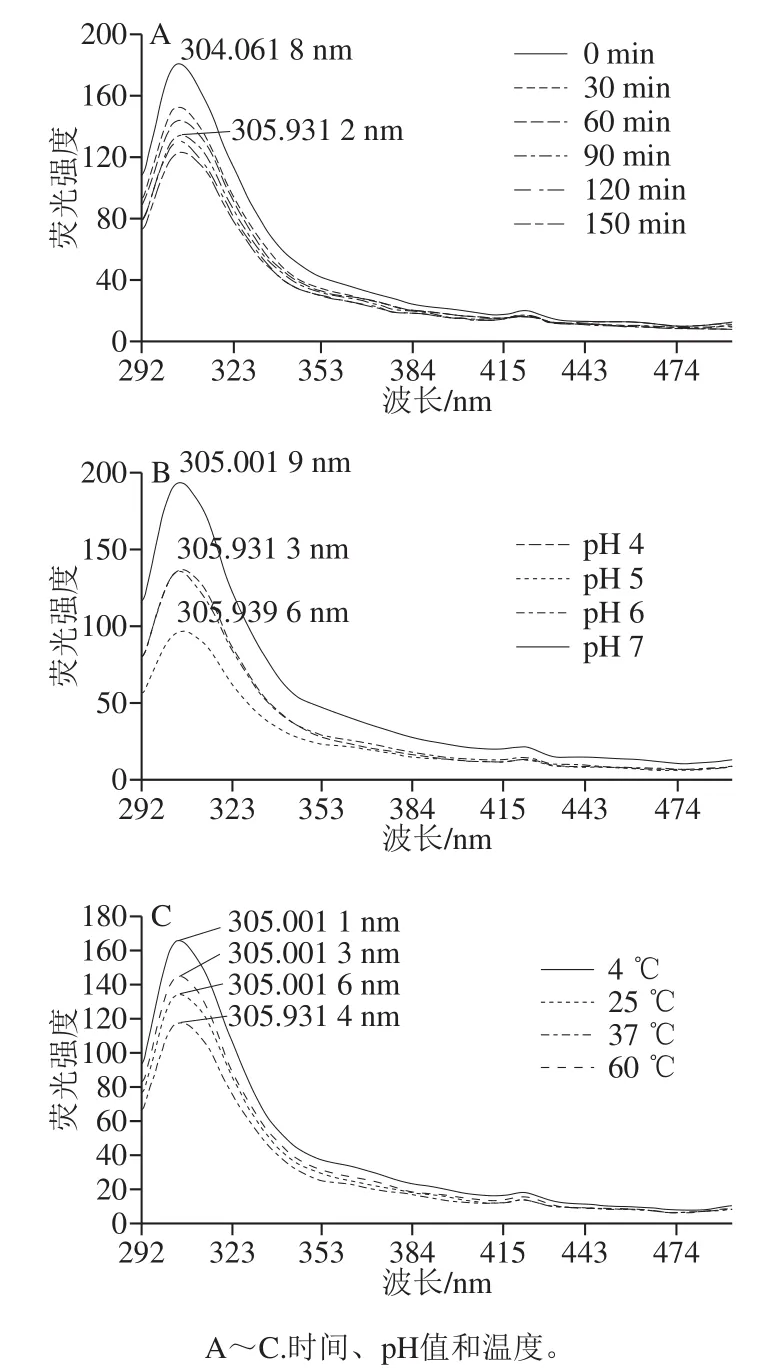
图5 不同条件下TSPP结合Fe2+后其荧光强度的变化Fig. 5 Changes in fluorescence intensity of tilapia skin protein peptides(TSPP) after chelating with Fe2+ under different conditions
金属离子在蛋白质和多肽链的折叠过程中起重要作用,特别在肽链较短时,金属离子可辅助TSPP在水溶液中形成热力学稳定的折叠结构[22]。Reddi等[23]研究也表明,TSPP与金属离子的结合能可为TSPP的折叠提供能量辅助。肽链中含有的芳香族氨基酸如Phe、Trp和Tyr,可产生内源性荧光,TSPP与Fe2+发生结合反应后,肽链结构发生变化,荧光强度的降低可反映出肽-铁结合物在形成过程中发生了肽的折叠[24]。本研究结果表明,Fe2+与肽链的结合引起了肽链折叠,形成TSPP-Fe2+结合物,此结果与李博等[25]的研究结果一致。
2.4 TSPP及TSPP-Fe2+结合物的紫外光谱分析
在TSPP与金属离子的结合反应中,TSPP作为配位体,结合金属离子后,相应原子的价电子发生不同程度的跃迁,导致其紫外光吸收性能发生改变,由此证明TSPP与金属离子之间发生了结合反应[26]。由图6可知,Fe2+的乙酸钠缓冲液(pH 5.0)在230~350 nm波长处形成特征性的宽吸收带,该溶液经0.22 μm滤膜过滤后,其紫外吸收光谱与乙酸钠缓冲液的光谱基本一致,特征性吸收带消失,说明Fe2+在乙酸钠缓冲液中水解形成了铁氢氧化物沉淀。缓冲液+TSPP+Fe2+的反应溶液在250~280 nm波长处形成特征性的吸收带,且反应溶液经0.22 μm滤膜过滤前后,其紫外吸收带基本一致,说明Fe2+在含有TSPP的缓冲液中不水解形成铁氢氧化物沉淀,此外,TSPP-Fe2+结合物的紫外吸收带与TSPP的相似,但出现红移,说明TSPP介入了FeSO4在缓冲液中的水解过程,TSPP结合Fe2+后,减少了溶液中铁氢氧化物胶体粒子的形成,而形成新物质TSPP-Fe2+结合物,该结果与Wu Haohao等[27]研究结果相似。Yuan Biao等[28]研究也发现,灰树花蛋白结合Fe2+前后,其紫外最大吸收峰从194 nm移至192 nm,灰树花-Fe2+的最大吸收波长向短波方向移动,这可能是由于Fe2+的结合过程中羰基氧原子的变化所致。
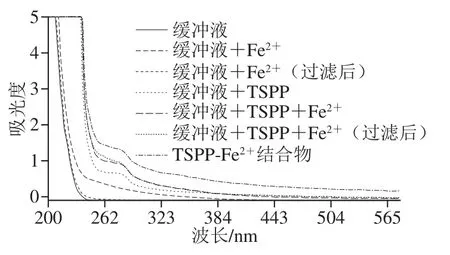
图6 TSPP及TSPP-Fe2+结合物的紫外光谱Fig. 6 UV absorption spectra of TSPP and TSPP-Fe2+ complex
2.5 TSPP及TSPP-Fe2+结合物的红外光谱分析
红外光谱中基团特征性吸收峰的改变可反映出金属离子与肽链中有机配位体的相互作用,且肽链中氨基、羰基、羧基的特征性吸收峰分别在3 300~3 600、1 600~1 700、1 400~1 500 cm-1左右[29]。由图7可知,TSPP与Fe2+结合后,在特征区,氨基的伸缩振动吸收峰从3 317.56 cm-1移动至3 315.63 cm-1;酰胺I带即羰基的伸缩振动吸收峰从1 653.00 cm-1移动至1 656.85 cm-1;羧基反对称伸缩振动吸收峰从1 533.41 cm-1移动到1 537.27 cm-1,其对称伸缩振动峰从1 436.97 cm-1移动到1 440.83 cm-1,且吸收峰的强度均有所增加。由于结合前后,肽链结构构型的改变,引起了红外吸收峰的移动变化,说明肽链中的氨基、羰基及羧基参与了Fe2+的结合,进而形成了TSPP-Fe2+结合物。Huang Guangrong等[30]通过红外光谱发现虾加工副产物水解产物的Fe2+结合的位点主要对应于羧酸酯基团。Chen Qianru等[31]研究利用MS2技术发现Gly-Pro-Ala-Gly-Pro-His-Gly-Pro-Pro-Gly中组氨酸的咪唑环可能是潜在的Fe2+结合位点。林慧敏等[32]利用核磁共振及红外光谱结构表征显示,肽链His-Tyr-Asp中的—NH—、—NH2以及末端—COOH上的—C=O及—OH与Fe2+发生结合,形成不稳定结构的结合物。Wu Haohao等[27]发现鳀鱼蛋白Fe3+结合活性肽myosin1116-1127侧链的羧基是Fe3+的结合位点,即肽链羧基结合Fe3+形成COO—Fe,再水解形成COO—Fe(OH)n,最后脱水缩合完成晶体形成。
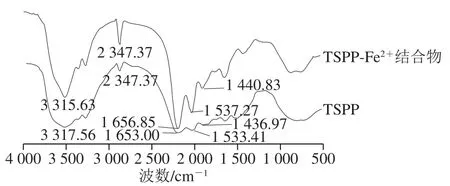
图7 TSPP及TSPP-Fe2+结合物红外光谱Fig. 7 FTIR spectra of TSPP and TSPP-Fe2+ complexes
2.6 TSPP的分子质量分布
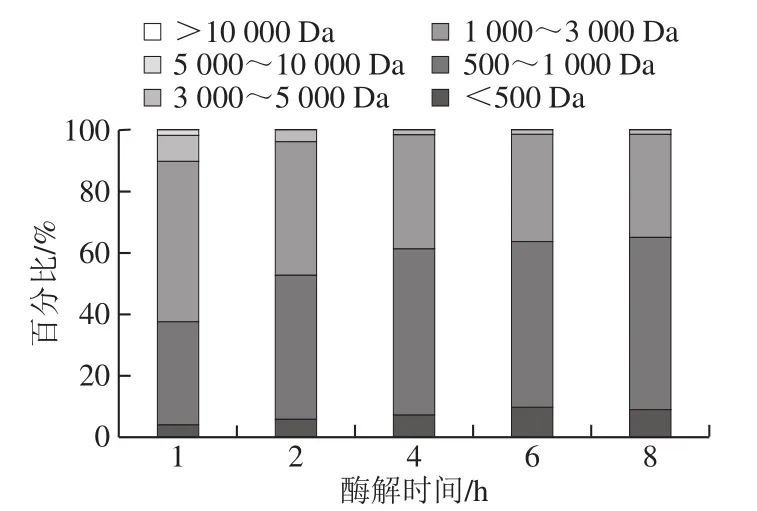
图8 TSPP的分子质量分布Fig. 8 Molecular mass distribution of TSPP with different hydrolysis times
蛋白质在不同的酶解时间下,生成的酶解物中含有各种不同分子质量大小的TSPP,且每一种分子质量的TSPP在不同酶解物中的含量不同。由图8可知,随着胰蛋白酶酶解时间的延长,罗非鱼皮蛋白酶解物中大分子质量(>3 000 Da)的TSPP逐渐减少,小分子质量(<3 000 Da)的TSPP逐渐增多;且2 h的酶解物中500~3 000 Da之间的TSPP含量(90.40%)高于其他酶解时间点下同等分子质量的酶解物。大部分研究表明分子质量在1 500 Da范围内的多肽,其Fe3+和Fe2+结合活性较高,从猪血浆蛋白水解物中鉴定出的Fe2+结合活性肽为1 055 Da[33],从核桃蛋白水解物中分离鉴定的2 条Fe3+结合活性肽的分子质量分别为971.508 0 Da和1 357.648 0 Da[7]。结合2.2节的结果(胰蛋白酶2 h的TSPP-Fe2+结合活性最高),推测出罗非鱼皮蛋白Fe2+结合活性肽的分子质量很可能在500~3 000 Da之间。
2.7 TSPP氨基酸含量的分析
蛋白酶具有特殊的酶切位点,在酶解蛋白后可生成特殊氨基酸组成及序列的多肽,从而具有特殊的生物活性。由表2可知,罗非鱼皮中Asp、Glu、Gly、Ala、Arg及Pro含量较高,罗非鱼皮蛋白经胰蛋白酶酶解2 h后得到的TSPP,上述6 种氨基酸在其酶解物中的含量均增加了3 倍左右,且高于其他氨基酸。根据路易斯规则,充当路易斯酸的Fe3+和Fe2+可以与富含氧或富含氮的基团(路易斯碱)反应,如Arg、Asn中的氨基等含氮基团或Glu、Asp中的羧基和磷酸基等含氧基团[34]。纪晓雯等[10]分离出的酪蛋白Fe2+结合活性肽富含Glu、Asp、Gln。Budseekoad等[8]发现Pro-Ala-Ile-Asp-Leu与Fe2+结合的能力可能与肽链中的Pro、Asp和Leu中的吡咯烷环、羧基和烷基的协同效应有关。Wu Haohao等[14]从鳀鱼肌肉蛋白的胰蛋白酶水解物中分离并表征出的Fe3+结合活性肽Ser-(Gly)7-Leu-Gly-Ser-(Gly)2-Ser-Ile-Arg、Ile-(Glu)2-Leu-(Glu)3-Ile-Glu-Ala-Glu-Arg,其Glu和Gly含量占肽链氨基酸总量60%及以上。综上说明,酶解物中的Asp、Glu、Gly、Arg及Pro在Fe2+结合活性中起重要作用。
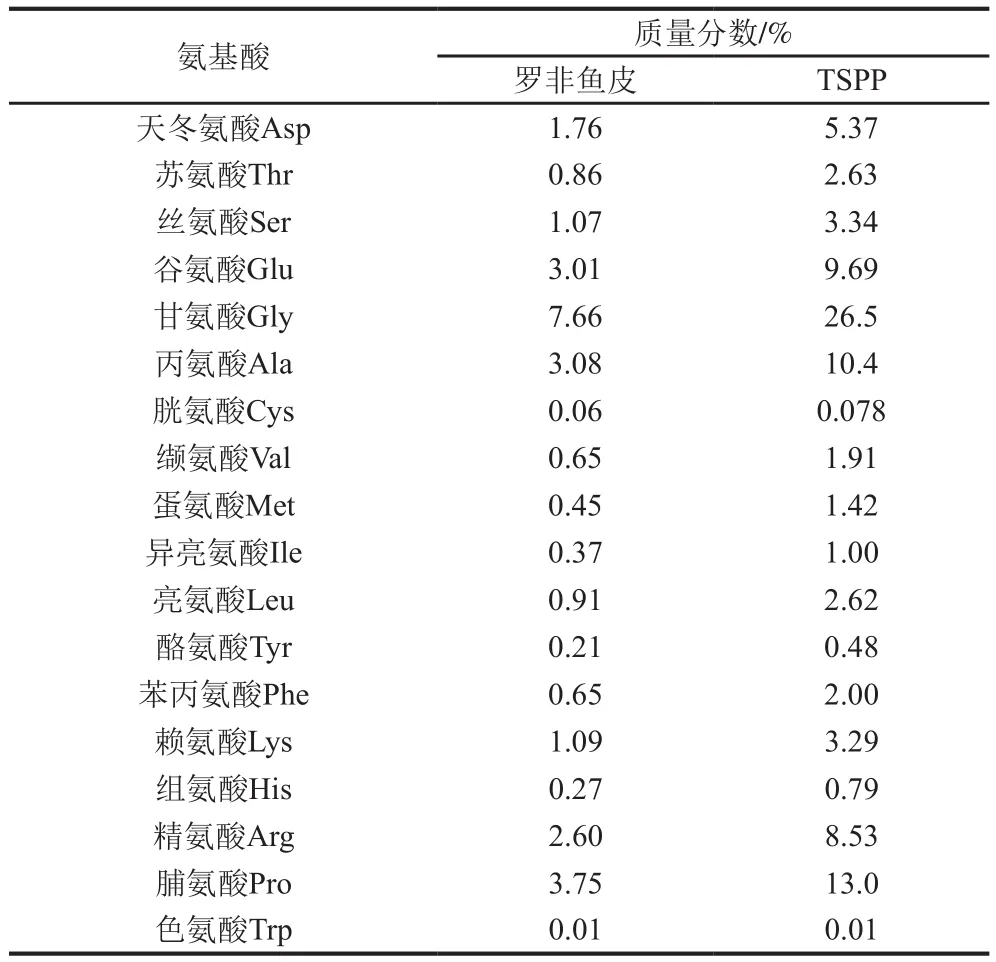
表2 罗非鱼皮和TSPP中氨基酸的成分及含量Table 2 Amino acid composition of tilapia skin protein and 2 h trypsin hydrolysate
2.8 TSPP及TSPP-Fe2+结合物的抗氧化能力分析
Fe2+结合活性肽及肽-Fe2+结合物的主要作用是促进铁元素在人体中的吸收,除此之外,还具有抗氧化活性[35]。由图9可知,5 mg/mL质量浓度下的TSPP对DPPH自由基具有一定的清除能力,且胰蛋白酶各酶解时间点下的TSPP,其DPPH自由基清除能力均高于其他蛋白酶的TSPP;此外,TSPP结合Fe2+形成TSPP-Fe2+结合物后,其DPPH自由基清除率由42.47%降低为37.63%,变化不显著,但均显著低于谷胱甘肽(95.97%)。由图10可知,在Trolox等效抗氧化能力中,碱性蛋白酶酶解8 h TSPP的等效抗氧化能力高于其他TSPP,此外,TSPP结合Fe2+后,其Trolox等效抗氧化能力从0.014 2 mmol/L降低为0.011 5 mmol/L,均显著低于谷胱甘肽(0.849 1 mmol/L)。研究指出,TSPP的抗氧化活性与肽链中的氨基酸组成及含量息息相关,大多数抗氧化肽富含Trp、Phe、Leu、Gly、Val等疏水性氨基酸以及Tyr、Phe、Trp等芳香族氨基酸,疏水性氨基酸残基通过提供电子或供体电子稳定活性自由基,芳香族氨基酸残基可作为氢供体,抑制自由基介导的过氧化链反应,肽的支链氨基酸(Val、Leu和Ile)和非极性脂肪族氨基酸(Leu和Ala)对肽的抗氧化活性也有很大的贡献[36-38]。综合TSPP氨基酸组成及含量的结果,TSPP中主要含有Asp、Glu、Gly、Arg及Pro,在Fe2+结合活性中,TSPP的结合活性高于谷胱甘肽,而在抗氧化活性中,谷胱甘肽的活性高于TSPP,由此说明,不同的TSPP具有不同的氨基酸组成及含量,决定其特殊的生物活性。
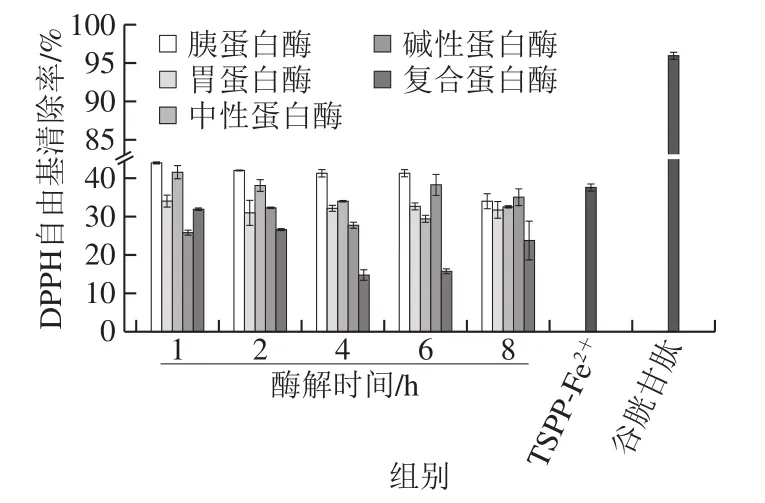
图9 TSPP及TSPP-Fe2+结合物的DPPH清除活性Fig. 9 DPPH scavenging activity of TSPP and TSPP-Fe2+ complexes
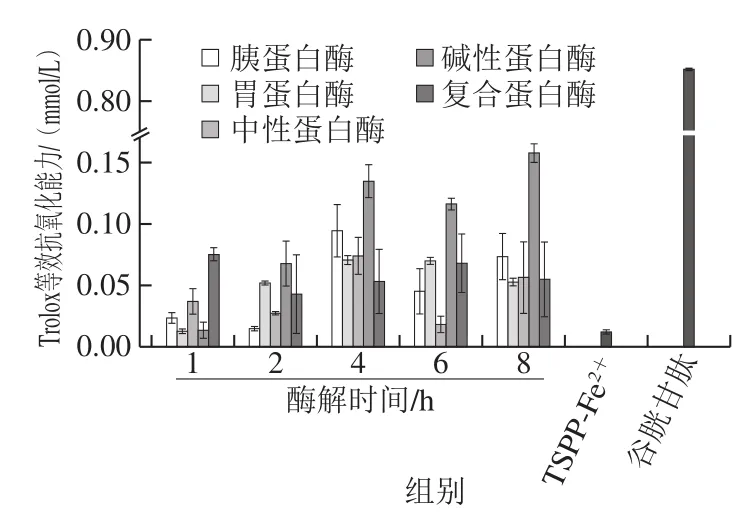
图10 TSPP及TSPP-Fe2+结合物的Trolox等效抗氧化能力Fig. 10 Trolox equivalent antioxidant capacity of TSPP and TSPP-Fe2+ complexes
3 结 论
本实验以罗非鱼皮为原料,进行了罗非鱼皮蛋白TSPP-Fe2+结合物的制备及其结合条件、结构特征、生物活性的探究。结果发现,TSPP的Fe2+结合活性不随蛋白水解度的增加而增加,且胰蛋白酶酶解2 h的TSPP,其Fe2+结合率最高;TSPP与Fe2+的结合率受pH值、温度和时间的影响,当pH值为5、温度为37 ℃、时间为90 min时,结合反应基本完成;TSPP结合Fe2+后,其内源性荧光强度降低且光谱发生红移,说明结合后,肽链发生了折叠;TSPP结合Fe2+前后,其紫外光吸收带的位移表明TSPP结合Fe2+后形成了新物质;根据TSPP及TSPP-Fe2+结合物的红外光谱推测出肽链中的氨基、羰基、羧基参与了Fe2+的结合;TSPP中的Fe2+结合活性肽,其分子质量大约在500~3 000 Da之间;此外,肽链中的Asp、Glu、Gly、Arg及Pro在Fe2+结合活性中起关键作用;TSPP具有一定的抗氧化能力,但TSPP的抗氧化能力显著低于谷胱甘肽,而其Fe2+结合能力显著高于谷胱甘肽,说明不同的肽段具有不同的氨基酸组成及含量,进而决定了其生物活性的特异性。由于蛋白酶解物中含有各种不同分子质量大小及氨基酸组成的肽段,需对其进行分离纯化、序列鉴定以及生物利用度的测定,以期为膳食铁元素补充剂的研究及开发提供依据。
