线粒体和溶酶体内源性NO的同时荧光传感
2021-05-19方君如苗俊峰霍莹莹翁嘉劲郭炜
方君如,苗俊峰,霍莹莹,翁嘉劲,郭炜
(山西大学 化学化工学院,山西 太原 030006)
0 引言
一氧化氮(NO)是生物体内重要的气体信使分子,在细胞内由L-精氨酸、NADPH和氧气在一氧化氮合成酶的催化下产生[1-5],并在一系列生理系统,如心血管、免疫和中枢神经等,发挥着重要的生理功能[6-8]。研究表明,NO主要产生于细胞内的线粒体[9-10],通过结合细胞色素c氧化酶的血色素基团和调节线粒体内的pH来参与调控呼吸作用和线粒体引起的细胞凋亡[11-12];而且,NO可以穿透线粒体膜而自由扩散到溶酶体中来调节溶酶体相关功能,如细胞自噬[13-15]。然而,不正常的生理条件会导致NO的过量表达,从而引起其下游氧化产物过氧亚硝基(ONOO-)的爆发。ONOO-具有极强的氧化性,能氧化损伤线粒体和溶酶体内的各种生物大分子,导致其功能丧失,从而引发系列疾病,例如癌症、糖尿病、高血压、老年痴呆以及溶酶体贮积症等[4]。尽管如此,由于生物系统的复杂性,许多与NO相关的线粒体和溶酶体功能迄今尚未被揭示[16-17]。因此,开发能特异性传感线粒体和溶酶体内源性NO的荧光探针显得尤为重要。
在过去十几年间,为了监测细胞内NO的变化,大量的NO荧光探针被开发出来。在各种类型的NO荧光探针中,基于邻苯二胺反应基团的NO荧光探针最早被开发,其后被广泛应用,目前已经商业化[18-23]。该类探针对NO的传感机理是:邻苯二胺反应基团在有氧条件下与NO反应生成苯并三氮唑基团,该基团抑制了探针分子的光诱导电子转移猝灭过程(PET),从而导致荧光“关-开”响应[24]。尽管该类探针在生物系统中得到了广泛的应用,但仍然存在一些限制,如易被细胞内脱氢抗坏血酸(DHA)/抗坏血酸(AA)/丙酮醛(MGO)所干扰以及相对长的荧光响应时间(通常超过5 min)。为了克服这些限制,2008年Xu课题组报道了一个“邻苯二胺-罗丹明内酰胺”型NO荧光探针。由于邻苯二胺基团的一个胺基得到了保护,该探针有效地克服了传统邻苯二胺型NO荧光探针选择性低的缺点,并大大提高了荧光响应速度[25]。此后,该设计理念被多个课题组采用,并发展出各式各样的罗丹明内酰胺型NO荧光探针[26-30]。然而,该类探针与NO反应后得到的酰基苯并三氮唑中间体非常活泼,能与细胞内丰富的半胱氨酸反应而得到非荧光的产物,因此在细胞影像应用时灵敏度将受到较大的影响。2017年,本课题组开发了一个“邻苯二胺-硅罗丹明脱氧内酰胺”型 NO荧光探针 Lyso-NO[31](图1A)。该探针不仅避免了传统邻苯二胺型NO荧光探针易被DHA/AA/MGO干扰的限制以及罗丹明内酰胺型NO荧光探针易被细胞内半胱氨酸干扰的限制,而且展现出对NO快速的荧光响应、大的荧光增强倍数以及超低的检测限。不仅如此,由于该探针的结构中包含了多个弱碱性的三级胺单元,该探针能通过质子化作用而选择性地定位在弱酸性的溶酶体中,从而实现了溶酶体中NO的荧光影像。

图1 Lyso-NO和Mito-NO的NO传感机理Fig.1 Fluorescence sensing mechanism of Lyso-NO and Mito-NO for NO.
在上述工作基础上,本文设计合成了一个“邻苯二胺-罗丹明脱氧酰胺”型NO荧光探针Mito-NO(图1B)。与硅罗丹明的9位碳原子相比,罗丹明9位碳原子的电正性略小[32-33],因此Mito-NO在生理pH条件下以开环的正离子形式存在。由于线粒体具有大的负性膜电势,Mito-NO能在静电相互作用下而特异性地靶向线粒体,从而实现了线粒体内NO的荧光影像。基于该探针并结合本课题组之前报道的一个溶酶体靶向的NO荧光探针Lyso-NO,本文从可见及近红外两个荧光通道实现了线粒体和溶酶体内NO的同时荧光传感,为NO生理病理功能的探索提供了优良的影像工具。
1 实验部分
1.1 实验仪器与试剂
紫外可见光谱仪Varian Cary 4000分光光度计;荧光光谱仪Hitachi F-7000荧光光谱仪;超导核磁共振仪Bruker ARX600;高分辨质谱仪Varian QFT-ESI质谱仪;激光共聚焦显微镜Zeiss LSM 880。合成所用试剂都为分析纯,测试所用乙腈为色谱纯试剂,所用水均为去离子水。
1.2 探针的合成
探针Lyso-NO的合成参考本课题组报道的方法[26]。
探针Mito-NO的合成步骤如图2所示。
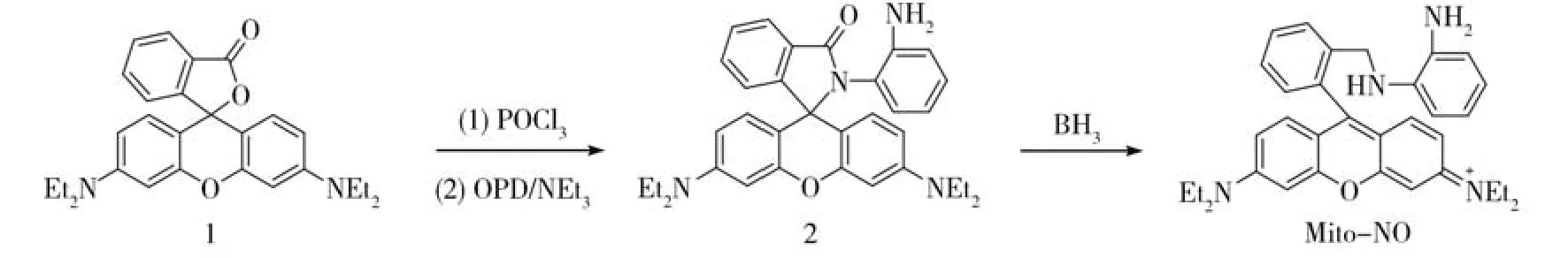
图2 探针Mito-NO的合成步骤Fig.2 Synthesis of probe Mito-NO
在室温下,向罗丹明 B(1)(422 mg,1.0 mmol)的1,2-二氯乙烷(5.0 mL)溶液中缓慢滴加三氯氧磷(460 mg,3.0 mmol)。回流4 h后,将反应混合物冷却并减压旋干,得到罗丹明B的酰氯粗产品。将该产物溶于无水乙腈(5.0 mL)中,然后将其缓慢加入到含有三乙胺(5.0 mL)和邻苯二胺(OPD)(540 mg,5.0 mmol)的无水乙腈(5.0 mL)的溶液中。室温下搅拌过夜后,将混合物减压旋干,粗产物通过硅胶柱色谱纯化(乙酸乙酯:石油醚=1∶4,V/V),得到邻苯二胺-罗丹明内酰胺2(266 mg,50% yield,除特别说明以外本文的百分数均表示质量分数)。1H NMR(600 MHz,CDCl3)δ8.04(dd,J=6.4,1.7 Hz,1H),7.65~ 7.51(m,2H),7.27(dd,J=6.3,1.4 Hz,1H),6.97(td,J=8.0,1.4 Hz,1H),6.66(d,J=8.8 Hz,2H),6.57(dd,J=8.0,1.0 Hz,1H),6.49~ 6.40(m,1H),6.38~ 6.21(m,4H),6.12(dd,J=7.9,1.1 Hz,1H),3.33(dd,J=13.8,6.9 Hz,8H),1.17(t,J=7.0 Hz,12H);13C NMR(151 MHz,CDCl3)δ166.44,153.98,152.40,148.91,144.52,132.63,131.95,128.83,128.75,128.67,128.37,124.30,123.46,122.18,118.22,117.01,107.98,98.03,68.06,44.40,12.53;ESI-MS:Calcd for[M+H]+533.291 7,Found 533.291 1。
在室温条件下,将邻苯二胺-罗丹明内酰胺2(106 mg,0.2 mmol)加入到超干 THF(5ml)溶液中,在N2气保护下滴加硼烷BH3的四氢呋喃溶液(1 mol/L,THF,1.1 mmol)。回流 12 h后,将反应物冷却并加入甲醇(5 mL)猝灭。将所得反应物减压旋干,硅胶柱色谱纯化(乙酸乙酯:石油醚=1∶5,V/V)后得到紫色固体 Mito-NO(56 mg,51% yield)。1H NMR(600 MHz,CDCl3)δ7.78(d,J=7.6 Hz,1H),7.58(t,J=7.6 Hz,1H),7.45(t,J=7.5 Hz,1H),7.11(d,J=7.4 Hz,1H),7.07(d,J=9.3 Hz,2H),6.81~ 6.73(m,4H),6.50(dd,J=25.4,7.1 Hz,3H),6.17(d,J=7.6 Hz,1H),4.25(s,2H),3.63(q,J=6.9 Hz,8H),1.34(t,J=7.0 Hz,12H);13C NMR(151 MHz,CD3CN)δ153.46,148.92,141.35,136.88,132.63,132.05,129.38,128.95,127.59,125.73,121.29,118.33,116.53,115.4,112.69,108.75,97.11,68.69,58.67,43.75,14.53;ESI-MS:Calcd for[M]+519.311 8,Found 519.305 7。
1.3 待测溶液的配制
探针Mito-NO和Lyso-NO溶解到色谱纯的乙腈中,配制成2 mmol/L的储备液。NO水溶液的制备是在N2保护下将NO气体首先通过NaOH溶液以除去由NO和O2反应产生的NO2,然后通入脱氧的去离子水中30 min,得到的NO溶液由Griess方法测定其浓度为1.8 mmol/L。细胞成像实验中,使用市售的NO供体NOC-9。在光谱研究中,将不同的分析物(·OH and1O2除外)分别加入到Mito-NO(或 Lyso-NO)(4.0 μmol/L)的 PBS 溶液中(50 mmol/L,pH7.4,包含20% 体积DMSO 或CH3CN),然后记录吸收和荧光发射光谱。对于·OH和1O2,首先将 Mito-NO(或 Lyso-NO)和 H2O2预混合,然后向混合物中加入Fe2+或ClO-。
2 结果与讨论
2.1 探针Mito-NO对NO的传感性能研究
首先,我们检验了探针Mito-NO与NO反应的吸收光谱变化。如图3A所示,在生理pH条件下,探针Mito-NO在可见光波长范围出示了一个大的吸收峰,吸收最大值为553 nm,表明该探针主要以开环形式存在;当向Mito-NO的溶液中加入NO(30 μmol/L)后,由于生成的苯并三氮唑基团对罗丹明的共轭结构影响很小,因此吸收光谱仅仅发生了轻微的变化。随后,我们检验了探针Mito-NO与NO反应的荧光光谱变化。如图3B所示,探针Mito-NO在生理pH条件下几乎是非荧光的,表明该探针存在一个由邻苯二胺基团到罗丹明共轭结构的PET荧光淬灭过程;当往Mito-NO的溶液中加入NO(30 μmol/L)后,在588 nm处出现了一个大的荧光发射峰,荧光增强倍数达到96倍,表明生成的苯并三氮唑基团有效地抑制了探针分子的PET荧光猝灭,从而导致荧光大大增强。重要的是,Mito-NO与NO的反应能够在数秒内完成(图3C),表明探针Mito-NO具有实时影像生物体内NO的能力。荧光滴定实验进一步表明,随着NO浓度的增加,荧光强度逐渐增强,当增加的NO浓度达到80 μmol/L时,荧光达到最大值(图3D),而且荧光强度与NO浓度在0 μmol/L~ 1.0 μmol/L范围呈现良好的线性相关(R2=0.994)(图3E)。根据信噪比S/N=3,计算得到探针Mito-NO对NO的检测限为2.4 nmol/L。上述结果表明,探针Mito-NO是一个高敏感、快响应的NO荧光探针。
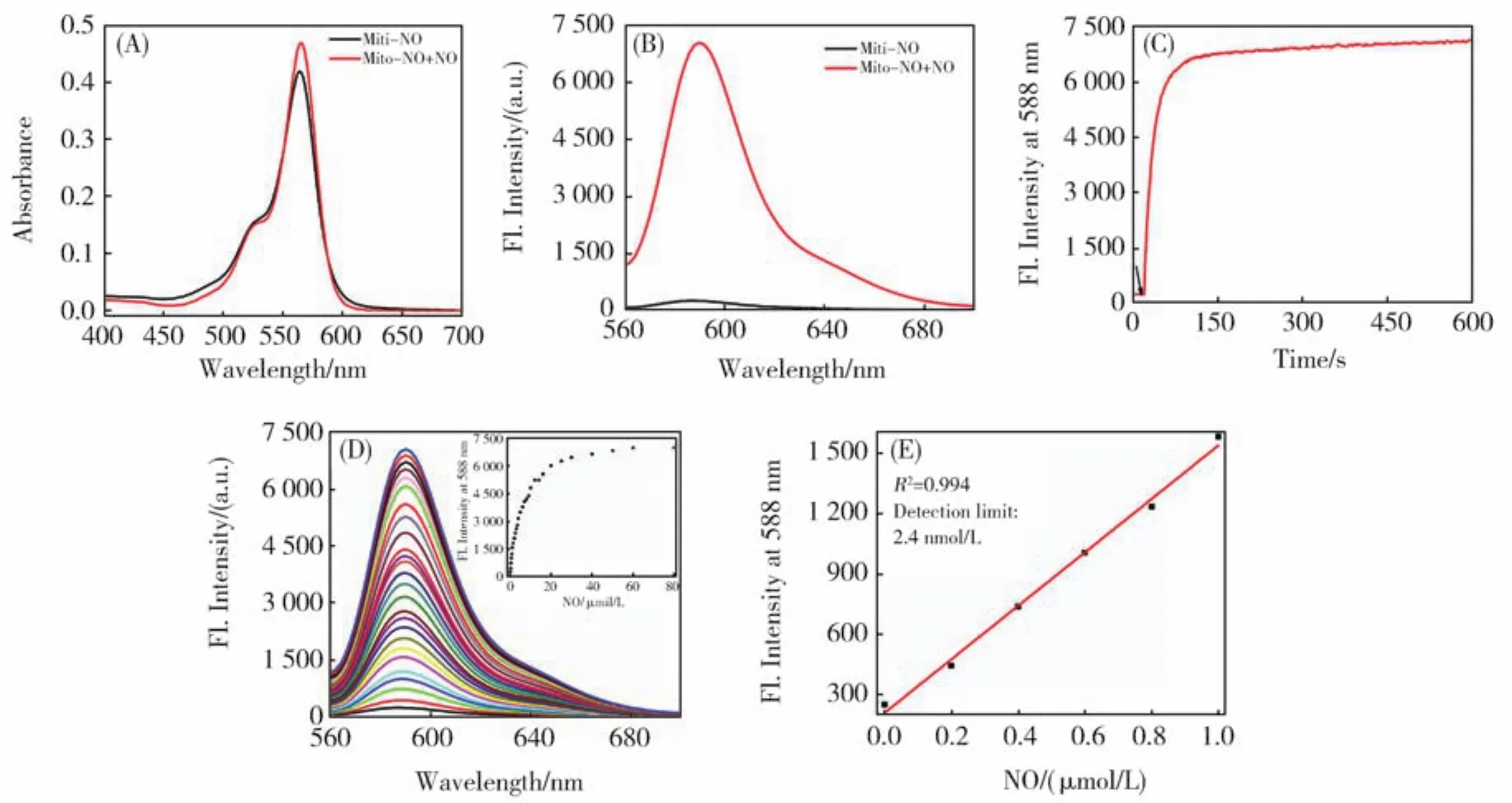
图3 (A,B)Mito-NO(4 μmol/L)与NO(30 μmol/L)反应前后的吸收光谱和荧光光谱变化;(C)Mito-NO(4 μmol/L)与NO(30 μmol/L)的反应动力学;(D)Mito-NO(4 μmol/L)与NO(0 μmol/L ~ 80 μmol/L)的荧光滴定光谱;(E)Mito-NO在588 nm处的荧光密度与NO浓度(0 mol/L~1 mol/L)的线性相关Fig.3 (A,B)Absorption and fluorescence spectra of Mito-NO(4 μmol/L)in the absence and presence of NO(30 μmol/L);(C)Time course of fluorescence intensities of Mito-NO(4 μmol/L)at 588 nm upon treatment with NO(30 μmol/L);(D)Fluorescence spectra of Mito-NO(4 μmol/L)treated with various concentrations of NO(0-80 μmol/L);(E)Plots of the fluorescence intensities of Mito-NO at 588 nm vs.NO concentrations(0-1.0 μmol/L)
接下来,我们检验了探针Mito-NO对NO的选择性。如图4A所示,当向探针Mito-NO的PBS溶液中加入生物相关的活性氧化物(ROS:ClO-,H2O2,1O2,O2·-,·OH,NO2-和 ONOO-,100 μmol/L)、DHA/AA/MGO(1 mmol/L)、金属离子(K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Fe3+,Cu+,and Cu2+,1 mmol/L)、生物硫醇(Cys and GSH,1 mmol/L)后,溶液的荧光几乎没有变化;相反,当向探针Mito-NO的PBS溶液中加入NO(30 μmol/L)后,溶液的荧光显著增强,表明探针Mito-NO对NO具有高的选择性。进一步,我们在不同pH条件下检验了探针Mito-NO对NO传感性能。如图4B所示,探针Mito-NO在pH=5~9的范围内均呈现非荧光特性;当加入NO(30 μmol/L)后,在生理pH范围展现了大的荧光增强,表明该探针能在复杂的生理pH条件下高选择性地传感NO。

图4 (A)Mito-NO 对各种生理相关的分子或离子的荧光响应结果。(1)Mito-NO;(2)HClO;(3)H2O2;(4)1O2;(5)O2·-;(6)·OH;(7)NO2-;(8)ONOO-;(9)DHA;(10)AA;(11)MGO;(12)K+;(13)Ca2+;(14)Na+;(15)Mg2+;(16)Al3+;(17)Zn2+;(18)Fe2+;(19)Fe3+;(20)Cu+;(21)Cu2+;(22)Cys;(23)GSH;(24)NO;(B)Mito-NO 在不同pH条件下对NO的荧光响应结果Fig.4 (A)Fluorescence response of Mito-NO(4 μmol/L)toward various biologically related species,including(1)Mito-NO;(2)HClO;(3)H2O2;(4)1O2;(5)O2·-;(6)·OH;(7)NO2-;(8)ONOO-;(9)DHA;(10)AA;(11)MGO;(12)K+;(13)Ca2+;(14)Na+;(15)Mg2+;(16)Al3+;(17)Zn2+;(18)Fe2+;(19)Fe3+;(20)Cu+;(21)Cu2+;(22)Cys;(23)GSH;(24)NO;(B)Fluorescence response of Mito-NO(4 μmol/L)toward NO(30 μmol/L)under varied pH conditions
为了证明反应机理,我们用高效液相色谱-质谱联用仪研究了探针Mito-NO与NO的反应产物。如图5所示,探针Mito-NO本身的液相色谱保留时间为12.42 min,相应的分子离子峰的质核比为519.312 5;探针Mito-NO与NO反应后生成了一个主要产物(保留时间:8.89),该产物分子离子峰的质核比为m/z=530.291 5,与预测的苯并三氮唑产物一致(计算值:m/z=530.291 4)。该结果支持了我们在图1中建议的反应机理。
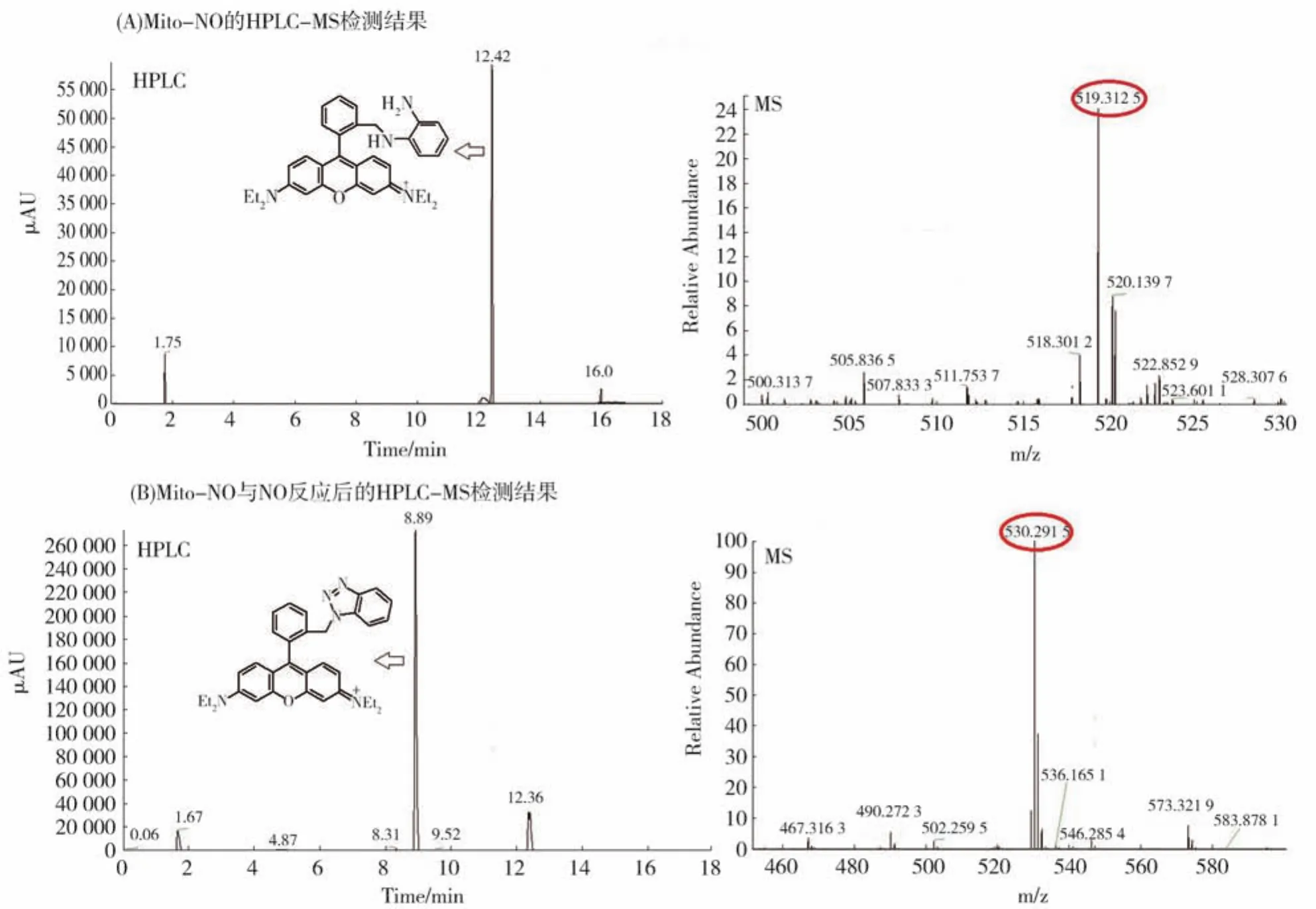
图5 Mito-NO与NO反应前后的液相色谱-质谱检测结果Fig.5 HPLC-MS results of Mito-NO in the absence(A)and presence(B)of NO
2.2 细胞影像实验
接下来,我们利用激光共聚焦影像仪在HeLa细胞系测试了探针Mito-NO对NO的影像能力。如图6A所示当往HeLa细胞内孵入探针Mito-NO后,在561 nm激发光激发下,几乎没有可检测的背景荧光;当往孵有Mito-NO的HeLa细胞内孵入NOC-9(商业化的NO供体)后,该细胞在红色通道呈现出强荧光,表明Mito-NO能在细胞环境中影像外源性NO;当往孵有Mito-NO的HeLa细胞内分别加入H2O2、ClO-、SIN-1(商业化的 ONOO-供体)后,红色通道没有观察到明显的荧光,暗示了该探针能在细胞中选择性影像NO。进一步,我们在RAW264.7细胞系测试了探针Mito-NO对内源性NO的影像能力。如图6B所示,在激发光激发下,RAW264.7本身没有荧光,然而当孵入Mito-NO后,该细胞呈现微弱的荧光;当RAW264.7细胞预先用γ-干扰素/脂多糖(IFN-γ/LPS)刺激6 h再孵入探针Mito-NO后,该细胞在红色通道呈现明显的荧光;当在IFN-γ/LPS刺激的同时加入NO合成酶抑制剂AG(或L-Name),然后再孵入探针Mito-NO,该细胞在红色通道仅呈现微弱的荧光。上述结果表明,探针Mito-NO不仅能检测RAW264.7细胞内生理浓度的NO,而且能检测该细胞刺激产生的内源性NO。另外,我们也研究了Mito-NO的光稳定性和抗光漂白能力。如图6C所示,当用激发光连续激发孵有Mito-NO的HeLa细胞30 min后,该细胞仍然呈现低的背景荧光,表明该探针具有较强的抗光氧化能力;当用激发光连续激发孵有Mito-NO和NOC-9的HeLa细胞30 min后,细胞在红通道的荧光没有明显减弱,表明探针Mito-NO与NO的反应产物具有良好的抗光漂白性能。
图6 (A)HeLa细胞外源性NO的共聚焦影像结果,在该试验中,细胞分别用Mito-NO,Mito-NO/NOC-9,Mito-NO/SIN-1,Mito-NO/H2O2,和 Mito-NO/ClO-处理;(B)RAW264.7内源性NO的共聚焦荧光影像结果,在该试验中,细胞分别用Mito-NO,LPS/INF-γ/Mito-NO,LPS/INF-γ/AG/Mito-NO,和LPS/INF-γ/L-Name/Mito-NO处理;(C)探针Mito-NO的抗光氧化和抗光漂白能力的检测结果,在该实验中,负载Mito-NO和Mito-NO/NOC-9的HeLa细胞分别用561 nm激光器连续照射30 min,然后进行共聚焦荧光影像Fig.6 (A)Confocal images of HeLa cells pretreated with Mito-NO(2 μmol/L)and then treated with NOC-9(20 μmol/L),SIN-1(0.5 mmol/L),H2O2(0.5 mmol/L),and ClO-(0.5 mmol/L),respectively.(B)Confocal images of RAW264.7 cells treated with Mito-NO(2 μmol/L)only,or pretreated with LPS(20 mg/mL)/INF-γ(150 units/mL)for 6 h and then treated with Mito-NO(2 μmol/L),or pretreated with LPS(20 mg/mL)/INF-γ(150 units/mL)in the presence of AG(2 mmol/L)or L-Name(10 μmol/L)for 6 h and then treated with Mito-NO(2 μmol/L),respectively.(C)Confocal images of Mito-NO-loaded HeLa cells continuously excited by 561 nm laser for 30 min in the absence and presence of NOC-9.Emission was collected at 566-650 nm(λex=561 nm)
为了验证Mito-NO的亚细胞器定位能力,我们进行了共染实验。在该实验中,我们将探针Mito-NO与商业化亚细胞器靶向荧光探针(内质网探针ER Tracker,溶酶体探针Lyso Tracker,线粒体探针Mito Tracker)同时孵入HeLa细胞中,然后加入NOC-9点亮探针在红色通道的荧光。如图7A所示,共染实验表明,Mito-NO与NO反应产物的荧光影像与内质网探针和溶酶体探针的重叠效果较差,皮尔森系数分别仅为0.35和0.25;然而与线粒体探针呈现良好的重叠影像,皮尔森系数可达0.88,表明探针与NO的反应产物主要定位于线粒体。为了进一步探测Mito-NO本身的定位情况,我们提高了共聚焦荧光影像仪的激光强度来获得可观测的Mi-to-NO本身的弱荧光,并在该条件下进行了共染实验。如图7B所示,Mito-NO本身与线粒体靶向探针呈现良好的共定位,皮尔森系数为0.8,而与内质网和溶酶体探针的共定位效果较差,皮尔森系数分别仅为0.35和0.28。这些结果表明,探针Mito-NO及其与NO的反应产物均能特异性靶向细胞的线粒体。

图7 (A)HeLa细胞中,探针Mito-NO(2 μmol/L)与NO的反应产物与商业化内质网探针ER-Tracker Green(1 μmol/L)、溶酶体探针Lyso Tracker Green DND-26(0.07 μmol/L)以及线粒体探针Mito Tracker green FM(0.2 μmol/L)的共染影像结果;(B)HeLa细胞中,探针Mito-NO(2 μmol/L)与商业化内质网探针ER-Tracker Green(0.2 μmol/L)、溶酶体探针 Lyso Tracker Green DND-26(0.02 μmol/L)以及线粒体探针Mito Tracker green FM(0.05 μmol/L)的共染影像结果,激发和收集波长:Mito-NO:λex=561 nm,λem=566 nm~650 nm;Mito Tracker/Lyso Ttracker/ER-Tracker:λex=488 nm,λem=493 nm~550 nmFig.7 (A)Confocal images of HeLa cells co-stained with Mito-NO(2 μmol/L)/ER-Tracker Green(1 μmol/L),Mito-NO(2 μmol/L)/Lyso Tracker Green DND-26(0.07 μmol/L),and Mito-NO(2 μmol/L)/Mito Tracker green FM(0.2 μmol/L),and then treated with NOC-9(30 μmol/L);(B)Confocal images of HeLa cells co-stained with Mito-NO(2 μmol/L)/ER-Tracker Green(0.2 μmol/L),Mito-NO(2 μmol/L)/Lyso Tracker Green DND-26(0.02 μmol/L),and Mito-NO(2 μmol/L)/Mito-Tracker green FM(0.05 μmol/L).For Mito-NO,emission was collected at 566 nm-650 nm(λex=561 nm);for ER-Tracker/Lyso-Tracker/Mito Tracker,emission was collected at 493 nm-550 nm(λex=488 nm)
利用Mito-NO和本课题组之前报道的溶酶体NO探针Lyso-NO进行了同时荧光影像线粒体和溶酶体内源性NO的实验。在该实验中,我们将Mito-NO、Lyso-NO 以及 Mito Tracker(或 Lyso Tracker)同时孵入内皮EA.hy926细胞,然后将该细胞置于“氧糖剥夺-再灌氧(OGD/RO)”条件下以刺激该细胞产生内源性NO。如图8A所示,共聚焦影像结果表明,探针Mito-NO与线粒体探针的荧光影像重叠良好,皮尔森系数高达0.82,表明该探针能靶向线粒体并影像线粒体内源性NO;而探针Lyso-NO与Mito-NO以及线粒体探针的荧光影像基本没有重叠,皮尔森系数仅为0.41和0.45。如图8B所示,探针Lyso-NO与溶酶体探针的荧光影像重叠良好,皮尔森系数高达0.84,表明该探针能靶向溶酶体并影像溶酶体内源性NO;然而Mito-NO与Lyso-NO以及Lyso Tracker的荧光影像基本没有重叠,皮尔森系数仅为0.31和0.24。这些结果表明,Mito-NO和Lyso-NO能同时在一个细胞内荧光影像线粒体和溶酶体内源性NO,且相互不干扰,因此是研究线粒体和溶酶体内NO生理功能的良好影像工具。
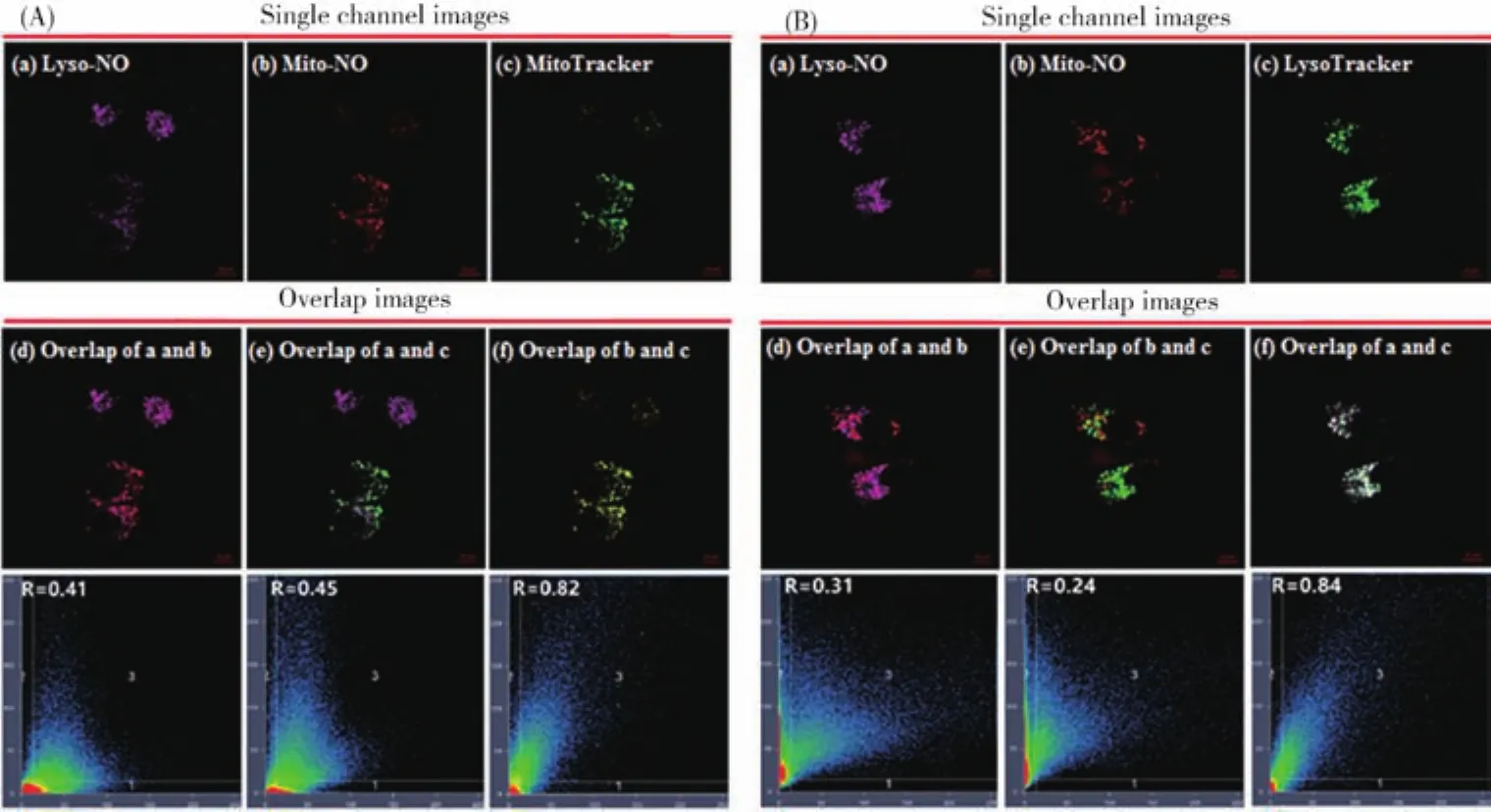
图8 (A)EA.hy926细胞经氧糖剥夺-再灌氧、Mito-NO(2 μmol/L)/Lyso-NO(2 μmol/L)/Mito Tracker Green DND-26(0.2 μmol/L)共染后的荧光影像图;(B)EA.hy926细胞经氧糖剥夺-再灌氧、Mito-NO(2 μmol/L)/Lyso-NO(2 μmol/L)/Lyso Tracker Green DND-26(0.07 μmol/L)共染后的荧光影像图;激发和收集波长:Mito-NO:λex=561 nm,λem=566 nm~650 nm;Lyso-NO:λex=633 nm,λem=638 nm~750 nm;Mito Tracker/Lyso Ttracker:λex=488 nm,λem=493 nm~550 nmFig.8 (A)Confocal images of EA.hy926 cells subjected to OGD(2 h)/RO(1 h)and then co-stained with Mito-NO(2 μmol/L)/Lyso-NO(2 μmol/L)/Mito Tracker Green DND-26(0.2 μmol/L).(B)Confocal images of EA.hy926 cells subjected to OGD(2 h)/RO(1 h)and then co-stained with Mito-NO(2 μmol/L)/Lyso-NO(2 μmol/L)/Lyso Tracker Green DND-26(0.07 μmol/L).For Mito-NO,emission was collected at 566 nm-650 nm(λex=561 nm);for Lyso-NO,emission was collected at 638 nm-750nm(λex=633 nm);for Lyso-Tracker/Mito Tracker,emission was collected at 493 nm-550 nm(λex=488 nm)
3 结论
本文设计合成了一个线粒体靶向的罗丹明脱氧酰胺型NO荧光探针Mito-NO,并在模拟生理条件下以及细胞内证实了该探针能高选择性、高灵敏性检测线粒体内源性NO。结合本课题组之前报道的一个溶酶体靶向的硅罗丹明脱氧内酰胺型NO荧光探针Lyso-NO,本文成功地实现了线粒体和溶酶体内源性NO的同时荧光影像。本工作为NO生理病理的深层次研究提供了优良的荧光影像工具。
