基于PI3K-AKT通路探讨连翘归尾煎抗乳腺癌作用机制研究
2021-05-19翟康欣谭丽媛遆安航李思思张淑蓉
翟康欣,谭丽媛,遆安航,李思思,张淑蓉
(山西中医药大学 中药与食品工程学院,山西 晋中 030600)
0 引言
2018年全球乳腺癌新发病约208万例,死亡病例约62万,以西医为主的治疗手段,毒副作用大,费用昂贵,严重影响患者的生活质量[1-3]。中药由于其多靶点,低毒性的优点,越来越受到人们的关注[4-6]。越来越多的证据表明,中药中富含的活性成分具有抗肿瘤作用,如:乳康饮能够通过抑制PI3K/AKT信号通路,促进PTEN、SHIP蛋白表达,从而抑制乳腺癌细胞的增殖[7]。阳和汤可激活MDA-MB-231细胞中Egr1/p21信号通路使细胞周期阻滞于G2/M 期,发挥其抗肿瘤效应[8]。
《景岳全书》中记载连翘(Forsythia suspensa(Thunb.)Vahl)归 尾 煎(Lianqiao Guiwei Decoction,LGD)由连翘、金银花、归尾、甘草、红藤组成,具有清热解毒,活血消肿的功效。文献报道显示,连翘归尾煎临床可用于急性乳腺炎、腮腺炎、牙周脓肿等疾病的治疗[9]。然而,关于连翘归尾煎抗肿瘤活性研究报道较少。课题组前期参考《景岳全书》中连翘归尾煎的用法(好酒二碗,煎一碗服),选择乙醇为提取溶剂,进行不同浓度乙醇提取物对乳腺癌MDA-MB-231细胞增殖抑制作用的研究,结果表明20%乙醇提取物效果最佳,并且研究显示连翘归尾煎提取物(LGD)具有显著的抗乳腺癌作用[10],但是其作用机制尚不清楚。因此本研究运用网络药理学方法构建“药物-成分-靶基因-疾病”网络,对LGD抗乳腺癌的作用机制进行研究,为进一步阐明其药效物质基础及作用机制提供参考。
1 材料与方法
1.1 材料与试剂
经山西中医药大学裴香萍副教授鉴定连翘为木犀科植物连翘的干燥果实,金银花为忍冬科植物忍冬Lonicera japonicaThunb.的干燥花蕾,归尾为伞形科植物Angelica sinensis(Oliv.)Diels的干燥根,甘草为豆科植物甘草Glycyrrhiza uralensisFisch的干燥根及根茎,红藤为木通科植物大血藤Sarge odoxa cuneata(Oliv.)Rehd.et Wils.的干燥藤茎,均购自同仁堂。L-15培养基购买自博士德生物工程有限公司;胎牛血清购买自赛澳美细胞技术有限公司;AKT和p-AKT抗体购买自bioworld生物技术有限公司;GAPDH购买自武汉三鹰有限公司;青链霉素购买自北京索莱宝科技有限公司;SDS-聚丙烯酰胺凝胶试剂购自普利莱公司;AKT的特异性抑制剂(SC79)购买自MCE公司。
1.2 LGD的提取
分别称取连翘24 g、金银花15 g、大血藤15 g、归尾 9 g、甘草 3 g,按照料液比(1∶12)加入 20% 乙醇,回流3次,每次1 h。将提取物减压浓缩至原先体积的一半后进行真空冷冻干燥,样品于4℃保存。
1.3 细胞培养
人乳腺癌MDA-MB-231细胞培养条件为L-15完全培养基(10%(体积分数)胎牛血清及1%(体积分数)青霉素-链霉素),37℃、无CO2细胞培养箱。
1.4 CCK-8法检测LGD对人乳腺癌MDA-MB-231细胞增殖的影响
实验设阴性对照组和给药组,每组设5个复孔。取对数生长期MDA-MB-231细胞,调整细胞数为4×104个/mL,观察细胞完全贴壁后,加入不同浓度(0.1 mg/mL~ 1.0 mg/mL)的LGD孵育细胞,24 h后弃去培养基,每孔再加入100 μL新鲜培养基和10 μL CCK-8,1 h后测定 450 nm处的吸光度值,根据测得吸光度值计算细胞增殖抑制率。
1.5 有效活性成分及靶基因的收集和筛选
通过中药系统药理学数据库与分析平台(TCMSP(http://lsp.nwu.edu.cn/tcm sp.php),检索LGD所含药味(连翘、金银花、大血藤、甘草、当归)的活性成分,筛选条件限定口服生物利用度(OB)≥ 30%且类药性(DL)≥ 0.18。其次利用Pub-Chem 数 据 库(https://pubchem.ncbi.nlm.nih.gov/)获取已知活性成分的SMILE结构,将其导入Swiss Target Prediction数据 库(http://www.swisstargetprediction.ch/),获取有效活性成分所对应的靶基因。
1.6 乳腺癌相关靶基因的收集
通过GeneCard数据库平台(https://www.genecards.org/)检索关键词“Breast Cancer”,设置 Relevance score≥30,收集乳腺癌相关靶基因。
1.7 有效成分与疾病靶基因的Venn分析
将LGD的活性成分靶基因与乳腺癌靶基因导入 Bioinformatics&Evolutionary Genomics(http://bioinformatics.psb.ugent.be/webtools/Venn/)平台,获取药物与疾病的共同靶基因。
1.8 构建“药物-成分-靶基因-疾病”网络
将收集到的乳腺癌相关靶基因与筛选得到的药物活性成分进行映射,建立活性成分与靶基因的对应关系,得到治疗乳腺癌的活性成分以及关键靶基因。通过Cytoscape软件平台进行数据可视化分析,构建“药物-成分-靶基因-疾病”网络。
1.9 构建蛋白互作关系网络
借助 STRING(https://string-db.org)平台构建蛋白间相互作用关系网络以及运用Cytoscape软件可视化。输入关键靶基因,限定种属“Homo sapiens”,“minimum required interaction score”设 置0.4,获得蛋白相互作用关系,导入Cytoscape,使用插件CentiScape计算度中心性(DC),筛选得到蛋白互作网络(PPI)的核心基因。
1.10 核心靶基因GO(基因本体论)分析和KEGG富集分析
采用 DAVID 数据库(https://david.ncifcrf.gov/)对LGD抗乳腺癌的关键靶基因进行GO分析与KEGG富集分析,结果以气泡图形式进行可视化分析。
1.11 Western blot法测定细胞Akt、p-Akt蛋白水平
将对数期的MDA-MB-231细胞接种到60 mm培养皿,待细胞贴壁后,加入不同浓度(0.25、0.5、1.0 mg/mL)的LGD处理细胞24 h。用细胞刮收取细胞,于冰上裂解细胞(WBIP∶PMSF=100∶1)30 min后,13 000 r/min低温离心后取上清,采用BCA法进行蛋白定量。随后,SDS-PAGE分离蛋白并电转,电转结束后于4℃过夜孵育一抗;二抗于室温孵育。之后,用ECL发光液观察蛋白条带的变化。
1.12 数据分析
采用SPSS18.0统计软件进行分析。所有数据均为三次重复的结果,以平均值±标准差表示,组间差异分析采用t检验,P<0.05表示有显著性差异,P<0.01表示差异极显著。
2 结果
2.1 LGD抑制乳腺癌细胞的增殖
用不同浓度的LGD(0.1 mg/mL~1.0 mg/mL)处理MDA-MB-231细胞24 h后,结果显示,LGD可显著抑制MDA-MB-231细胞的增殖,并且呈现浓度梯度依赖性,其IC50值为0.7872 mg/mL(图1)。
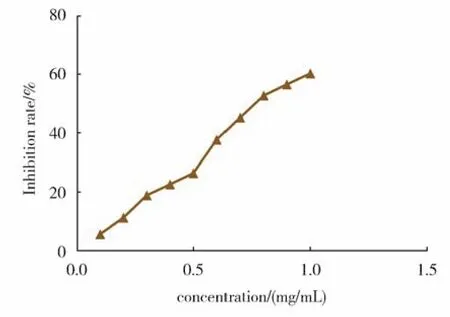
图1 LGD对人乳腺癌MDA-MB-231细胞增殖的抑制率Fig.1 Cells inhibition rate of LGD on the proliferation of human breast cancer MDA-MB-231 cells
2.2 LGD有效活性成分及靶基因的收集
通过TCMSP数据库检索得到LGD相关有效活性成分共134个,其中连翘23个、金银花23个、大血藤5个、甘草92个、当归2个。收集LGD有效活性成分的预测靶基因,去重后最终获得796个潜在作用靶基因(表1)。
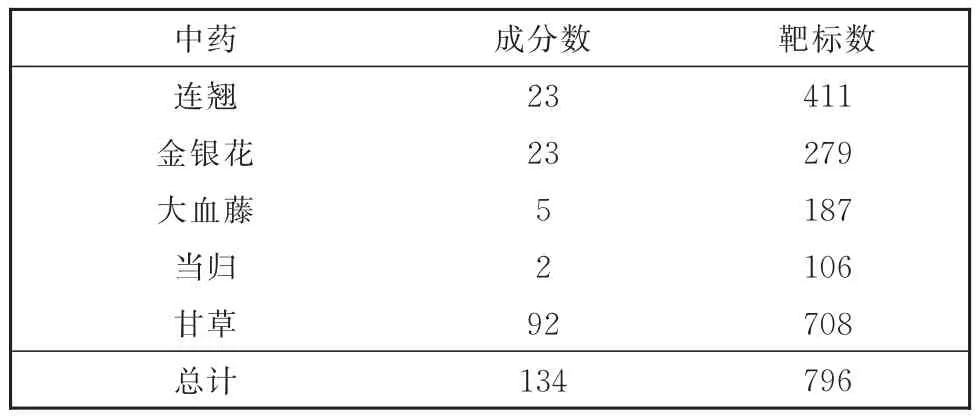
表1 LGD的有效活性成分及靶基因数目Table 1 Number of effective components and genes in LGD
2.3 LGD抗乳腺癌相关靶基因
通过GeneCards数据库共筛选出364个乳腺癌靶基因,将疾病相关靶基因和药物作用靶基因取交集得到66个共同靶基因,确定为LGD抗乳腺癌的靶基因(图2)。
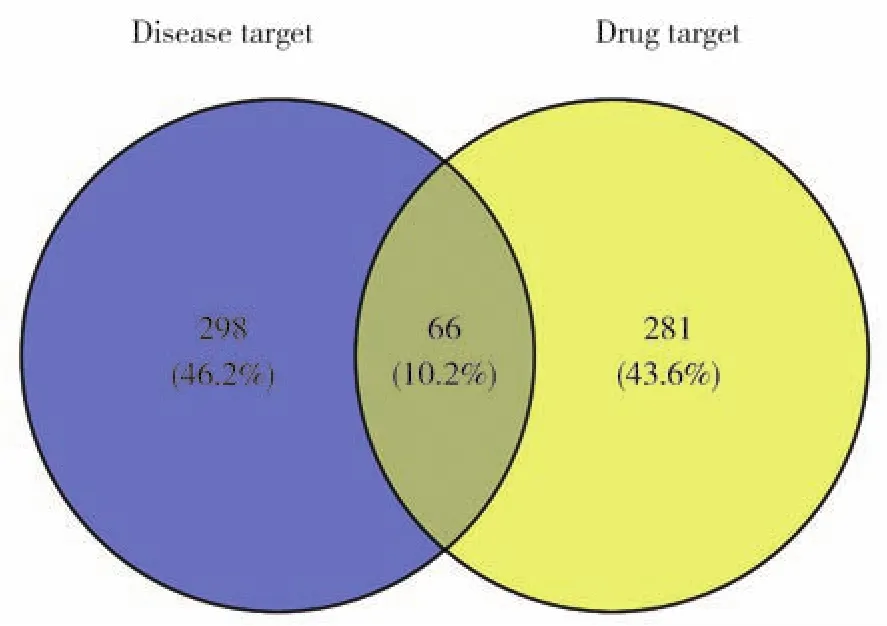
图2 LGD活性成分相关基因与乳腺癌相关基因Fig.2 Ingredient-related genes of LGD and breast cancer-related genes
2.4 “药物-成分-靶基因-疾病”网络
将连翘、金银花、大血藤、甘草、当归与对应活性成分,活性成分与关键靶基因,关键靶基因与乳腺癌对应关系以及属性导入Cytoscape,构建完整的“药物-成分-靶基因-疾病”网络(图3)。根据degree值进行排序,wogonin、DFV、Eriodyctiol(flavanone)、2-(4-hydroxyphenyl)ethyl(E)-3-(4-hydroxyphenyl)prop-2-enoate、Jaranol、Medicarpin、beta-sitosterol meso-1,4-Bis-(4-hydroxy-3-methoxyphenyl)-2,3-dimethylbutane可能为 LGD抗乳腺癌的主要物质。

图3 LGD抗乳腺癌的“药物-成分-靶基因-疾病”可视化网络图粉色倒三角形为乳腺癌,绿色菱形为药物,蓝色三角形为活性成分,红色圆形为关键靶基因,灰色连线代表各节点间相互关系Fig.3 Visual network diagram of"compound-gene-disease"of anti-breast cancer of LGDPink inverted triangle is breast cancer,green diamond is medicine,blue triangle is the active ingredient,red circle is key target genes,gray line represents the relationship between the nodes
2.5 蛋白互作网络构建
借助STRING数据库对LGD抗乳腺癌的关键靶基因构建蛋白互作网络(PPI),并通过Cytoscape可视化(图4)。通过CentiScape计算DC均值为26.485,以大于26进行筛选,得到30个核心基因,以黄色圆点表示,其中蛋白激酶(AKT1)、雌激素受体 1(ESR1)、细胞周期蛋白 D1(CCND1)、半胱氨酸蛋白酶-3(Caspase-3)、表皮生长因子受体(EGFR)位于前五位,可能是LGD治疗乳腺癌的关键靶点。

图4 LGD抗乳腺癌靶基因相互作用图圆点均代表靶基因,黄色圆点代表核心靶基因,灰色连线代表各节点间相互关系Fig.4 Diagram of proteins interactions network of anti-breast cancer of LGDDots represent genes,yellow dots represent core genes,gray lines represent the relationships between nodes
2.6 GO功能富集分析
利用David数据库进行GO分析,共富集481个生物学过程及功能,涉及Bioprogress(BP,细胞生物过程)297个,包括蛋白质自磷酸化、凋亡、药物反应、肽基酪氨酸磷酸化、磷脂酰肌醇介导的信号传导等;Cell Components(CC,细胞组成)47个,包括细胞核、细胞质等;Molicular Function(MF,分子功能)74个,包括ATP结合、蛋白激酶活性、蛋白质酪氨酸激酶活性、激酶活性、跨膜受体蛋白酪氨酸激酶活性等。根据P值排序,选择前20个进行气泡图展示(图5)。
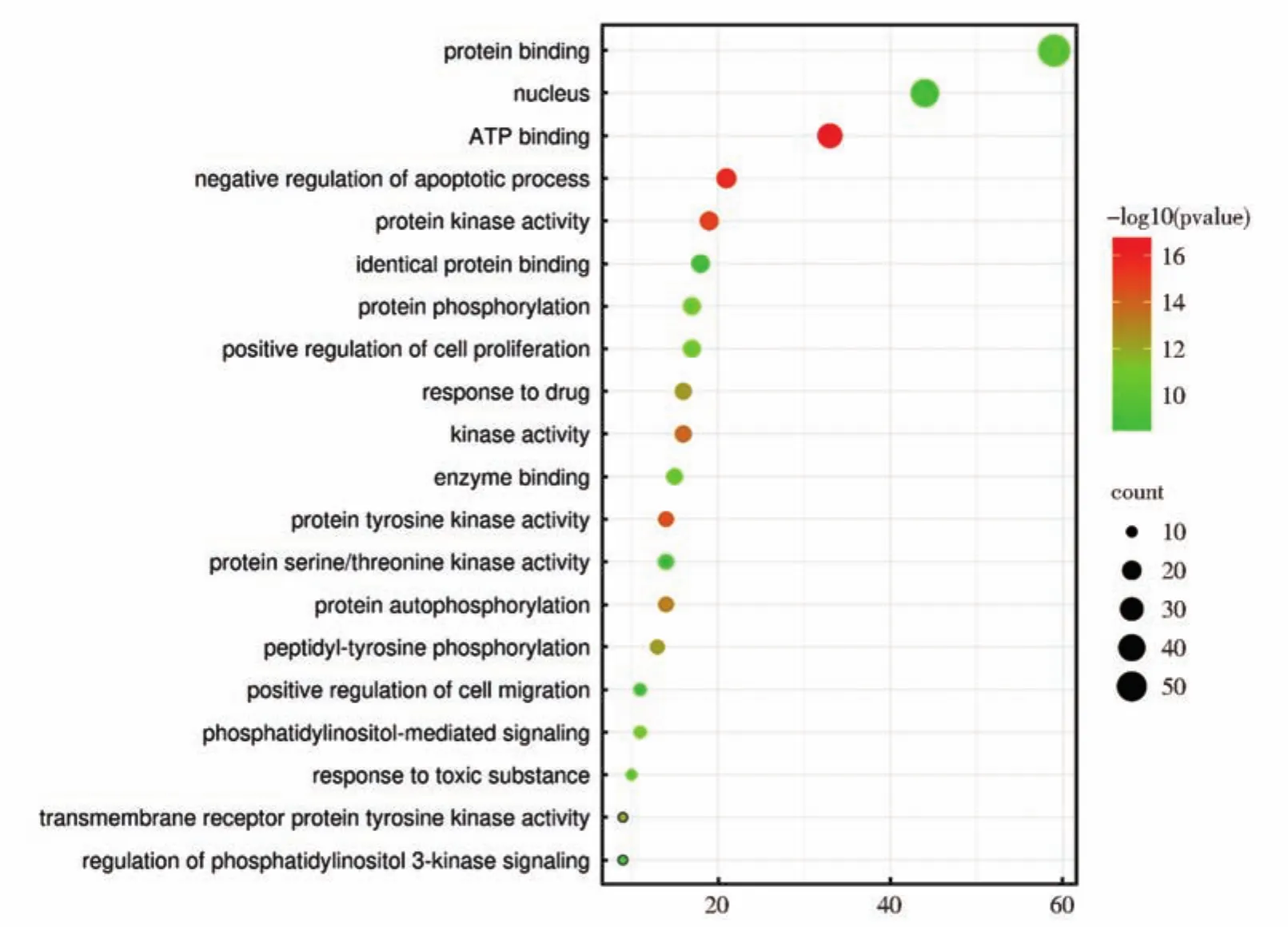
图5 LGD抗乳腺癌靶基因的生物过程(GO)富集分析Y轴为生物学过程及功能名称,X轴为富集因子,气泡大小代表富集的基因数目,颜色代表富集显著性(P值),颜色由绿到红表示富集的程度由低到高,对应的P值由小到大Fig.5 Enrichment analysis of Bioprocess(GO)of target genes of anti-breast cancer of LGDThe Y axis is the biological process and function name,the X axis is the enrichment factor,the size of bubble represents the number of enriched genes,the color represents the significance of enrichment(P value),the color from green to red indicates that the degree of enrichment varies from low to high,and the corresponding P value varies from small to large
2.7 KEGG通路富集分析
KEGG通路富集分析共得到92条通路,根据P值进行排序,选择前20个得到气泡图(图6)。LGD抗乳腺癌的信号通路包括癌症通路、肿瘤蛋白多糖、癌症中的中央碳代谢、PI3K-AKT信号通路、黏着、ErbB信号通路、催乳素信号通路、VEGF信号通路、甲状腺激素信号通路、Rap1信号通路、HIF-1信号通路、雌激素信号通路、癌症中的微RNA、Ras信号通路、Foxo信号通路等,还包括前列腺癌、黑色素瘤、胶质瘤、胰腺癌、膀胱癌等肿瘤的相关信号通路。

图6 LGD抗乳腺癌靶基因KEGG信号通路富集分析Y轴为通路名称,X轴为富集因子,气泡大小代表富集的基因数目,颜色代表富集显著性(P值),颜色由绿到红表示富集的程度由低到高,对应的P值由小到大Fig.6 KEGG pathway enrichment analysis of target genes of anti-breast cancer of LGDThe Y axis gives the pathway name,the X axis is the enrichment factor,the size of bubble represents the number of enriched genes,the color represents the significance of enrichment(P value),the color from green to red indicates that the degree of enrichment varies from low to high,and the corresponding P value varies from small to large
2.8 LGD对MDA-MB-231细胞PI3K/Akt通路相关蛋白表达水平的影响
通过CCK-8实验结果以及KEGG富集结果分析,LGD有可能通过调控PI3K-AKT信号通路发挥抗乳腺癌的作用。为了进一步确定LGD能否通过调控PI3K-AKT信号通路,发挥其抗乳腺癌的作用,采用不同浓度的LGD处理MDA-MB-231细胞24 h后,采用Western blot技术对细胞中AKT的表达水平进行检测。如图7A和图7B所示,LGD能够显著抑制AKT的表达。随后,用AKT的特异性激活剂 SC79(20 μmol/L)处理细胞后,细胞中 p-AKT的表达水平被显著上调,当用0.5 mg/mL浓度的LGD继续处理细胞24 h,上述现象被明显地逆转(图7 C和D)。这说明LGD通过抑制AKT蛋白激活,从而调控PI3K-AKT信号通路。
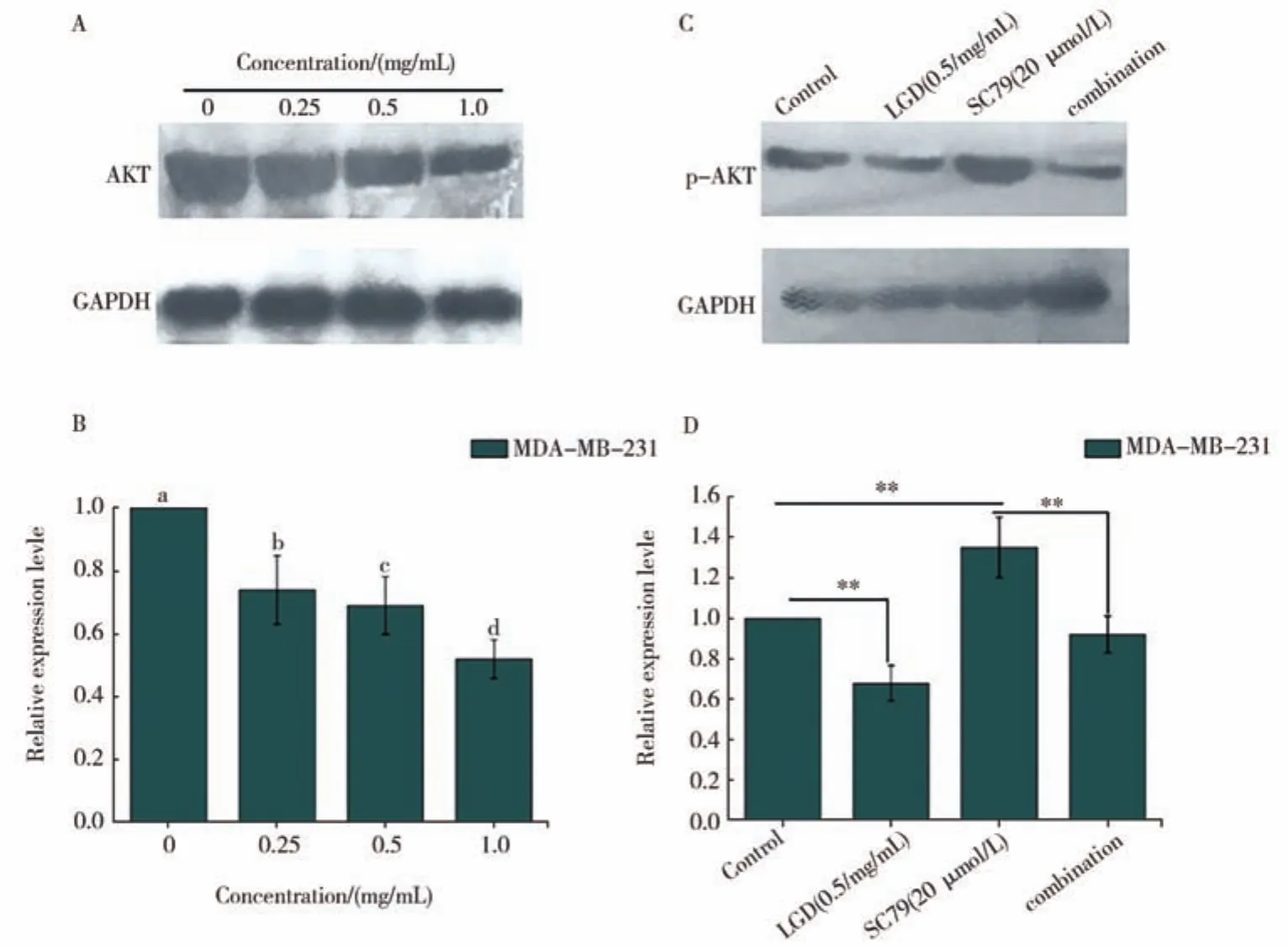
图7 采用western blot分析LGD通过抑制MDA-MB-231细胞A:AKT蛋白,B:AKT相对表达量,C:p-AKT蛋白,D:p-AKT相对表达量。Image J软件分析柱状图中不相同的字母代表两组数据间具有显著性差异,P<0.05。相关蛋白表达水平发挥抗乳腺癌作用Fig.7 Anti-breast cancer effect of LGD through inhibiting the expression levels of related proteins MDA-MB-231 cells by western blot assayA:AKT protein,B:the expression levels of AKT,C:p-AKT protein,D:the expression levels of p-AKT,in Image J software columns with no letters in common are significantly different between two groups,P< 0.05
3 讨论
中医药具有多成分、多靶点、高效低毒的优点,可调控肿瘤的发生、发展及免疫调节等多个阶段,目前对于中药防治肿瘤的作用机制的研究尚处于初步阶段。网络药理学整合了药理学和信息网络,用于探索药物对疾病的基本药理作用及其机制,借助网络药理学,可以直接从大量的数据中识别药物和疾病靶点,适用于研究中药与疾病之间复杂的作用机制[11-12]。本课题组前期研究发现,LGD具有显著的抗乳腺癌作用,但其作用机制尚不明确,本研究在前期研究基础上,基于网络药理学对其抗乳腺癌作用机制进行分析。
本研究筛选出LGD的134个有效活性成分及其靶基因(表1),与检索得到的乳腺癌相关靶基因进行映射,确定了66个关键靶基因(图2),对“药物-成分-靶基因-疾病”网络图进行拓扑分析,确认wogonin、DFV、Eriodyctiol(flavanone)、beta-sitosterol等共 26个抗肿瘤活性成分(图3)。有研究表明,核心成分wogonin可诱导MDA-MB-231永久性增殖抑制,降低TXNRD2的表达,控制细胞ROS水平[13]。LGD抗乳腺癌的PPI结果分析显示AKT1、ESR1、CCND1、Caspase-3、EGFR 为核心靶点(图4)。AKT1是肿瘤中最常见的活化蛋白激酶之一,在乳腺癌浸润进展过程中发挥重要作用,调控AKT1的表达可抑制乳腺癌细胞增殖,以AKT1作为靶蛋白抑制乳腺癌的恶性进展可作为治疗新方向[14-16]。ESR1突变是雌激素受体阳性类乳腺癌继发性耐药的重要机制之一,约有75%的乳腺癌诊断病例属于该类;同时,ESR1也是乳腺癌预后不良的重要检测指标[17-18]。CCND1(cyclin D1)的过度表达广泛存在于原发性乳腺肿瘤中,作为靶向蛋白,其低表达可抑制细胞增殖、侵袭以及提高化疗敏感性[19-20]。Caspase-3(CASP3)是一种半胱氨酸蛋白酶,主导细胞凋亡,有研究调查NAC手术的浸润性乳腺癌患者,结果显示Caspase-3可能为非pCR患者的潜在预后标志物[21]。EGFR是肿瘤发生的驱动因素,有研究表明肿瘤组织中EGFR蛋白表达明显高于癌旁正常组织,并与乳腺癌的侵袭能力、临床分期等相关联[22-23]。
通过对LGD抗乳腺癌的生物学过程进行富集分析,发现LGD可能是通过促进细胞增殖分化、诱导细胞凋亡、抑制炎症反应、氧化应激等多靶点发挥治疗乳腺癌的作用。KEGG富集分析结果显示Pathways in cancer信号通路(癌症信号通路)、PI3K-AKT信号通路等通路与LGD抗乳腺癌作用密切相关(图6)。其中共25个靶基因参与了PI3K-AKT通路,提示LGD可能主要通过抑制PI3K-AKT信号通路发挥抗肿瘤效应。PI3K-Akt信号通路可调节细胞基本功能,如增殖、凋亡、转录、翻译等,其活性异常可导致细胞恶性转化。现代研究表明PI3KAkt信号通路在多种肿瘤组织中高表达,如肺癌、乳腺癌、卵巢癌、鼻咽癌等[24]。兴伟等发现山慈菇提取液可抑制乳腺癌MDA-MB-231细胞增殖,诱导其凋亡,机制可能与抑制PI3K/Akt信号通路活化有关[25]。孙浩等研究发现消癌解毒方可抑制MDAMB-231细胞的增殖,并使肿瘤细胞周期阻滞于G2/M期,可能与抑制PI3K/AKT信号通路的活化有关,可上调 P53、P21蛋白表达,下调 CyclinB1、CDK1蛋白表达[26]。通过 Western blot进一步分析,我们发现LGD可抑制AKT的表达,而用AKT的特异性激活剂SC79处理后,p-AKT的表达水平被显著上调,推测LGD通过影响PI3K-AKT信号通路发挥抗乳腺癌的效应(图7)。
4 结论
本研究基于网络药理学方法筛选了LGD有效成分的靶基因,构建了LGD的“药物-成分-靶基因-疾病”网络,证明了LGD通过抑制PI3K-AKT信号通路发挥抗乳腺癌的作用机制,为后续实验验证提供理论依据。
