全新百部生物碱衍生物抑制结肠癌细胞活性研究
2021-05-19吴晓晓张梦晨杨鹏武兴康马开庆
吴晓晓,张梦晨,杨鹏,武兴康,马开庆
(1.山西大学 中医药现代研究中心,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006;3.山西大学 分子科学研究所,山西 太原 030006)
0 引言
百部(stemona japonica)作为药用植物在我国已有上千年的应用历史,作为其主要活性成分的百部生物碱(Stemonaalkaloids)是从直立百部(Stemo-na sessilifolia)和其近缘植物的根部分离得到的结构类似,具有相同生源的一类结构奇特且骨架变化多样的生物碱[1]。迄今为止,已经有150多种百部生物碱从植物中分离出来[2]。此类天然产物具有多样性的结构且具有显著的生物学活性,包括镇咳活性[3],毒蕈碱 M5受体和 Sigma-受体结合活性[4],逆转多药耐药性[5]和 Pim-3激酶抑制活性[6]。在先前的研究中,我们通过使用路易斯酸催化串联反应和催化羰基化合成了百部生物碱天然产物bisdehydroneostemoninine,bisdehydrostemoninine和 parvistemonine A[7-8],这有利于后续天然产物类似物的制备和进一步的生物学评价。
结直肠癌(colorectal cancer,CRC)是全球第四大最常被诊断出的癌症,也是与癌症相关死亡的第二大主要原因。近10年来我国结肠癌发病率呈明显升高趋势,据预测到2035年我国的结肠癌的发生率和死亡率都会有大幅度增加,严重威胁患者的健康和寿命[9]。5-氟尿嘧啶(5-FU)是针对多种类型癌症(包括CRC)的常用化疗药物,其主要通过抑制胸苷酸合酶(TS)并将其代谢物掺入RNA和DNA发挥其抗癌作用[10],但5-FU的临床疗效随着时间而显著降低,这是由于癌细胞耐药表型的发展所致。因此,进一步研究预防耐药性癌症形成对于增强CRC治疗的效力至关重要[11],发现具有显著抑制HCT-8及其耐药细胞株活性的新型骨架小分子具有重要的意义。本文报道了百部生物碱及其衍生物的合成及其对HCT-8/5-FU和HCT-8细胞毒性研究。
1 实验部分
1.1 合成实验
所有的实验均在氩气保护下干燥溶剂中进行。所有试剂均购自商业渠道,无需进一步纯化即可使用。使用TMS作为内标,在环境温度下于Bruker AV-600光谱仪(Bruker Co.Billerica,美国)上记录NMR光谱。使用Thermo Scientific Q Exactive(Thermo Fisher Scientific Inc.Waltham,USA)在质谱实验室记录高分辨率质谱(HRMS)。根据先前报道的方法制备天然产物bisdehydroneostemoninine(11)和衍生物 2、4-10[7]。衍生物 1根据先前报道的方法制备[8]。
1.2 生物测试
细胞培养:人结肠正常细胞系FHC和人CRC细胞系DLD1和HCT116细胞购自美国典型培养物保藏中心(ATCC,Manassas,VA,USA)。 HCT-8和HCT-8/5-氟尿嘧啶抗性细胞系(HCT-8/5-FU)从中国典型培养物保藏所(中国上海)获得。这些细胞在补充有体积分数10%胎牛血清和1%青霉素的RPMI 1640培养基中生长,并在装有体积分数5% CO2的潮湿培养箱中于37°C孵育。
2 实验方法
2.1 合成实验
(3aR,10bR)-1-亚甲基-1,3a,4,5,6,6,10b-六氢-2H-呋喃[3,2-c]吡咯并[1,2-a]氮杂化合物(3)在-78 ℃下向(3aR,10bR)-1,3a,4,5,6,6,10b-六氢-2H-呋喃[3,2-c]吡咯并[1,2-a]氮杂-2-2-酮(50 mg 0.26 mmol)的 THF(12.5 mL)溶液中缓慢加入在中的双(三甲基甲硅烷基)酰胺锂(1.53 mL,0.5 mol/L,1.0 mmol),然后将所得混合物在相同温度下搅拌0.5 h。向上述溶液中加入Eschenmoser salt(396 mg,2.14 mmol),然后将所得混合物缓慢升温至-30℃。通过在-30℃下添加饱和NH4Cl溶液淬灭反应混合物,然后升至室温。用EtOAc萃取反应混合物3次,并在真空下除去溶剂,得到黄色油,其无需进一步纯化即可用于下一步。
向上述粗胺化合物的异丙醇(1.25 mL)溶液中加入 2-氯 4,6-二甲氧基-1,3,5-三嗪(35.5 mg,0.2 mmol)和三乙胺(20 mg,27 μL),0.2 mmol)。将混合物在室温搅拌1.5 h并浓缩,得到残余物,将其通过柱色谱法纯化(PE:EA = 1∶1),以55%的收率得到所需化合物29 mg。

2.2 生物测定
细胞活力测定:使用MTT测定法确定化合物3对指定细胞的抑制作用。将细胞以3×103/孔的密度分配在96孔板中,温育过夜后在指定的时间段内用不同浓度的化合物3处理细胞。将20 μL MTT(5 mg/mL)添加到培养基中,并在37°C下孵育4 h。除去上清液后,将DMSO添加到每个孔中。在570 nm处测量吸光度。
菌落形成测定:将HCT-8细胞和HCT-8/5-FU细胞以每孔500个细胞的密度接种到6孔板。将细胞用各种浓度的化合物3处理14 d,并保持在37°C。用甲醇固定并用结晶紫染色后,在相差显微镜下捕获菌落。
FITC-Annexin V/PI染色法检测细胞凋亡:使用膜联蛋白V-FITC细胞凋亡检测试剂盒(Key-GEN BioTECH,南京,中国)进行FITC-Annexin V和PI细胞凋亡测定[12-14]。将HCT-8细胞用化合物3处理24 h后,收集细胞并用PBS洗涤,重悬于结合缓冲液中,与 5 μL Annexin V-FITC 和 5 μL PI在室温下于室温孵育20 min。通过流式细胞仪(BD bioscience,美国)分析凋亡细胞。
统计分析:数值表示至少三个独立实验的平均值±标准偏差(SD)。两组之间的差异是使用t-检验确定的。P<0.05被认为具有统计学意义。
3 结果与讨论
3.1 化学
根据先前报道的方法制备了天然产物bisdehydroneostemoninine 和其衍生物 1-2,4-11[7-8](如图1所示)。化合物2在碱性条件下与Eschenmoser salt反应,得到二甲胺中间体12,其无需进一步纯化即可用于下一步。首先探索了采用DBU进行甲基化和霍夫曼消除的常规方法,但该反应仅得到了双键异构化化合物13而不是所需的产物3。注意到了一种简便的一步法消除二甲基氨基,用2-氯-4、6-二甲氧基-1、3、5-三嗪和三乙胺在 Eschenmoser的亚甲基化反应中进行了研究,以55%的收率形成了化合物3。
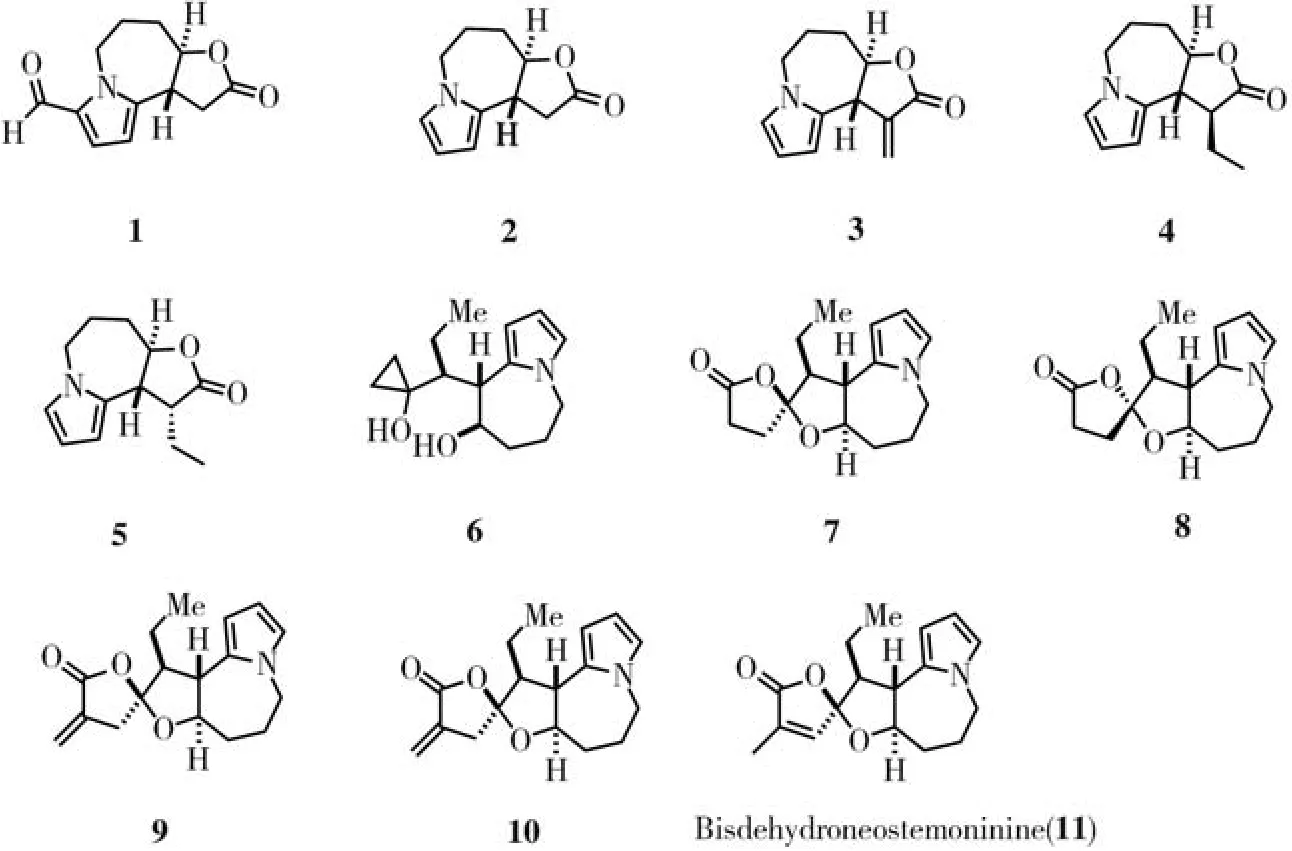
图1 Bisdehydroneostemoninine以及衍生物的结构Fig.1 Structures of bisdehydroneostemoninine(11)and its derivatives

图2 化合物3的合成Fig.2 Synthesis of compound 3
3.2 生物活性
细胞化合物孵育24 h后,针对HCT-8/5-FU细胞筛选所有制备的化合物(如图3所示),其中,天然产物bisdehydroneostemoninine对HCT-8/5-FU细胞没有细胞毒活性。衍生物3在100 μmol/L的浓度下显示出对HCT-8/5-FU细胞的有效细胞毒性作用。用乙基取代环外双键,衍生物5显示出弱的细胞毒性活性,而在羰基的α-位没有取代基的衍生物2显示没有活性,这表明亲电共价活性基团部分是至关重要的活性部分。

图3 bisdehydroneostemoninine和它的衍生物的细胞毒性活性(*P<0.05,**P<0.01)Fig.3 Cytotoxic activities of the bisdehydroneostemoninine and its derivatives(*P<0.05,**P<0.01)
为了检查以上观察到的现象是否不仅限于HCT-8/5-FU细胞,用化合物3处理HCT-8,DLD1,HCT116和HCT-8/5-FU,化合物3和上述CRC细胞孵育24 h后的结果表明,化合物3以剂量依赖性方式抑制所有CRC细胞增殖。当CRC细胞系 于 100 μmol孵育24 h 时 ,HCT-8,HCT116 和HCT-8/5-FU的细胞存活率为40%~55%。值得注意的是,即使在100 μmol下,化合物3对正常结肠细胞FHC没有显著的抑制作用(图4)。

图4 化合物3剂量依赖抑制CRC细胞的生长(共孵育24 h)Fig.4 Compound 3 dose-dependently inhibited cell growth of CRC cells(incubation in 24 h)
进一步的研究表明,化合物3以时间依赖性方式抑制HCT-8和HCT-8/5-FU细胞中的细胞增殖(图5),HCT-8和HCT-8/5-FU细胞与化合物3孵育24 h后出现细胞毒性,当浓度为20 μmol化合物3与HCT-8孵育72 h后,细胞存活率减少到50%,当浓度为50 μmol化合物3与HCT-8/5-FU孵育72 h后,细胞活力存活率减少到50%。

图5 化合物3对CRC细胞增长的剂量和时间依赖抑制Fig.5 Compound 3 dose-and time-dependent inhibition of cell growth of CRC cells
为了进一步确定化合物3对CRC细胞增殖能力的抑制作用,评价了化合物3在50 μmol和100 μmol浓度时,对HCT-8和HCT-8/5-FU集落形成能力的长期抑制作用。结果表明:化合物3可以显著地抑制两种CRC细胞系的集落生长(图6)。此外,流式细胞术实验表明化合物3可以促进HCT-8细胞的细胞凋亡(图7)。从以上结果可知,表明化合物3对能显著抑制HCT-8和HCT-8/5-FU的增殖能力,并诱导其凋亡。

图6 化合物3抑制细胞的集落形成Fig.6 Compound 3 inhibited colony formation of cells
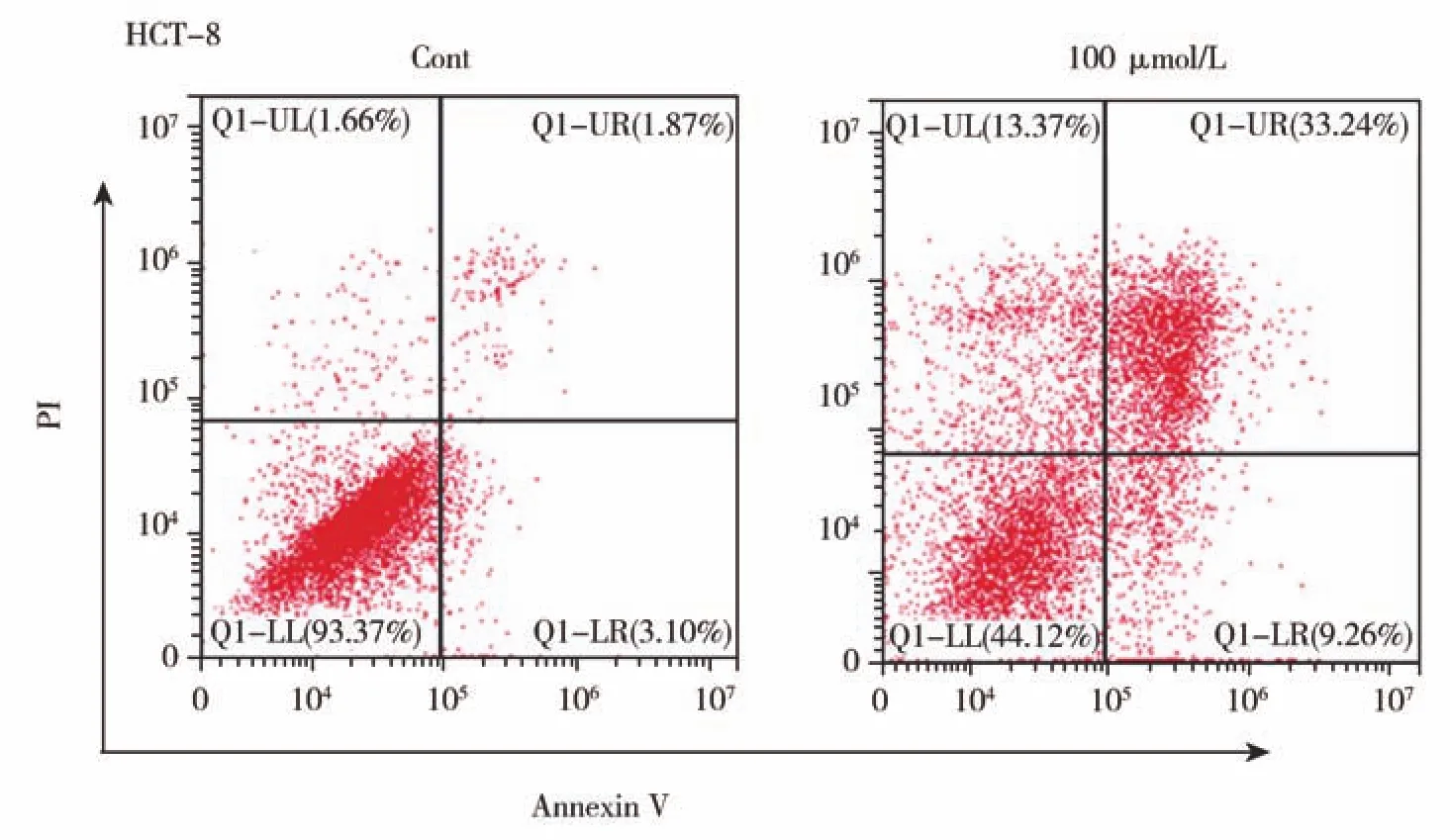
图7 化合物3诱导HCT-8细胞凋亡Fig.7 Compound 3 induced apoptosis in HCT-8 cells
4 结论
本文合成了bisdehydroneostemoninine和一系列百部生物碱衍生物,并评价了它们对HCT-8和HCT-8/5-FU细胞的细胞毒性,发现具有百部生物碱骨架的小分子化合物3以剂量和时间依赖性方式诱导HCT-8和HCT-8/5-FU细胞凋亡;同时,该化合物还对其他不同遗传背景的CRC细胞(DLD1,HCT116)具有显著的抑制活性,但是其对正常结肠细胞(FHC)没有作用,表明化合物3对CRC细胞的抑制具有一定的选择性。上述研究结果表明化合物3对CRC细胞及其耐药株具有显著的抑制活性,且与现有临床一线药物5-FU的作用机制有区别,但是该类小分子是通过何种生物机制产生细胞毒性的需要进一步的研究。
