兔支气管败血波氏杆菌外膜囊泡的制备及其蛋白质成分分析
2021-05-18南黎黄叶娥肖琛闻王志鹏韦强季权安李科刘燕鲍国连
南黎,黄叶娥,肖琛闻,王志鹏,韦强,季权安,李科,刘燕*,鲍国连*
(1.浙江师范大学化学与生命科学学院,浙江 金华321000;2.浙江省农业科学院畜牧兽医研究所,杭州310021)
支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)是一种需氧、高度传染性的革兰阴性菌,常见于各种家畜和野生哺乳动物的上呼吸道,可引起哺乳动物呼吸道感染,如造成兔和豚鼠的气管支气管炎(鼻塞)、狗的犬支气管肺炎(犬舍咳嗽)以及猪的鼻甲萎缩[1]等;还可感染免疫功能低下者,造成严重的肺部疾病,甚至危及生命[2]。在规模化养兔场中,波氏杆菌在我国多个省的兔群中普遍存在,给养殖户造成极大经济损失,已成为兔病防治的一大难题。而预防该疾病最有效的措施是接种疫苗。目前,市面上针对兔波氏杆菌的兽用疫苗主要是灭活苗,虽然大部分灭活苗能够引起高血清抗体滴度,但持续时间短,保护率低[3]。由于这种病菌对人类和动物的健康造成重大影响,故亟须研发有效的新型疫苗。
外膜囊泡(outer membrane vesicles, OMVs)是细菌生长过程中分泌的一种直径介于10~300 nm之间的球形结构,其无生命活性并且不可复制,在不同温度和处理下都能保持完整和稳定[4-5]。OMVs包含蛋白质、DNA、RNA、脂多糖(lipopolysaccharide,LPS)、酶和肽聚糖等细菌成分[6-7],能够有效引起机体对细菌感染的先天性和适应性免疫应答[8-10],使其成为潜在的新型疫苗候选者。许多研究显示,OMVs 是有前景的对抗细菌感染的疫苗候选者,例如对抗流感嗜血菌、多杀巴斯德菌、霍乱弧菌、产肠毒素的大肠埃希菌、百日咳博代杆菌和鼠伤寒沙门菌[11-15]。脑膜炎奈瑟菌的外膜囊泡(OMVs)已经被成功研发成商品化的疫苗,这充分说明OMVs 在疫苗的研发方面有其独特的优势。OMVs对于兔波氏杆菌新型亚单位疫苗的研究将具有积极的意义。
OMVs的产生一般是细菌对包膜作用压力的普遍反应,往往由多种生存条件引起。当细菌处于恶劣的环境时,各种应激因素如温度、营养物质的消耗和有害化学物质的暴露均可诱导产生OMVs[16]。目前,OMVs 的生产存在产量低、成本高等缺陷[17]。为此,本研究拟通过对细菌培养时间的优化及生长环境的改变,最大化提高OMVs 的产量,建立兔波氏杆菌OMVs 最佳制备工艺,为后续工业化大规模批量生产兔波氏杆菌OMVs 奠定基础;揭示兔波氏杆菌OMVs 的理化性质及蛋白质组成,以期为基于OMVs的兔波氏杆菌疫苗设计提供基础信息和潜在策略。
1 材料与方法
1.1 材料
1.1.1 菌株及主要试剂
兔波氏杆菌强毒株FX-1由浙江省农业科学院畜牧兽医研究所分离鉴定并保存。胰蛋白胨大豆琼脂(tryptone soya agar, TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)、胰蛋白胨(tryptone)购自美国赛默飞世尔科技有限公司;蛋白胨B、蔗糖购自上海市BBI 生命科学有限公司;Mueller-Hinton(MH)肉汤、Bradford 蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;头孢氨苄(98%)购自上海源叶生物科技有限公司;Tris-乙二胺四乙酸(Tris-ethylene diamine tetraacetic acid,TE)缓冲液购自生工生物工程(上海)股份有限公司;脱氧胆酸钠购自德国Sigma-Aldrich公司;4%~12%ExpressPlusTM蛋白预制胶、Mops电泳缓冲液购自南京金斯瑞生物科技有限公司;分子标志物购自美国Bio-Rad公司。
1.1.2 仪器设备
SpectraMax M5 Model 550 酶标检测仪购自美国Molecular Devices公司;超滤管(100 kDa)购自美国Millipore公司;Forma 702超低温冰箱购自美国赛默飞世尔科技有限公司;eStain L1蛋白染色仪购自南京金斯瑞生物科技有限公司;PowerLook 2100XL-USB扫描仪购自台湾省力广科技股份有限公司;CR21GⅡ高速冷冻离心机、CP100WX超速冷冻离心机和H7650透射电子显微镜购自日本日立公司;GNP-9270 恒温培养箱购自上海精宏实验设备有限公司;HZ-9210K、DHZ-CA恒温摇床购自江苏省太仓市华利达实验设备有限公司;EPS 601电泳仪购自美国GE Healthcare公司;ZetaView PMX 110纳米颗粒追踪分析仪购自德国Particle Metrix公司。
1.2 试验方法
1.2.1 OMVs 制备方法的筛选
将兔波氏杆菌FX-1菌株划线接种于胰蛋白胨大豆琼脂(TSA)平板上,于37 ℃条件下培养36 h,挑取单菌落接种于2 mL 胰蛋白胨大豆肉汤(TSB)培养基中,于37 ℃、200 r/min摇床培养10 h后,按体积比1∶100 扩大培养200 mL 菌液。采用稀释涂布分离计数法测定细菌培养中菌落形成单位(colony forming unit, CFU)的数量。将菌液倍比稀释,取1×106、1×107、1×108这3个稀释度的菌液各100 μL涂布于TSA 平板并计数,每个稀释度重复3 次并进行活菌数测定。分别采用超声破碎法和超滤浓缩法制取兔波氏杆菌OMVs,方法如下。
超声破碎法:将培养至对数生长末期的200 mL菌液计数后,在4 ℃条件下,以1×104g离心20 min,弃上清液;沉淀用TE 缓冲液复苏,在冰水中超声20 min后,在4 ℃条件下,以1×104g离心30 min,取上清液;以0.45 μm 的滤器过滤,并将滤液在4 ℃条件下,以4×104g超速离心3 h;将收集的沉淀重悬在溶有1.5%的脱氧胆酸盐的TE缓冲液中,每6 mL重悬液加2 mL 60%的蔗糖溶液,在4 ℃条件下,以1×105g超速离心2 h;OMVs 出现在TE/蔗糖界面,将其收集到Eppendorf管中,并于-80 ℃条件下保存,待用。
超滤浓缩法:将培养至对数生长末期的200 mL菌液计数后,在4 ℃条件下,以1×104g离心20 min,取上清液;经0.45 μm的滤器过滤后,收集到超滤管(截留分子质量为100 kDa)中,在4 ℃条件下,以5 000g离心20 min,以浓缩滤液;接着在4 ℃条件下,以1×105g超速离心2 h,弃上清液;沉淀用TE 缓冲液重悬,于-80 ℃条件下冻存。
通过比较分析用这2种方法制备的OMVs蛋白含量及成分,筛选最优制备方法。
1.2.2 OMVs 制备条件的优化
确立较适制备方法后,对培养时间、抗生素的添加量、过滤方法等条件进行逐一优化,确立兔波氏杆菌OMVs最佳制备工艺。
1.2.2.1 最佳培养时间的确定
将分离保存的兔波氏杆菌菌株FX-1 划线接种于TSA平板上,于37 ℃条件下培养36 h,挑取单菌落接种于2 mL TSB 培养基中,于37 ℃条件下,以200 r/min 摇床培养10 h 后,按体积比1∶100 扩大培养200 mL菌液,培养时间分别选取对数生长末期附近14、16、18、20、22 h,计数后按上述超滤浓缩法制备兔波氏杆菌OMVs。通过测定不同培养时间下制备的OMVs蛋白含量,确定最佳培养时间。
1.2.2.2 最佳抗生素添加量的确定
首先需要确定所使用抗生素的最小抑菌浓度(minimal inhibitory concentration,MIC)。在无菌条件下,将兔波氏杆菌划线于TSA平板上,置于37 ℃恒温箱中过夜培养,以达到分离纯化的目的;然后用接菌环挑取单个典型菌落接种于5 mL MH 肉汤是,置于37 ℃恒温摇床中过夜培养;最后用分析天平称取0.128 g 头孢氨苄(98%),溶于10 mL 超纯水中,配成终质量浓度为12.8 mg/mL的储备液10 mL,分装后保存于-80 ℃冰箱中,备用。
采用微量肉汤稀释法测定最小抑菌浓度,操作过程及结果判读严格按照临床实验室标准化协会(Clinical and Laboratory Standards Institute)的标准进行,具体步骤如下:将MH肉汤培养的菌液稀释到0.5 麦氏比浊度,然后将MH 肉汤以体积比1∶1 000稀释,使其浓度达到1×105CFU/mL。取灭菌的96孔板置于无菌操作台上,向第1 孔加入8 μL 12.8 mg/mL 的头孢氨苄和92 μL 的MH 肉汤(头孢氨苄质量浓度为1 024 μg/mL),其他第2—11 孔分别加入50 μL MH 肉汤,然后从第1 孔吸取50 μL 至第2孔,依次倍比稀释,到第10孔时弃去50 μL,第11孔只加入50 μL MH肉汤,然后每孔加入50 μL的菌液(第1—11 孔中头孢氨苄的质量浓度分别为512、256、128、64、32、16、8、4、2、1、0 μg/mL),第11 孔作为阳性对照,第12孔仅加入空白肉汤100 μL作为阴性对照。将96 孔板密封,置于37 ℃恒温培养箱中孵育20~24 h后判定结果,记录细菌浊度值[D(600 nm)][18]。每组试验至少重复3次。结果以在小孔内完全抑制细菌生长的最低药物浓度为MIC。当出现单一跳孔时,记录抑制细菌生长的最高药物浓度为MIC。
确定头孢氨苄对兔波氏杆菌的MIC 后,设定5个浓度,分别为1/16 MIC、1/8 MIC、1/4 MIC、1/2 MIC、1 MIC,以最佳培养时间培养,计数后按上述超滤浓缩法制备兔波氏杆菌OMVs,通过测定不同头孢氨苄浓度下制得的OMVs 蛋白含量,确定头孢氨苄的最佳添加量。
1.2.2.3 最佳过滤方法的确定
设计2组试验,在制备兔波氏杆菌OMVs时,将上清液分别用0.45和0.22 μm 2种滤器过滤,比较不同滤膜过滤后的OMVs 溶液中的蛋白质含量;同时,为确保得到的OMVs 中没有活菌,将1 mL 滤液置于TSA 平板上,于37 ℃条件下孵育过夜。最终确定最佳滤膜孔径大小。
1.2.3 OMVs 的理化性质分析
1.2.3.1 形态学观察
分别用透射电镜(transmission electron microscope, TEM)和扫描电镜(scanning electron microscope,SEM)对OMVs进行形态学观察。
取10 μL OMVs 样品滴在蜡纸上,将铜网与样品液表面接触,静置3~5 min,用滤纸吸去多余的样品。用2%的磷钨酸对样品进行负染色,晾干后在H7650 透射电镜下观察OMVs 的形态,用高灵敏度电荷耦合器件(charge-coupled device,CCD)相机记录试验结果。将OMVs 用样品固定液固定,经脱水、干燥后,将其紧贴于导电碳膜双面胶上并放入离子溅射仪样品台上进行喷金30 s左右,通过SEM观察OMVs的表面结构。
1.2.3.2 Zeta电位和纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)
将OMVs 样品用1×磷酸盐缓冲液稀释1×104倍,进样检测,在11个位置重复测量2次,用相应的软件ZetaView 8.04.02进行数据分析,试验温度保持在25 ℃左右。
1.2.3.3 OMVs蛋白含量的测定与分析
使用Bradford蛋白检测试剂盒检测OMVs蛋白含量。按照试剂盒说明书进行操作。以牛血清白蛋白作为蛋白标准品,制备标准曲线。将OMVs 样品作适当稀释,加20µL到样品孔中;再加入200µL 1×G250 染色液,室温放置3~5 min;用酶标仪测定595 nm 波长下的吸光度,根据标准曲线计算出OMVs样品中的蛋白质含量,再按每菌落形成单位的蛋白质含量进行定量。试验温度保持在25 ℃左右。
通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)对兔波氏杆菌OMVs 样品的蛋白质成分进行初步分析。取80 μL样品加入20 μL 5×上样缓冲液,于100 ℃水浴锅中煮沸20 min,置冰上冷却10 min,以备上样。将4%~12%ExpressPlusTM蛋白预制胶放入电泳槽,倒入Tris-3-吗啉丙磺酸-十二烷基硫酸钠(Tris-MOPS-SDS)缓冲液,依次加入分子标志物和OMVs 样品,各蛋白样品设置3 个重复。在150 V电压下电泳50 min。
为进一步鉴定OMVs 中所含的蛋白质成分,将OMVs样品交由上海中科新生命生物科技有限公司,采用液相色谱-串联质谱法(liquid chromatographytandem mass spectrometry,LC-MS/MS)进行检测分析。质谱测试原始文件用Mascot 2.2 和Proteome Discoverer 1.4 软件进行查库鉴定及定量分析,针对UniProt 的Bordetella bronchiseptica(下载21 311 个 条目)数据库进行分析。采用以下方法鉴定OMVs 中的蛋白质:允许2个缺失的胰蛋白酶切割位点,肽质量容差为20,质谱/质谱容差为0.1 Da,设置蛋氨酸氧化、N端乙酰化和半胱氨酸氨基甲酰化的固定修饰,错误发现率(false discovery rate,FDR)≤0.01。通过肽段质谱匹配(peptide spectrum matches,PSMs)的数量来评估OMVs中蛋白质的准确性,匹配得越好,可信度越高;筛选前30 PSMs的蛋白质作为OMVs主要蛋白进行分析。使用DAVID 6.8(https://david.ncifcrf.gov/)对OMVs中蛋白质分子功能、细胞成分及生物过程进行基因本体(gene ontology,GO)功能注释和富集分析,每个类别的x轴按照P值(P<0.05)从上到下排序,上面的差异更明显,y轴表示每个类别的蛋白数量和蛋白总数的百分比。
考虑服务请求者的个性化需求,采用权重分配法来描述请求者的愿望。将所构建的多属性决策矩阵与服务请求者所设定的权重分配数值进行相乘然后再将计算出的单个QoS属性评价结果相加,得到Web服务综合评价值。如评价公式(8)所示
1.3 数据统计与分析
采用ZetaView 8.04.02 软件进行纳米颗粒追踪分析;采用Mascot 2.2 软件进行蛋白质组学数据分析;采用GraphPad Prism 8和OriginLab Origin 8.1进行统计分析和作图。结果以平均数±标准误表示,多组间比较采用单因素方差分析,2组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 OMVs 最优制备工艺的建立
从图1A中可以看出:培养时间在16~22 h之间时,每菌落形成单位(CFU)Bb产生的OMVs蛋白含量随着培养时间的延长呈先增加后下降的趋势,在18 h时达到最大值,故而18 h为最佳培养时间。在前期确定头孢氨苄MIC 的基础上(MIC=128 μg/mL),随着头孢氨苄质量浓度的增大,每菌落形成单位(CFU)Bb产生的OMVs 蛋白含量也随之增大(图1B);在64 μg/mL头孢氨苄处理下,每菌落形成单位(CFU)Bb产生的OMVs 蛋白含量比128 μg/mL 时的低,但实际蛋白质含量从1 634.91 μg(菌液量为2.12×109CFU)降低为389.59 μg(菌液量为4×108CFU),总蛋白量显著降低,因而64 μg/mL为头孢氨苄最佳添加量。从图1C~D可知,0.45 μm滤膜处理的每菌落形成单位(CFU)Bb产生的OMVs 蛋白含量远高于0.22 μm滤膜处理组,且2组滤液中均没有检测到活菌,因此,使用0.45 μm滤膜过滤一次更为经济。
综上所述,兔波氏杆菌OMVs最佳制备条件为:培养时间18 h,头孢氨苄的添加量64 μg/mL,使用0.45 μm滤膜过滤一次。

图1 OMVs最优制备工艺的建立Fig.1 Establishment of the optimum preparation technic of OMVs
2.2 OMVs 的理化性质
2.2.1 OMVs 的TEM、SEM 和NTA 观察结果
从图2A~B可知:OMVs呈球形囊泡状,直径介于10~300 nm之间,平均直径为127.83 nm±0.68 nm;NTA结果显示,样品含量达到(9.97±0.05)×1012mL-1(图2C),Zeta电势为-36.40 mV±0.75 mV(图2D)。
2.2.2 OMVs 中的蛋白质成分分析
将2 种方法提取的OMVs 进行SDS-PAGE 和LC-MS/MS 分析。从图3 中可知:2 种方法提取的OMVs 主要蛋白条带大小大致相同,而超声法提取的OMVs 与超滤浓缩法相比存在明显的杂条带。这归结于超声法制得的OMVs 不仅包含细菌本身分泌的外膜囊泡,还包括了在超声环境中诱导形成的囊泡状结构。结合质谱结果分析,构成兔波氏杆菌OMVs 的蛋白质有多种,表1 列出了PSMs 前30的蛋白质成分。其中,丝状血凝素、黏附素、侵袭素、外膜蛋白A、自主转运蛋白、绒毛蛋白以及主要蛋白条带P60 经质谱鉴定为60 kDa 伴侣蛋白(GroEL),P40 为鞭毛蛋白,这些保护性抗原大多是兔波氏杆菌中已知的毒力相关蛋白。此外,质谱鉴定出的腺苷酸环化酶溶血素(adenylate cyclasehemolysin,AC-Hly)、外膜孔蛋白、脂蛋白、脂质A脱酰酶PagL、假定的氨基酸ABC 转运可溶性结合蛋白、赖氨酸/异亮氨酸/缬氨酸结合蛋白等均是兔波氏杆菌OMVs中具有潜力的免疫原性蛋白。
由于超滤浓缩法制得的OMVs 相对纯度较高,包含多种免疫原性蛋白,且该方法相对超声法更简单,为后续规模化生产应用提供了可能,故而选择超滤浓缩法用于后续研究。
从图4A中可知:OMVs蛋白的生物学过程富集于蛋白质、核酸等生物合成及代谢过程,部分参与膜构建和膜内蛋白插入过程,猜测其与外膜囊泡的合成相关。从细胞成分上看,OMVs 蛋白富集于核糖体、细胞外膜以及外部封装结构上,其分子功能为参与核糖体的结构组成及小分子结合等(图4B~C),证实OMVs上的蛋白质是由核糖体参与合成的。

图2 超滤浓缩法制OMVs的TEM、SEM和NTA观察结果Fig.2 TEM, SEM images and NTA observation of OMVs prepared by centrifugal ultrafiltration
3 讨论
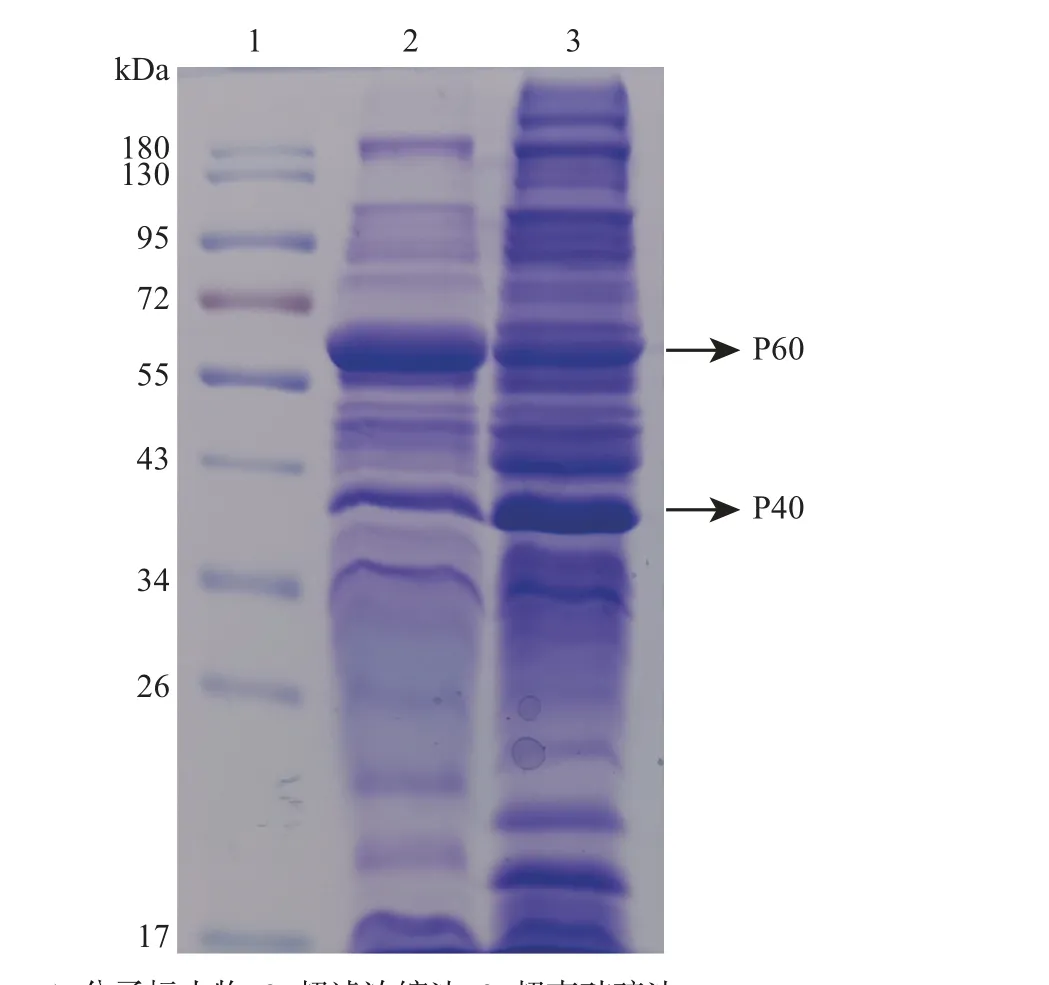
图3 SDS-PAGE 分析超滤浓缩法和超声破碎法制得的OMVs蛋白条带Fig.3 SDS-PAGE analysis of OMVs protein bands prepared by centrifugal ultrafiltration and ultrasonication
近年来,以纳米颗粒为基础的治疗方法引起了研究者们的极大关注。这些帮助小分子、多肽和蛋白质衍生药物传递的纳米粒子,如树状大分子、聚合物纳米颗粒、无机纳米颗粒,具有类似的靶向性和治疗药物装载特性,但它们在毒性或生物清除问题上存在局限性,脂质纳米颗粒(如脂质体)能够消除纳米颗粒的清除问题,但存在生产复杂、成本高等缺陷[19]。
细菌OMVs 是在近半个世纪前被发现的。研究发现,OMVs 在发病机制、细胞间通信、药物递送载体、疫苗开发、毒力因子传递等方面具有重要意义,在临床和其他相关领域显示出巨大的潜力。这种由细菌外膜释放,具有与亲本细胞膜相似的蛋白质、脂多糖(LPS)和脂质的纳米囊泡,其表面表达的病原体相关分子模式可以激活Toll 样受体(Tolllike receptor, TLR)信号,促进OMVs 进入宿主细胞[20],有效引起机体对细菌感染的先天性和适应性免疫应答。例如,产志贺毒素大肠埃希菌(STEC)OMVs可作为疫苗用于保护小鼠和黏菌群免受溶血性尿毒综合征的侵袭[21],从百日咳杆菌中分离到的OMVs 能使小鼠有效抵抗该菌的感染[22]。此外,细菌OMVs 可装载抗原、重组蛋白或药物。通过基因改造,在OMVs 表面表达多种靶向分子,实现选择性靶向递送药物,同时为制备多价疫苗提供可能。如KIM等[23]通过基因修饰来消除细菌内毒素功能,不仅增加了OMVs 的安全性,也显著诱导了小鼠长期抗肿瘤免疫反应的能力。装载多种毒力因子的具核梭杆菌OMVs,能够利用病原体毒力因子的抗原性生产有效疫苗而对抗结直肠癌[24]。GUJRATI等[25]发现,表面有抗HER2 亲合体的OMVs 可以选择性地传递到肿瘤细胞。这种细菌能够自主合成脂质,产生囊泡外表面的靶向配体,表达并包装囊
泡内包膜的重组蛋白,这是任何其他载体都难以实现的,使OMVs成为一种极有前途的纳米载体。

表1 超滤浓缩法制得的兔波氏杆菌OMVs主要蛋白质鉴定Table 1 Main proteins identified in OMVs from Bb prepared by centrifugal ultrafiltration
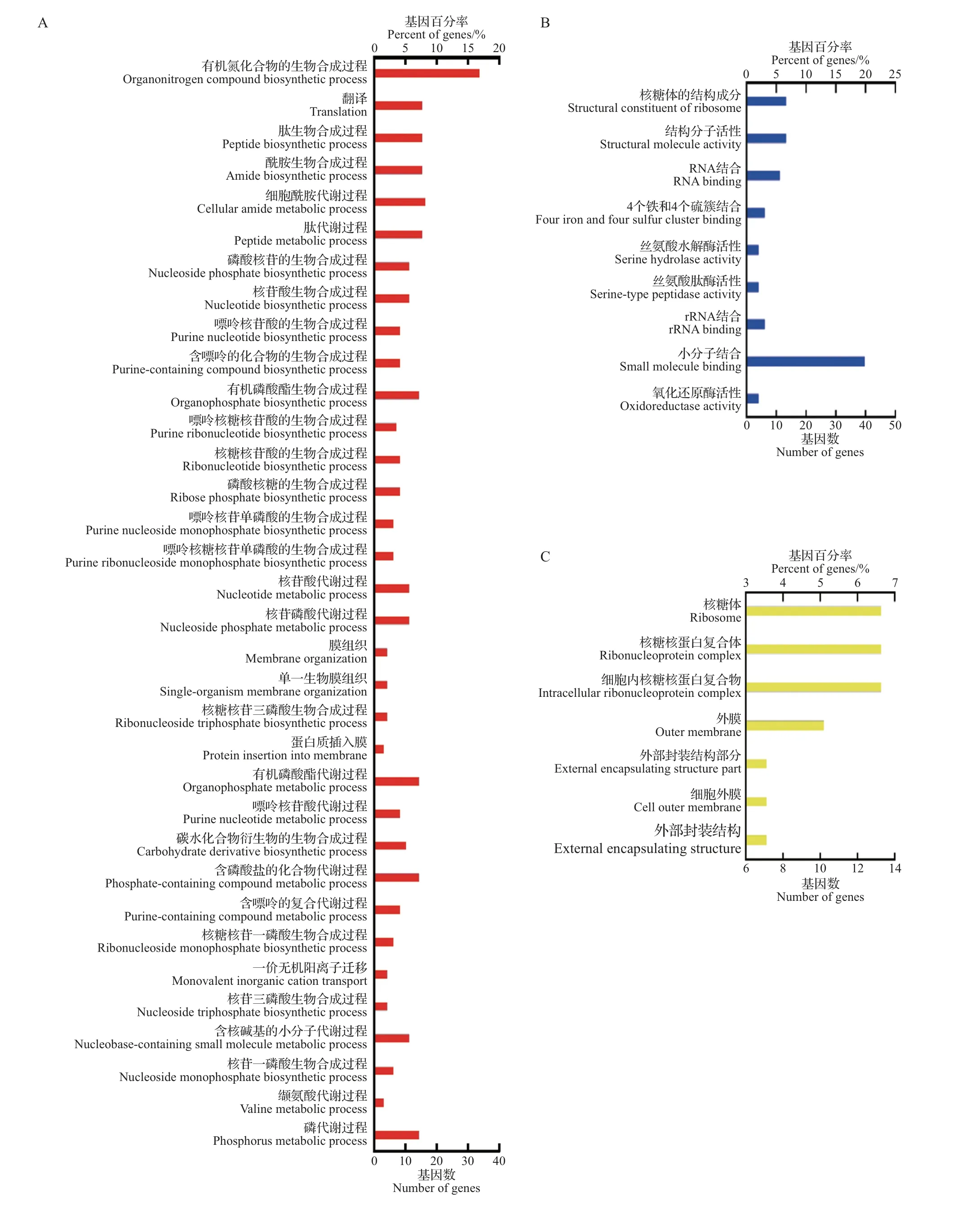
图4 基于基因本体论(GO)的兔波氏杆菌OMVs蛋白的功能注释和富集分析Fig.4 Functional annotation and enrichment analysis of the proteins in the OMVs from Bb based on gene ontology(GO)
波氏杆菌是革兰阴性菌,常见于哺乳动物的呼吸道中,该菌极易传播,宿主范围广泛。本研究围绕兔波氏杆菌OMVs 的制备开展相关研究,并对其理化性质进行综合评估。采用超声破碎法和超滤浓缩法2 种方法分别收集兔波氏杆菌OMVs,通过TEM和SEM观察发现,2种方法均能成功提取到OMVs;SDS-PAGE 分析显示,用这2 种方法提取的OMVs主要蛋白条带大小大致相同,而超声法提取的OMVs 较超滤浓缩法纯度低,因为超声法制得的OMVs 不仅包含细菌本身分泌的外膜囊泡,还包括了在超声环境中诱导形成的囊泡状结构,因而其蛋白成分更为复杂。质谱分析结果显示,超滤浓缩法提取的OMVs,其主要蛋白包含了丝状血凝素、黏附素、外膜孔蛋白、脂蛋白、鞭毛蛋白等兔波氏杆菌中重要的免疫原性蛋白;并且超滤浓缩法相对超声法操作更为简单,为后续规模化生产应用提供了可能,故而我们选择超滤浓缩法用于后续研究中。在对培养时间、抗生素添加量及过滤方法进行逐一优化后发现,培养时间为18 h,头孢氨苄质量浓度为64 μg/mL,以及采用0.45µm 滤膜过滤一次时,显著提升了OMVs的产量。
本研究制得的OMVs 呈纳米级球形囊泡,平均直径为127.83 nm±0.68 nm。质谱分析结果显示,超滤浓缩法制得的OMVs 具有多种与疾病发病机制有关的多肽。其中,OMVs 蛋白中有很多丝状血凝素,这类蛋白是兔波氏杆菌的毒力决定因子,它已作为一种成分被列入大多数非细胞性疫苗中[26]。黏附素和侵袭素与细胞间通信、刺激免疫反应以及一些毒力和感染机制有关[27]。60 kDa 伴侣蛋白(GroEL)是兔波氏杆菌OMVs 的主要成分,可促进多肽的重新折叠和装配,同时,其作为兔波氏杆菌毒力相关蛋白,OMVs 诱导的免疫血清能够识别GroEL 抗原[28]。鞭毛蛋白是一种有效的促炎因子,能够诱导趋化因子、细胞因子和宿主防御基因的表达[29]。自主转运蛋白、绒毛蛋白以及含β桶域的自主转运外膜蛋白定位于细胞外膜,具有自转运蛋白域,这类蛋白是典型的毒力因子,与致病菌的感染或毒力相关。外膜蛋白A(OmpA)可能与OMVs 的生物合成有关,同时也是一个有潜力的保护性抗原。经质谱鉴定的假定的氨基酸ABC转运可溶性结合蛋白、外膜孔蛋白、脂蛋白以及赖氨酸/异亮氨酸/缬氨酸结合蛋白,这些重组蛋白都能诱导高抗体效价,其中外膜孔蛋白和脂蛋白对兔波氏杆菌的侵袭具有保护作用[30]。此外,研究表明,腺苷酸环化酶溶血素(AC-Hly)、脂质A 脱酰酶PagL 也是兔波氏杆菌OMVs 中具有潜力的免疫原性蛋白[31]。总之,兔波氏杆菌OMVs 本身作为一种纳米级球形囊泡,其包含上述多种与毒力和感染机制有关的蛋白质,因而OMVs对于兔波氏杆菌新型亚单位疫苗的研究将具有积极意义。
综上所述,本研究建立了兔波氏杆菌OMVs 最佳制备工艺,为其工业化生产提供了可能;揭示了兔波氏杆菌OMVs 的理化性质及蛋白质组成,为新型亚单位疫苗的研发提供了科学依据。
