女性阴道微生态与HPV感染相关性研究进展
2021-05-18郑介婷张子康操龙斌张召邱峰
郑介婷 张子康 操龙斌 张召 邱峰★
2006年至今,全球发表微生物相关学术论著总数超过5 000 篇,是全球自然科学界中关注的热点[1]。随着培养组学、高通量测序技术等在人体微生态领域的广泛应用,肠道、生殖泌尿道、口腔、皮肤等部位的微生物在宿主及环境中的各种作用逐渐被揭示[2-3]。其中,女性阴道内正常菌群种类丰富、数量庞大,有序定殖在管壁上皮粘膜表面,有效抵御着感染和有害环境的形成[4]。这些微生物相互制约、相互协作,共同维持阴道微生态的动态平衡[5]。近期,阴道微生态与各种妇科疾病之间的相关研究越来越多,阴道微生物、阴道免疫调节作用和宿主基因之间的相互作用和关系也不断被报道[6-7]。
女性生殖道微生态可分为外生殖道微生态区系统和内生殖道微生态区系统,而外阴菌群是整个生殖道菌群最复杂的区域(图1)。研究报道显示,全球75%的女性曾患过生殖道感染,30%的生殖道感染者会发展为妇科重大疾病,这些均与阴道微生态的稳定密切相关[8]。临床发现,90%以上的宫颈癌病例与HPV 感染有关,但影响HPV 持续存在的因素尚清楚[9]。近期研究表明,HPV 感染与阴道微环境关系密切[10]。本文拟对女性阴道微生态菌群多样性的研究进展及其与生殖道感染性疾病的关系,尤其是与本团队长期研究的HPV 感染相关的研究进行综述,以期明确女性阴道微生物菌群在女性生殖道健康和疾病中的作用,并展望多种微生态制剂治疗方法在女性生殖健康领域的应用。

图1 女性生殖道微生态在分布区域示意图Figure 1 Schematic diagram of distribution area of female reproductive tract microecology
1 阴道微生态及其检测方法
阴道微生物组成复杂、动态变化性强,是引起女性泌尿生殖道感染的主要来源[11]。女性阴道微生态系统是由阴道微生物、内分泌调节系统、阴道解剖结构及宫颈局部免疫系统共同组成,形成一条天然的微生态屏障。正常情况下,健康的阴道中含有大量的乳酸菌与其他微生物[12]。阴道微生态的组成和变化受众多因素影响,其中女性激素水平的变化是最重要的内部影响因素[13]。在健康女性的某一段时间内,阴道微生物的组成却是一致和稳定的,这也是保证和维持女性生殖健康的主要屏障之一[14]。
阴道微生态检测目前主要分为两大类:一类是基于镜检的临床诊断检测,另一类是基于高通量的基础研究检测。临床诊断检测主要通过涂片染色镜检及病原菌培养两种方法对阴道分泌物进行检测,可明确阴道感染的类型[15]。分泌物样本的培养是另外一种临床诊断常用方法,常见的病源菌、支原体、衣原体、酵母菌等均可通过培养的方法进行鉴定[16-17]。而基础领域研究阴道微生态的主要方法,是基于高通量测试技术、LC-MS 技术为主的新型检测方法。高通量测序主要包括16S rRNA 检测、宏基因组检测、宏转录组检测。宏基因组检测可以达到种的水平,并提供更多的菌种代谢相关性信息[18]。
2 阴道微生态与常见妇科感染
2.1 细菌性阴道病与阴道微生态
细菌性阴道病(Bacterial vaginosis,BV)是育龄期妇女最常见的阴道感染性疾病之一。它本质上是一种由乳杆菌减少、阴道纤毛菌与阴道加德纳氏菌等厌氧菌增多引起的阴道微生态失调综合征[19]。随着对阴道微生态的持续关注与研究,引起BV 发生的细菌种属逐渐被发现,BV 的致病与诱发其他妇科感染性疾病的机制越来越明确。BV患者阴道内比正常女性多出40 多个属[11],这些微生物的增加可产生大量蛋白降解酶,破坏阴道与宫颈粘膜屏障,促使大量外部微生物进入阴道环境,诱导一系列其他妇科感染。根据现有的研究结果,BV 并不是女性阴道中某一种或几种细菌与宿主相互作用的结果,而是由多种微生物组成的病原性微生物群落造成的,其具体的机制还需要更多的研究人员关注[20]。
2.2 外阴阴道假丝酵母菌与阴道微生态
外阴阴道假丝酵母菌病(Vulvo vginal candidiasis,VVC)主要由白色念球菌、光滑念球菌、热带假丝酵母、近平滑念球菌等引起。有趣的是,与正常人群相比,VVC 阴道内优势菌群没有显著差异,这可能与细菌、真菌不同的代谢与生长模式有关。有报道显示,无论是口服还是阴道内使用基于乳酸菌的益生菌,均没有得到有效的治疗数据[11]。而Reid G 等[21]人研究表明特定乳杆菌菌株对复杂型VVC 的预防与治疗效果显著。深入探究VVC 患者阴道微生态的结构及其与宿主的相互作用关系,对阐明VVC 的发病机制具有重要作用。
2.3 滴虫性阴道炎与阴道微生态
滴虫性阴道炎(Trichomona1vaginitis,TV)与阴道微生态的相关性研究较少。目前有报道称,阴道滴虫的存在会消耗阴道上皮细胞的糖原,导致宫颈上皮组织坏死,促进阴道与宫颈粘膜表面的破坏,大大增加HPV 等病毒的入侵与定植[22]。但Meng 等[23]人研究发现TV 与HPV 感染无相关性;Ghosh 等[24]人也发现TV 与宫颈癌的发生和演变不具有相关性。目前,TV 的发生发展与阴道微生态的关系不明,还需更多的工作者关注。
2.4 宫颈炎与宫颈微生态
支原体、衣原体、淋病奈瑟氏菌感染是宫颈炎的主要诱导因素,促使子宫内粘性脓液增多。研究表明,宫颈微生物的结构不同于阴道微生物,其总体数量与类型均低于阴道微生物,这可能与宫颈所具有的独特环境有关[11]。Marrazzo 等[25]人的研究发现,BV 合并宫颈炎患者阴道内产H2O2的乳杆菌减少,但阴道其他的优势菌没有显著变化,这表明引起宫颈炎症的各种病原体的定植可能与产生H2O2的乳杆菌有密切相关,并影响阴道的自净功能。宫颈炎的发生必然与阴道微生态多样性密切相关,为此需要更多的基础研究与临床研究工作者更细致深入的探究。
3 阴道微生态与宫颈HPV 感染不同进程
近年来,大量文献报道阴道微生态中微生物的种类结构和环境的变化与HPV 初次感染、HPV 持续感染、宫颈粘膜局部免疫、鳞状上皮内病变、宫颈上皮内瘤样病变等密切相关[26-27]。如图2所示,阴道微生态的失调会促使HPV 易感、而HPV 感染也会加速阴道微生态的紊乱,但两者之间的关系尚不完全清楚。考虑到现在临床上对持续性HPV 感染并没有特别好的治疗方法,细致的探究HPV 感染进程中阴道微生态的具体变化与相互影响的机制,有助于探究以预防和治疗为主的阴道微生态制剂通过纠正阴道微生态的平衡,激活宫颈局部免疫自我清除HPV病毒的可能性。
毕庆庆等[28]人发现HPV 阴性组和HPV 感染后转阴患者的阴道微生物类型相对单一,主要以厚壁菌门、乳杆菌为主;但HPV 持续感染患者的阴道微生物多样性非常复杂,不动杆菌属、普雷沃菌属、假单胞菌属和鞘氨醇单胞菌属等具有显著统计学差异。王秀芳等[29]人发现HR-HPV 感染患者的菌群密集度分级、菌群多样性、乳酸菌分级、需氧菌性阴道病、细菌性阴道病、外阴阴道假丝酵母菌病检出率与低危型性人乳头病毒感染患者均具有显著的统计学差异。罗燕艳等[30]对334 例门诊HPV感染患者的检测数据进行分析,发现宫颈HR-HPV感染者的阴道微生态失衡会影响阴道清洁度、菌群多样性、优势菌、H2O2及PH 值等。
某些阴道微生物菌株可能在HPV 感染后发挥保护或致病作用,从而抑制或促进宫颈癌的发展。例如,卷曲乳杆菌对预防鳞状上皮内瘤病变具有保护作用,以及占优势的惰性乳杆菌可抑制CST IV的发展等[31]。这些结果都为以微生态制剂为主的新型HPV 感染治疗提供了很好的理论参考意义。然而,当前的主要问题集中在HPV 感染前后阴道微生态各种差异究竟是如何加速或者抑制HPV、上皮细胞病变,各个不同的菌株究竟是通过什么途径来影响宫颈局部免疫,这个过程中宫颈免疫、微生物、代谢物、微环境、上皮细胞等究竟是如何相互影响的?这些难点可能需要相关基础研究和临床诊断工作者继续探究,为有效治疗持续性HPV 感染患者、为预防HPV 感染提供更多、更好的手段。
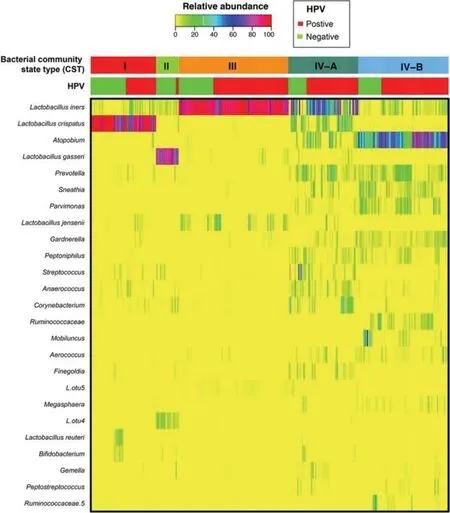
图2 阴道菌群与HPV 感染与否不同进程的相对丰度的热图菌群类型与丰度的差异Figure 2 The differences in the relative abundance of vaginal flora and flora types and abundances of different processes with or without HPV infection
4 阴道微生态、宫颈局部免疫在HPV 感染后清除中的作用
临床发现HPV 持续感染最终导致宫颈癌的患者只占少数,大多数HPV 感染可被宿主快速清除,即阴性转归,原因未明[32]。近期越来越多的证据表明,阴道菌群、HPV 感染进程和宫颈局部免疫系统相互作用,密切影响阴道环境的稳态和女性下阴道的健康[33]。宿主粘膜免疫反应和生殖器炎症在清除性传播感染疾病的病原体及预防再次感染方面发挥重要作用。有数据表明HPV 的宿主免疫清除与女性生殖道中的Th1 促炎应答相关,体外实验发现外周血CD8+T 细胞与HPV 蛋白的应答相关[34]。这些结果表明宿主免疫应答对HPV 的免疫清除必不可少。除了宿主自身的免疫系统外,由阴道菌群等组成的阴道微环境在实现阴道上皮细胞的保护和阴道局部免疫微环境的稳定过程中是否也发挥了作用?见图3。

图3 HPV 感染后人体免疫微环境的变化及其激活的免疫清除过程Figure 3 Changes of human immune microenvironment after HPV infection and the process of activated immune clearance
临床发现HPV 感染的妇女常伴各种下生殖道病原体的感染。这可能是由于BV 阳性的女性免疫力相比BV 阴性的女性更低,因而更容易感染HPV[35]。阴道微生物群的结构是动态的,并且可以发生CST 之间的转变。Brotman 等发现HPV 阳性女性阴道的菌群主要集中在CSTs III 和CSTs IV,并指出CST II 和加氏乳杆菌(L.gasseri)可能与快速清除急性HPV 感染有关,可作为潜在的治疗菌用于维持子宫颈的健康[36]。因此,我们团队推测阴道菌群与HPV 感染后的转归和预后密切相关。阴道微生物中的部分细菌产生的脂肪酸、脂多糖代谢物可直接识别激活NF-κB。尽管如此,基于HPV 感染的相关阴道菌群对宫颈局部免疫的调控机制的研究还寥寥无几,因此,明确影响HPV 感染转归和预后的关键阴道菌群及其作用机制具有重大意义。我们团队推测阴道菌群可以通过SAFA等代谢产物激活宿主TLR4/NF-kβ 信号通路并调节宫颈局部免疫,从而帮助宿主清除HPV 感染,而阴道菌群失调则可能是HPV 逃逸宿主免疫的重要机制(相关研究正在开展)。
5 结论与展望
目前,大量的基础与临床研究工作已经证明,女性阴道微生态与以HPV 感染为代表的妇科感染性疾病密切相关。但与阴道宿主拥有的数以百万计的微生物相比,现在我们对阴道微生态的研究还过于肤浅。通过深入了解阴道微生物群影响各种妇科感染的具体过程,有可能最大限度地提高女性的第一道防线,这将最终有助于开发实用和低成本的疗法,以减少性传播感染,特别是HPV等病毒的易感性。同时,随着各种现代高通量测序技术与生物信息分析技术的发展,“阴道微生物—阴道/宫颈局部免疫激活—外源感染体的清除”这个过程的机制将会被逐步揭开。此外,伴随着各种针对阴道炎症的微生态制剂的深入开发与大队列的临床探究,在改善女性阴道微生态整体环境,必将为以HPV 为代表的妇科感染性疾病的的治疗、为宫颈病变甚至宫颈癌的预防提供一条安全又有效的新途径。笔者相信,随着女性对妇科保健意识的提升、对HPV 等疫苗的大范围接受以及微生态制剂的广泛推广,我国的妇科感染性疾病、宫颈癌等发病率将会大幅度下降。
