多重PCR病原体分子检测技术在下呼吸道感染诊断中的应用价值
2021-05-18叶泽辉郭惠玲陈茂生李小悦
叶泽辉 郭惠玲 陈茂生 李小悦
下呼吸道感染作为临床中常见的呼吸道感染疾病类型,具有较高的发病率和死亡率,随着近年来各类抗菌药物的发明和广泛应用,下呼吸道感染的致病菌病原谱也不断变化,增加了临床诊断及治疗的难度[1]。传统的培养法是下呼吸道感染病原体检测的金标准,但由于整个培养过程较为复杂,因此耗时较长,不利于临床早期治疗,容易延误患者的病情[2]。目前,直接免疫荧光法和间接免疫荧光法在下呼吸道感染病原体中的检测也发挥出了较好的应用效果,但诊断的灵敏度和特异度仍相对较低[3]。随着现代分子生物学技术的快速发展,病原体分子检测技术在临床中的诊断研究也逐渐增多,尤其是基于分子遗传水平的核酸检测技术,已经成为了病原体检测技术中的主流。多重PCR 是在传统PCR 基础上发展的一种检测方法,可以同时实现多种病原体的同时检测,近年来在下呼吸道感染的病原体检测中发挥出了较好的应用价值[4]。基于此,本研究将提取患者的痰液标本后分别使用多重PCR 和直接免疫荧光法进行病原体检测,对比不同检查方式的检查结果,期望以此来为下呼吸道感染的早期诊断提供依据,现将报道如下。
1 资料与方法
1.1 一般资料
随机选取2019年1月至2019年12月于2家医院重症医学科接受治疗的128例下呼吸道感染患者作为研究对象,男73 例,女55 例,平均年龄(45.69±15.26)岁。其中包括社区获得性肺炎44例、慢性支气管炎急性加重31 例、院内获得性肺炎29 例、肺心病14 例、慢性阻塞性肺疾病10 例,排除活动性肺结核、吸入性肺炎、阻塞性肺炎或发病前2周接受过住院治疗的患者。
1.2 方法
1.2.1 标本采集及处理
针对所有患者进行痰液标本培养,于患者入院后24 h 内使用吸痰管经由患者的鼻孔插入鼻咽部,连接黏液收集器后采集患者的痰液标本,标本提取后使用漩涡混合器将其打散,使用离心仪离心10 min,转速设定为1 500 r/min,将沉淀物使用pH 值为7.2 的磷酸缓冲盐溶液(PBS)10 mL 进行洗涤,共计洗涤2 次,随后使用1 mL 的PBS 缓冲液将其调成悬液,使用法国生物梅里埃公司的全自动核酸提取仪器(easyMAG)对标本进行自动核酸提取,并放置于PCR 管中保存。所有痰液标本均送检进行微生物病原学诊断。
1.2.2 免疫荧光法
将标本离心沉淀后制片,放置于常温条件下自然干燥,使用冷丙酮固定10 min 后取出,待冷丙酮完全挥发,采用荧光标记的呼吸道病毒单克隆抗体检测标本的病原体,检测试剂盒购进于美国Chemicon 公司,具体操作步骤按照试剂盒说明要求进行操作,以2 个及以上完整细胞内有明亮黄绿色荧光判定为阳性。
1.2.3 多重PCR 检测
根据美国国立生物技术信息中心(NCBI)公布的病原体目的序列找到各病原体的相对保守区域,并对引物进行设计,引物序列见表1。

表1 引物序列Table 1 Primer sequence
同时于中国食品药品检定研究院购买个病原体的对应参考品,通过对参考品的梯度稀释使用各引物进行检测,针对无法有效扩增的病原体浓度即为该位点的扩增灵敏度。对其他的呼吸道病原进行收集和检测,确保本研究内所使用的的引物并不会对病原核酸产生扩增作用,确定特异度,并将所有检测靶点的正向和反向引物混合为反转录引物混合液和PCR 引物混合液。PCR 扩增后使用遗传分析仪对样品的PCR 产物进行毛细电泳片段分离,分析各样品的峰形图,所有病原体的PCR 产物片段长度与参考大小之间的差距不得超过1.5 bp,阴性质控品和阳性质控品的峰形图。见图1~2。

图1 阴性质控品峰形图Figure 1 Peak shape of quality control products
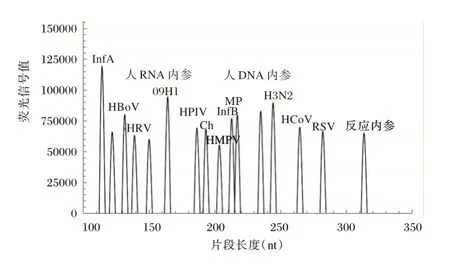
图2 阳性质控品峰形图Figure 2 Peak shape of positive quality control products
1.3 统计学处理
使用SPSS 22.0 统计软件对数据进行处理,计数资料用n(%)表示,用χ2检验,计量资料用(±s)表示,用t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 下呼吸道感染患者的多重PCR 检测结果
通过对128 例患者的多重PCR 检测结果分析,发现病原体阳性92 份(71.88%),其中有12份标本检测到两种或两种以上病原体,占比9.38%,以FluA 病原体的阳性率最高为39.84%,其次依次为PIV1、PIV2、ADV、RSV 和FluB 等。见表2。
2.2 下呼吸道感染患者的直接免疫荧光法检测结果
128 例患者检测结果发现共有56 份(43.75%)标本为病原体阳性,其中有5 份(3.91%)标本检测到两种或两种以上病原体,其中以FluA 病原体的阳性率最高为25%,其次依次为PIV1、PIV2、RSV、ADV 和FluB 等。见表3。
2.3 多重PCR 与直接免疫荧光法的检测价值对比
多重PCR 检测的总灵敏度和准确率明显高于直接免疫荧光法检测的总灵敏度和准确率,差异有统计学意义(P<0.05),特异度相比,差异无统计学意义(P>0.05)。见表4。
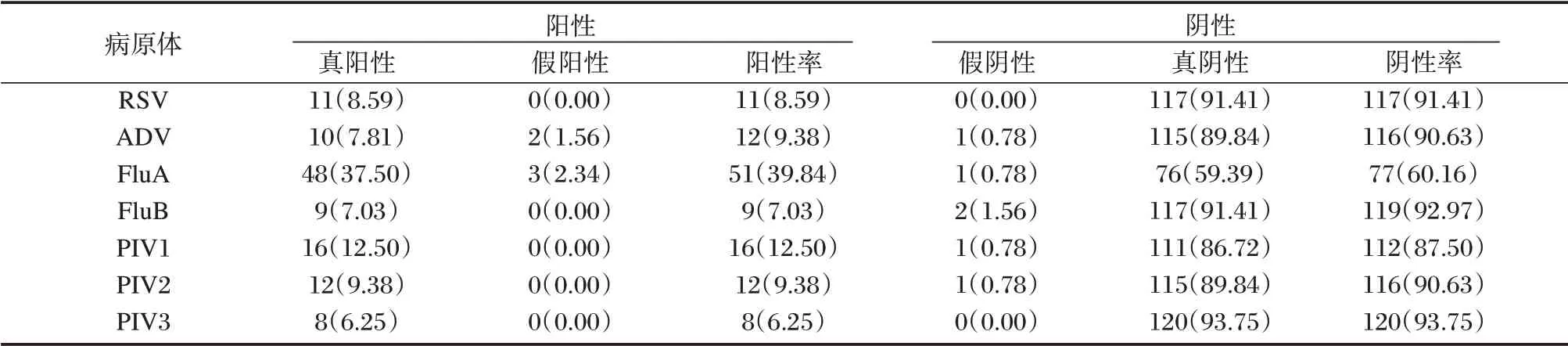
表2 下呼吸道感染患者的多重PCR 检测结果[n(%)]Table 2 Multiplex PCR test results of patients with lower respiratory tract infection[n(%)]

表3 下呼吸道感染患者的直接免疫荧光法检测结果[n(%)]Table 3 Direct immunofluorescence test results of patients with lower respiratory tract infection[n(%)]

表4 多重PCR 与直接免疫荧光法的检测价值对比(%)Table 4 Comparison of detection value between multiplex PCR and direct immunofluorescence(%)
3 讨论
急性呼吸道感染作为全球面临的严重公共卫生问题之一,感染的病原体具有多样性,其中有70%是由病毒所引发[5]。下呼吸道感染作为呼吸道感染中的常见类型,相关临床研究中发现,下呼吸道感染的病原体分布较为广泛,发达国家以病毒感染为主,而发展中国家以细菌感染为主[6]。有报道指出,下呼吸道感染病原体的构成较为复杂,且患者的临床症状缺乏特异性,传统的病原学诊断主要是通过对病原体的分离培养进行诊断,但该方法花费的时间较长,且鉴定数量有限,因此已经无法满足临床诊断的需求[7]。随着临床诊断技术的不断发展,免疫荧光法在临床中的应用也日益广泛,并在病毒和衣原体抗原的检测中发挥出了较好的应用效果,具有较高的特异度,但灵敏度却相对较低。20世纪80年代,PCR 技术被广泛应用于分子诊断领域,并从最初的传统PCR 逐渐发展至多重PCR、反转录PCR 和实时定量PCR 等,而检测的扩增能力和准确性均有所提升,而其中的多重PCR 技术在呼吸道病毒感染患者的病原体筛查中发挥出了积极的作用[8]。张海邻等[9]在研究中发现,PCR 技术的检出率为58.37%,明显高于直接免疫荧光法检测的41.53%,说明PCR 技术在下呼吸道感染的病原体检测中发挥出了较好的应用效果。
本研究结果说明与传统的直接免疫检测方法相比,多重PCR 可以有效提高临床诊断的灵敏度和准确率,具有较好的诊断价值。刘馨玉等[10]在研究发现多重PCR 诊断的敏感度和特异度分别为94.74%和84.38%,均明显高于间接免疫荧光法,与本文的研究结果一致。郑凯文等[11]在研究中使用多重PCR 对下呼吸道感染的病原体进行了检测,结果发现多重PCR 检测共计检出13 种病原体,传统培养法仅检出8 种,且多重PCR 检测的阳性率为79.41%,灵敏度为100%,检测时间比传统培养法缩短了至少1 d,进一步证实了多重PCR 可以有效实现对下呼吸道感染病原体的检测,与本文的研究结果相似。
综上所述,相较于传统的直接荧光免疫法检测,多重PCR 病原体分子检测在下呼吸道感染中发挥出了较好的诊断价值,具有较高的灵敏度和特异度,应当在临床中广泛应用及推广。
