磷脂酰肌醇-3-激酶/蛋白激酶B和丝裂原活化蛋白激酶/细胞信号调节激酶1/2信号通路抑制剂对乳腺癌细胞缺氧诱导因子-2α表达的影响
2021-05-18李永真王志慧韩正华千新来原志庆陆漫漫李思琦
李永真,王志慧,2,李 娜,宋 颖,韩正华,千新来,原志庆,陆漫漫,李思琦
(1.新乡医学院病理学系,河南 新乡 453003;2.新乡医学院第三附属医院,河南 新乡 453003;3.新乡医学院三全学院,河南 新乡 453003)
肿瘤内部缺氧是实体瘤的共同特征,是恶性表型发展的重要微环境因素。缺氧诱导因子(hypoxia inducible factor,HIF)是介导细胞对缺氧反应的转录因子[1]。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路对细胞凋亡、增殖、血管生成有重要的调节功能,对乳腺癌细胞的转移、化学治疗耐药也起着重要作用。有研究表明,磷脂酶C-ε通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MEK)/细胞信号调节激酶(cell signal regulated kinase,ERK)和HIF-1α途径调节前列腺癌的代谢和转移[2]。在卵巢癌中,盐诱导激酶2通过激活PI3K/Akt信号通路上调HIF-1α的表达,促进糖酵解[3]。HIF-2α为HIF家族重要成员,与HIF-1α在结构上有很大的一致性,而且二者识别并结合的DNA也相同,目前的文献对HIF-1α研究较多,对HIF-2α与肿瘤的关系研究相对较少。本课题组前期研究表明,HIF-2α在乳腺癌MCF-7细胞中高表达,并与乳腺癌增殖、侵袭和多药耐药的发生密切相关[4-5],而PI3K/Akt和MEK/ERK1/2信号通路对缺氧诱导的乳腺癌MCF-7细胞中HIF-2α表达的影响尚不明确。本研究通过研究抑制PI3K/Akt和MEK/ERK1/2信号通路对乳腺癌MCF-7细胞中HIF-2α表达的影响,旨在为乳腺癌的治疗寻找新的途径。
1 材料与方法
1.1 细胞来源人低侵袭乳腺癌MCF-7细胞由中国科学院上海生命科学院细胞资源中心提供。
1.2 主要试剂和仪器氯化钴(cobalt chloride,CoCl2)购自美国Sigma公司,引物由上海英潍捷基贸易有限公司合成,HIF-2α兔抗人多克隆抗体购自北京博奥森生物技术有限公司,PI3K/Akt抑制剂LY294002、MEK/ERK1/2抑制剂U0126、磷酸化ERK1/2(phosphorylation ERK1/2,p-ERK1/2)和磷酸化Akt(phosphorylated Akt,p-Akt)抗体购自美国Cell Singaling Technology公司,增强电化学发光(enhanced chemiluminescence,ECL)试剂盒购自上海碧云天生物有限公司,TRIzol试剂、RNA反转录试剂盒和实时荧光定量聚合酶链式反应(real-time quantitative fluorescence polymerase chain reaction,qRT-PCR)试剂盒购自日本TaKaRa公司,二辛可宁酸(bicinchonininc acid,BCA)购自美国Thermo公司,Tris 缓冲生理盐水( Tris-buffered saline and Tween-20,TBST) 购自宁波亿诺医药科技有限公司;荧光显微镜购自日本Nikon公司,Step One荧光定量PCR仪购自美国ABI公司。
1.3 细胞培养和分组将乳腺癌 MCF-7细胞培养于含体积分数10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的RPMI 1640 培养液中,37 ℃、含体积分数5%CO2条件下常规培养24 h后,分为常氧组、缺氧组、缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组。常氧组细胞更换为含生理盐水的RPMI 1640培养基,缺氧组细胞更换为含100 μmol·L-1CoCl2的RPMI 1640 培养基,缺氧+低剂量LY294002组更换为含 100 μmol·L-1CoCl2和 4 μmol·L-1LY294002的RPMI 1640 培养基,缺氧+高剂量LY294002组更换为含100 μmol·L-1CoCl2和40 μmol·L-1LY294002的RPMI 1640 培养基,缺氧+低剂量U0126组更换为含100 μmol·L-1CoCl2和 2 μmol·L-1U0126的 RPMI 1640 培养基,缺氧+高剂量U0126更换为含 100 μmol·L-1CoCl2和8 μmol·L-1U0126的RPMI 1640 培养基,继续培养3 h,进行后续实验。
1.4 qRT-PCR法检测各组细胞中HIF-2α mRNA的表达取各组继续培养3 h后的MCF-7细胞,使用TRIzol试剂提取总RNA,按照反转录试剂盒说明书方法反转录合成cDNA第一条链,使用qRT-PCR试剂盒检测各组细胞中HIF-2α mRNA的表达量,HIF-2α上游引物序列:5′-TGAAAACGGAGTCCGAAGCC-3′,下游引物序列:5′-GTGGCTGACTTGAGGTTGA-3′,PCR反应条件:94 ℃预变性30 s,94 ℃ 5 s,60 ℃ 30 s,循环数为40。以甘油醛-3-磷酸脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为内参,采用2-ΔΔCt法计算HIF-2α的相对表达量。实验重复3次,取均值。
1.5 Western blot法检测各组细胞中HIF-2α、p-Akt和p-ERK1/2蛋白的表达收集各组继续培养3 h后MCF-7的细胞,磷酸盐缓冲液洗涤并重悬后离心,取上清液加入放射免疫沉淀裂解液轻摇重悬后冰上孵育 30 min,4 ℃ 12 000 r·min-1离心10 min,取上清液,即为细胞总蛋白,应用BCA蛋白浓度测定试剂盒测定蛋白质浓度。蛋白上清经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜,用50 g·L-1脱脂奶粉封闭 90 min,加入HIF-2α(1100)、p-ERK1/2(1100)、p-Akt(1200)兔抗人一抗于4 ℃下孵育过夜,TBST洗涤3次×10 min,硝酸纤维素膜加入羊抗兔二抗(12 000),室温孵育90 min,TBST洗涤3次×10 min,按照ECL试剂盒说明书进行操作,X线片曝光、显影、定影。内参蛋白为GAPDH,使用 Image J 软件分析各蛋白对应的灰度值,以目的蛋白灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。实验重复3次,取均值。

2 结果
2.1 各组MCF-7细胞中HIF-2α mRNA相对表达量比较常氧组、缺氧组、缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组MCF-7细胞中HIF-2α mRNA相对表达量分别为0.913±0.252、1.374±0.188、0.731±0.111、0.613±0.133、0.892±0.142、0.545±0.174,各组MCF-7细胞中HIF-2α mRNA相对表达量比较差异有统计学意义(F=74.237,P<0.05)。缺氧组MCF-7细胞中HIF-2α mRNA相对表达量高于常氧组,差异有统计学意义(P<0.05);缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组MCF-7细胞中HIF-2α mRNA相对表达量低于缺氧组,差异有统计学意义(P<0.05)。缺氧+高剂量LY294002组MCF-7细胞中HIF-2α mRNA相对表达量低于缺氧+低剂量LY294002组,缺氧+高剂量U0126组MCF-7细胞中HIF-2α mRNA相对表达量低于缺氧+低剂量U0126组,差异均有统计学意义(P<0.05)。
2.2 各组MCF-7细胞中HIF-2α蛋白相对表达量比较结果见图1。常氧组、缺氧组、缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组MCF-7细胞中HIF-2α 蛋白相对表达量分别为0.924±0.262、1.386±0.342、0.732±0.214、0.572±0.166、0.860±0.322、0.586±0.188,各组MCF-7细胞中HIF-2α蛋白相对表达量比较差异有统计学意义(F=76.438,P<0.05)。缺氧组MCF-7细胞中HIF-2α 蛋白相对表达量高于常氧组,差异有统计学意义(P<0.05);缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组MCF-7细胞中HIF-2α 蛋白相对表达量低于缺氧组,差异有统计学意义(P<0.05)。缺氧+高剂量LY294002组MCF-7细胞中HIF-2α 蛋白相对表达量低于缺氧+低剂量LY294002组,缺氧+高剂量U0126组细胞中HIF-2α 蛋白相对表达量低于缺氧+低剂量U0126组,差异均有统计学意义(P<0.05)。
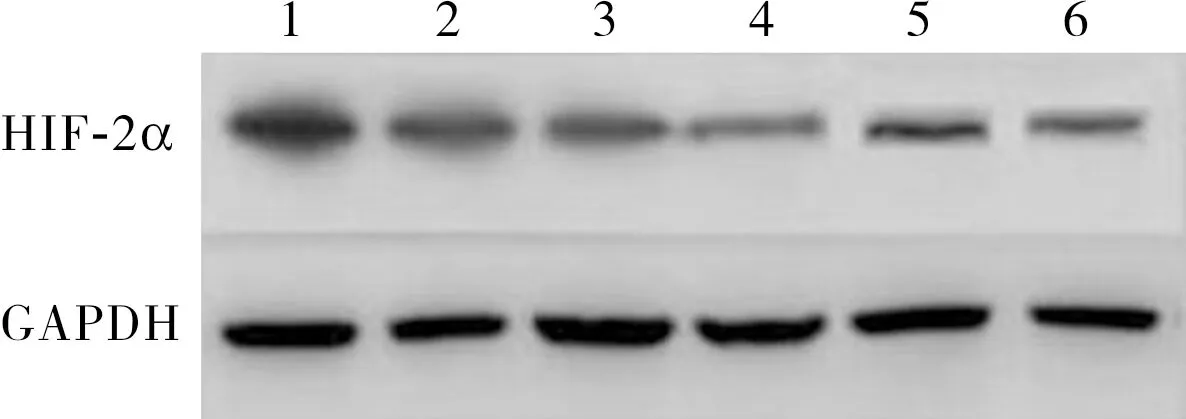
1:缺氧组;2:常氧组;3:缺氧+低剂量U0126组;4:缺氧+高剂量U0126组;5:缺氧+低剂量LY294002组;6:缺氧+高剂量LY294002组。
2.3 各组MCF-7细胞中p-Akt、p-ERK1/2蛋白相对表达量比较结果见图2和表1。各组MCF-7细胞中p-Akt蛋白和p-ERK1/2蛋白相对表达量比较差异有统计学意义(F=86.542、88.460,P<0.05)。缺氧组MCF-7细胞中p-Akt蛋白和p-ERK1/2蛋白相对表达量高于常氧组,差异有统计学意义(P<0.05)。缺氧+低剂量LY294002组、缺氧+高剂量LY294002组、缺氧+低剂量U0126组、缺氧+高剂量U0126组MCF-7细胞中p-Akt蛋白和p-ERK1/2蛋白相对表达量低于缺氧组,差异有统计学意义(P<0.05)。缺氧+高剂量LY294002组MCF-7细胞中p-Akt蛋白和p-ERK1/2蛋白相对表达量低于缺氧+低剂量LY294002组,缺氧+高剂量U0126组MCF-7细胞中p-Akt蛋白和p-ERK1/2蛋白相对表达量低于缺氧+低剂量U0126组,差异有统计学意义(P<0.05)。
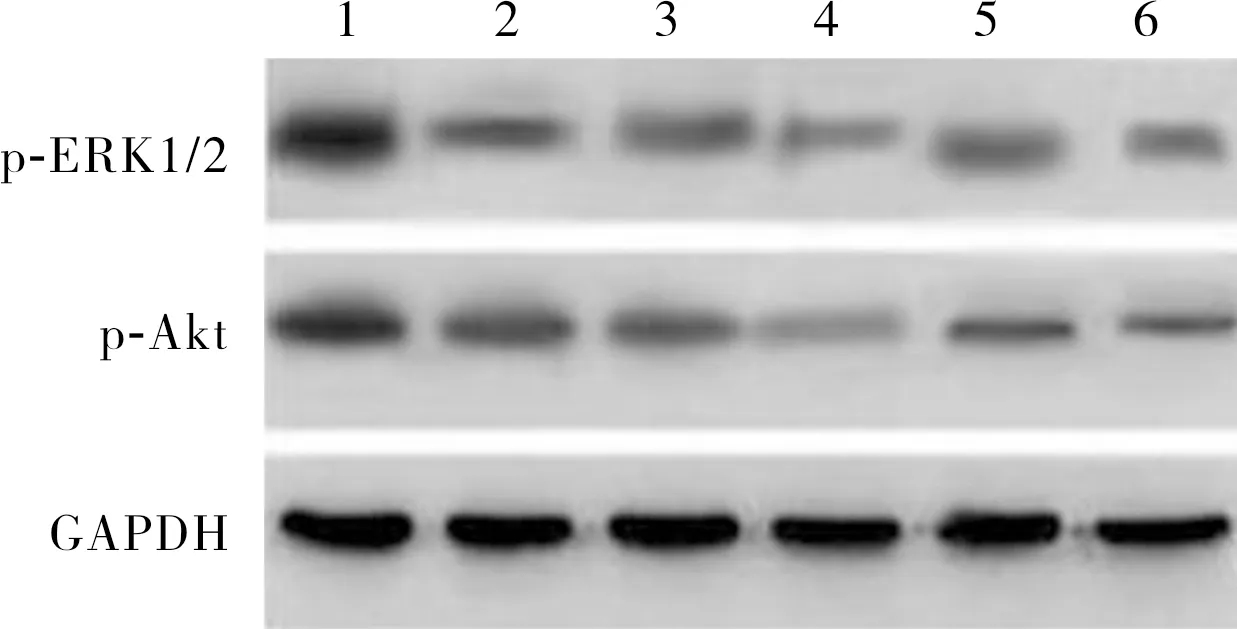
1:缺氧组;2:常氧组;3:缺氧+低剂量U0126组;4:缺氧+高剂量U0126组;5:缺氧+低剂量LY294002组;6:缺氧+高剂量LY294002组。

表1 各组MCF-7细胞中p-Akt、p-ERK1/2蛋白相对表达量比较
3 讨论
乳腺癌是中国女性最常见的恶性肿瘤,也是女性患癌症死亡的主要原因,其发病率呈上升趋势[6-8]。缺氧是实体瘤的一个常见特征,与各种肿瘤的侵袭和转移有关,肿瘤细胞通过表达促进其存活的蛋白质(如血管生成因子、糖酵解酶和应激蛋白)而在缺氧条件下得以存活,大部分肿瘤细胞在缺氧条件下生长快速。HIF是一种异源二聚体,由HIF-α和HIF-β 2个亚基构成。HIF是缺氧反应的关键分子,调节特定基因的活化,介导许多组织对缺氧的适应,然而缺氧反应途径复杂,许多机制尚不清楚。HIF-2α在缺氧条件下在人体内广泛存在,其表达有组织特异性,目前在结直肠癌细胞[9]、肝癌细胞[10]、肺癌细胞[11]等多种恶性肿瘤细胞中发现HIF-2α高表达。本课题组在前期的研究中发现,HIF-2α在乳腺癌组织中高表达,而且通过小干扰RNA干扰HIF-2α的表达抑制了乳腺癌MCF-7细胞的增殖和侵袭能力[4-5]。
PI3K/Akt信号通路是细胞内重要的信号转导通路,其通路中一些成分的突变可引起细胞转化,且其在肿瘤细胞内的持续激活状态与肿瘤细胞的增殖、血管生成及存活等有关。研究表明,PI3K/Akt信号通路的激活与肿瘤的侵袭性有关[12]。生长因子激活的受体酪氨酸激酶传导通路和多种细胞的增殖分化密切相关[13];细胞外信号调节激酶的上游激酶是其中重要的一环,具有酪氨酸、苏氨酸激酶活性,MEK/ERK1/2信号通路的异常活化引起c-fos、c-Jun,Elk-1、c-myc等基因的表达,导致细胞丧失凋亡和分化的能力,促使细胞发生恶性转化并异常增殖,产生肿瘤,并能进一步促进肿瘤细胞的增殖。COSTA等[14]研究发现,PI3K/Akt信号通路在乳腺癌中的活化率高达70%。CHEN等[15]研究发现,激活PI3K/Akt和MEK/ERK1/2信号通路可以诱导乳腺癌细胞凋亡。本研究通过观察抑制PI3K/Akt和MEK/ERK1/2信号通路对乳腺癌MCF-7细胞中HIF-2α表达的影响,探讨PI3K/Akt和MEK/ERK1/2信号通路在乳腺癌中对HIF-2α表达的调控作用,研究结果表明,LY294002和U0126这2种抑制剂均能明显抑制缺氧诱导的HIF-2α的表达,且LY294002能够抑制缺氧状态下乳腺癌MCF-7细胞中p-Akt和p-ERK1/2的磷酸化水平,U0126亦能够抑制缺氧状态下乳腺癌MCF-7细胞中p-Akt和p-ERK1/2的磷酸化水平,并且抑制效果均呈剂量依赖性,说明在缺氧条件下抑制PI3K/Akt和MEK/ERK1/2信号通路可以明显抑制HIF-2α的表达。JIANG等[16]研究显示,在喉癌组织中PI3K/Akt信号通路与HIF-1α的表达相关;另有研究报道,红景天苷通过PI3K/Akt信号通路抑制HIF-1α的表达,减轻阿霉素诱导的局部性肾小球硬化症[17];以上研究均提示PI3K/Akt信号通路与HIF的表达相关。本研究与以上研究的结果[16-17]相符,本研究结果进一步证实了乳腺癌中PI3K/Akt信号通路与HIF-2α的正向调控关系。
综上所述,在缺氧条件下被激活的PI3K/AKT和MEK/ERK1/2信号通路对HIF-2α具有正向调节作用,PI3K/AKT和MEK/ERK1/2信号通路可能是缺氧诱导HIF-2α表达的上游信号通路,在乳腺癌的发生、发展中起着重要作用。本研究结果为治疗乳腺癌提供了新的途径,但其详细调控机制及通路中诸多分子靶点仍是下一步研究的方向。
