土贝母对小鼠肝癌的抑制作用及其机制
2021-05-18陈燕妮
查 青,陈燕妮,晁 旭,2
(1.陕西中医药大学,陕西 西安 712046;2.陕西中医药大学第二附属医院科研科,陕西 咸阳 712000)
肝细胞肝癌是世界范围内最常见的恶性肿瘤之一,其发病率在各类肿瘤中位居第6,病死率位居第4,是全球第4大癌症相关死亡原因[1]。目前,我国肝癌发病率在各类肿瘤中位居第2,死亡人数约占全球的51%[2]。肝癌因其发病隐匿、肝脏代偿能力强、发现时多为中晚期而导致预后不良,病死率较高。肝癌发生的主要危险因素有病毒感染、代谢性疾病(如脂肪肝、糖尿病、酒精性肝疾病等)及其他因素(如黄曲霉毒素、马兜磷酸暴露等)。目前,早期肝癌可通过局部消融、手术切除或肝移植等方法进行治疗,以导管为基础的局部区域治疗适用于中期癌症患者[3]。中西医结合是我国的特色治疗方法,在肝癌的治疗中发挥着关键作用,肝癌术后及放射治疗和化学治疗后联合中医药治疗具有驱邪扶正、散结消徵、提高正气、提高患者生存质量、减少放化疗不良反应等作用。因此,探寻中药在肝癌治疗中的作用及机制具有重要意义。
土贝母为葫芦科植物土贝母的干燥块茎,其味苦,性微寒,能够解毒、消肿、散结,常用于治疗乳痈、痰核、瘰疬等疾病[4];《本草从新》中记载其可“治外科痰毒”[5]。因此,土贝母被长期应用于各类肿瘤的治疗。现代研究发现,其有效提取物土贝母苷甲对肝癌、人乳腺肿瘤、口腔鳞状细胞癌、胶质母细胞瘤等各类肿瘤细胞具有抑制作用。本课题组前期研究发现,土贝母含药血清能够有效抑制人肝癌细胞7404增殖,并促进其凋亡;土贝母含药血清作用于7404细胞后能够提高细胞中caspase-3的表达,预示着其作用机制可能与细胞凋亡有关[6-9]。基于土贝母的前期研究结果,本研究致力于探讨土贝母在小鼠体内能否有效抑制肝癌的生长及其作用机制。
1 材料与方法
1.1 实验动物雄性昆明小鼠30只,6周龄,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。
1.2 细胞、试剂与仪器H22细胞株购自上海茂科生物有限公司;土贝母购自陕西中医药大学校医院;Ki67、caspase-1、caspase-3、caspase-9抗体购自武汉赛维尔科技有限公司;GREEN-30T超纯水机购自南京易普易达科技发展有限公司,电子天平购自梅特勒-托利多仪器(上海)有限公司,DYCZ-24DN双垂直电泳仪购自北京六一仪器厂,D1008E掌上离心机购自武汉赛维尔科技有限公司,AX-Ⅱ暗匣购自广东粤华医疗器械厂有限公司,MS-PB磁力搅拌器、TSY-B脱色摇床均购自武汉赛维尔科技有限公司,小鼠灌胃针购自深圳市恒铭金属制厂,一次性注射器购自陕西龙康鑫医疗器械有限公司,1300 SERIES A2超净工作台购自德国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 瘤细胞悬液的制备将1 mL H22冻存细胞于37 ℃恒温水浴箱中快速溶解,溶解后快速离心弃上清,加入10 mL 达尔伯克尹格尔完全培养基,轻轻吹打混匀后接种于培养皿中,置于恒温培养箱中培养,定时观察,当细胞生长至密度达80%~90%时进行传代,传2代后收集细胞,以磷酸盐缓冲液稀释为 1×1011L-1瘤细胞悬液,备用。取2只小鼠于右下腹部腹中线旁1 cm处消毒,将配置的瘤细胞混悬液0.1 mL(约 1×107个瘤细胞)注射入小鼠腹腔内,观察小鼠腹水生长情况。1周后观察到小鼠腹部膨隆,按之柔软后用注射器抽取腹水。小鼠腹部皮肤消毒,无菌抽取乳白色腹水,离心后弃上清液,镜下观察并确认为肿瘤细胞后,以生理盐水将瘤细胞稀释为1×1011L-1瘤细胞悬液,备用。
1.3.2 药液制备根据《中国药典》中药制剂通则,将100 g土贝母生药于1 500 mL蒸馏水中浸泡2 h,武火煮沸转用文火熬煮1 h,4层纱布分离药液,再加入1 500 mL蒸馏水继续加热,武火煮沸,文火熬煮40 min,4层纱布过滤药液,弃药渣,将2次药液合并收集,将药液浓缩至2.0 g·mL-1,取1/2备用,剩余的药液用蒸馏水分别稀释为1.0、0.5 g·mL-1,置于4 ℃冰箱备用。给药前37 ℃水浴加热。
1.3.3 实验分组及干预措施取30只小鼠适应性生长1周后随机分为空白对照组、模型组、高浓度组、中浓度组和低浓度组,每组6只,分笼饲养并标记;局部消毒后,模型组和高、中、低浓度组小鼠右前腋窝皮下接种瘤细胞悬液0.1 mL(约1×107个瘤细胞)制备肝癌小鼠模型,空白对照组小鼠皮下注射0.1 mL生理盐水。造模次日早上,高浓度组、中浓度组和低浓度组小鼠分别灌胃给予2.0、1.0、0.5 g·mL-1的土贝母水提液(0.2 mL·10 g-1),空白对照组和模型组小鼠给予相同体积的蒸馏水;每日1次,共给药30 d。
1.3.4 小鼠进食量测定实验过程中观察小鼠存活状态、精神状态、步态及毛色等指标;定量给予食物200 g,每隔2日称量剩余食物质量,并加至200 g,通过食物消耗量计算每日每只小鼠的进食量。
1.3.5 小鼠体质量及肿瘤体积测量待肿瘤长出后每隔2日称小鼠未灌胃前体质量,使用电子游标卡尺测出小鼠瘤体的长径及短径,计算小鼠肿瘤体积。肿瘤体积=1/2×Dmax×(Dmin)2,Dmax、Dmin分别为皮下肿瘤的长径与短径[10]。
1.3.6 样品采集各组小鼠完成给药后禁食不禁水15 h,颈椎脱臼处死小鼠,置于干净操作台上剥离瘤体,生理盐水冲洗干净,将其分为2份,1份置于-80 ℃冰箱保存,另1份置于100 g·L-1多聚甲醛溶液中固定。
1.3.7 苏木精-伊红(hematoxylin-eosin,HE)染色法观察肿瘤细胞的病理学变化取肿瘤组织,常规石蜡包埋切片,厚度4~6 μm,HE染色后光镜下观察肿瘤细胞的形态。
1.3.8 免疫组织化学法检测肿瘤组织中Ki67的表达肿瘤组织切片后,将包埋切片按照二步法免疫组织化学试剂盒说明进行检测。光镜下拍照并应用Image-Pro Plus 6.0进行分析,细胞核呈棕黄色为阳性细胞,细胞核呈蓝色为其他细胞,计数每张照片中阳性细胞数及总细胞数,并计算阳性细胞百分比。阳性细胞百分比=阳性细胞数/总细胞数×100%。
1.3.9 Western blot法检测肿瘤组织中caspase-1、caspase-3和caspase-9蛋白表达取各组肝癌组织,组织匀浆机进行匀浆,RIPA细胞裂解液进行裂解,提取总蛋白,二喹啉甲酸蛋白定量试剂盒测定蛋白浓度,十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,牛奶封闭,TBST洗脱3次,每次10 min,随后将条带放入10 mL的一抗4 ℃过夜,敷二抗后暗室曝光。以β-actin为内参,分析胶片灰度值,以目的蛋白与内参条带的灰度值比值作为目的蛋白的相对表达量。实验重复3次,取均值。
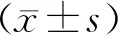
2 结果
2.1 H22荷瘤小鼠的一般情况造模后小鼠一般状态良好,随着给药及肿瘤增长,荷瘤小鼠均出现活动受限,毛色粗糙暗淡,其中模型组小鼠由于肿瘤体积较大,其活动明显受限,其余各肿瘤组荷瘤小鼠活动轻度受限。
2.2 5组小鼠每日进食量及体质量比较结果见表1。模型组及低、中、高浓度组小鼠每日进食量均少于空白对照组,差异有统计学意义(P<0.05)。低、中、高浓度组小鼠每日进食量均多于模型组,差异有统计学意义(P<0.05)。低浓度组小鼠每日进食量多于高浓度组和中浓度组,差异有统计学意义(P<0.05);中浓度组与高浓度组小鼠每日进食量比较差异无统计学意义(P>0.05)。
模型组、低浓度组、高浓度组与空白对照组小鼠体质量比较差异无统计学意义(P>0.05);中浓度组小鼠体质量低于空白对照组,差异有统计学意义(P<0.05)。低、中、高浓度组小鼠体质量均显著低于模型组,差异有统计学意义(P<0.05)。低、中、高浓度组小鼠体质量比较差异无统计学意义(P>0.05)。

表1 5组小鼠每日进食量及体质量比较
2.3 4组荷瘤小鼠肿瘤体积变化结果见表2。低浓度组、中浓度组、高浓度组小鼠肿瘤体积均低于模型组,差异有统计学意义(P<0.05);低浓度组、中浓度组、高浓度组小鼠肿瘤体积比较差异无统计学意义(P>0.05)。

表2 4组荷瘤小鼠肿瘤体积比较
2.4 4组荷瘤小鼠肿瘤组织形态结构的改变结果见图1。模型组小鼠肿瘤细胞排列紧密,细胞结构完整,未见明显的细胞凋亡、坏死、肿胀。与模型组比较,高、中、低浓度组小鼠均出现肿瘤细胞肿胀、细胞数量减少、间隙增宽及不同程度的坏死和凋亡。
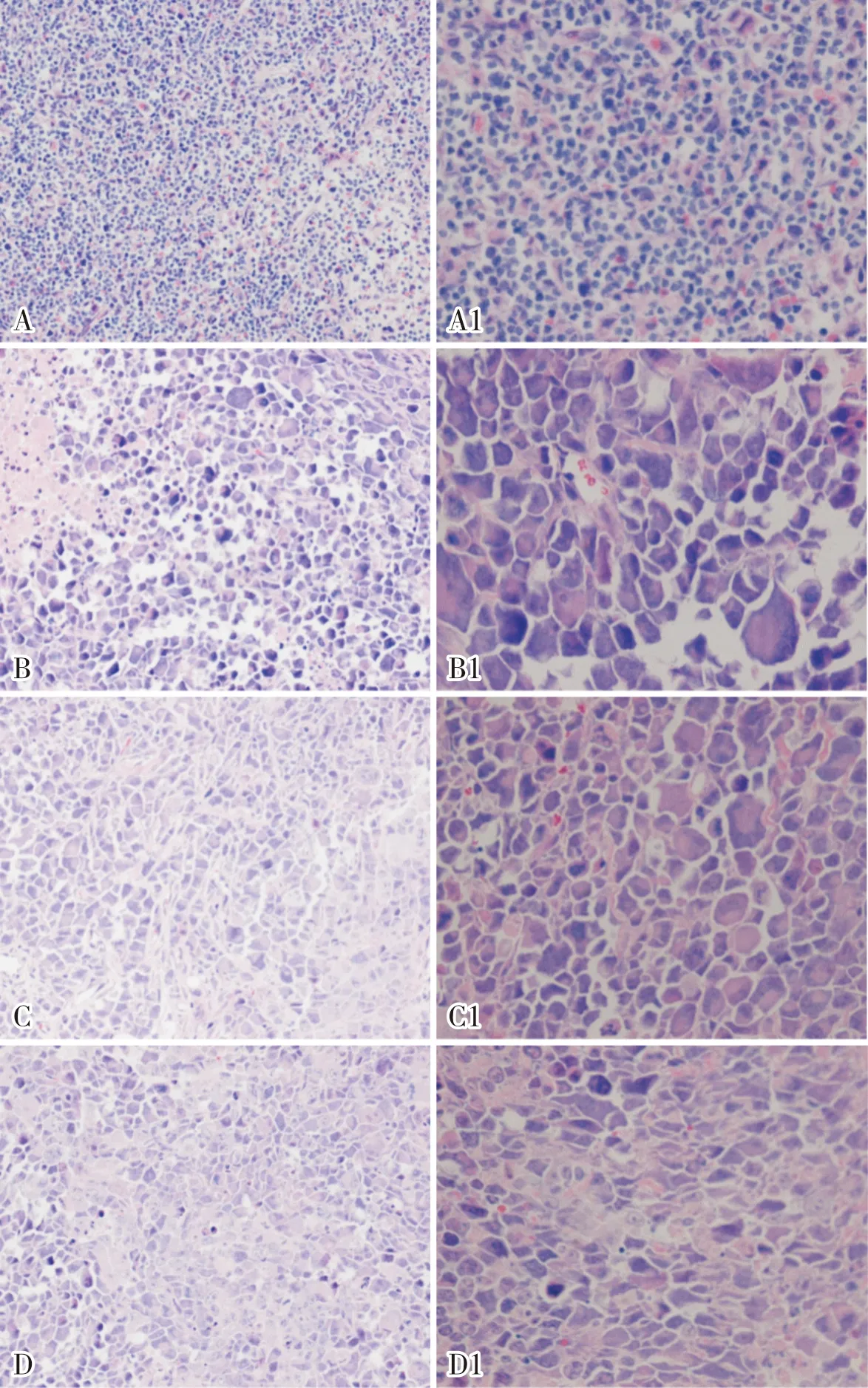
A、A1:模型组;B、B1:高浓度组;C、C1:中浓度组;D、D1:低浓度组;图A、B、C、D放大200倍;图A1、B1、C1、D1放大400倍。
2.5 4组荷瘤小鼠肿瘤组织中Ki67的表达结果见图2。模型组、高浓度组、中浓度组、低浓度组小鼠肿瘤组织中Ki67阳性表达率分别为(62.10±16.59)%、(26.80±16.72)%、(41.76±2.98)%、(18.68±16.83)%。高浓度组、中浓度组、低浓度组小鼠肿瘤组织中Ki67阳性表达率均低于模型组,差异有统计学意义(P<0.05);低浓度组小鼠肿瘤组织中Ki67阳性表达率低于中浓度组,差异有统计学意义(P<0.05);高浓度组与低浓度组、中浓度组小鼠肿瘤组织中Ki67阳性表达率比较差异无统计学意义(P>0.05)。

A:模型组;B:高浓度组;C:中浓度组;D:低浓度组。
2.6 4组荷瘤小鼠肿瘤组织中caspase-1、caspase-3、caspase-9蛋白的表达结果见图3和表3。低浓度组、中浓度组、高浓度组小鼠肿瘤组织中caspase-1、caspase-3、caspase-9蛋白相对表达量均高于模型组,差异有统计学意义(P<0.05)。中浓度组、高浓度组小鼠肿瘤组织中caspase-1、caspase-3蛋白相对表达量低于低浓度组,差异有统计学意义(P<0.05);高浓度组小鼠肿瘤组织中caspase-9蛋白相对表达量低于低浓度组,差异有统计学意义(P<0.05);中浓度组小鼠肿瘤组织中caspase-9蛋白相对表达量与低浓度组比较差异无统计学意义(P>0.05)。高浓度组小鼠肿瘤组织中caspase-3蛋白相对表达量低于中浓度组,差异有统计学意义(P<0.05);高浓度组与中浓度组小鼠肿瘤组织中caspase-1、caspase-3蛋白相对表达量比较差异无统计学意义(P>0.05)。

表3 4组荷瘤小鼠肿瘤组织中caspase-1、caspase-3、caspase-9蛋白相对表达量比较
3 讨论
肝细胞癌是一种发病率高、病死率高的恶性肿瘤,在中医属“积聚”、“臌胀”等范畴。土贝母是我国传统中药材,具有散结消徵作用,现代药理学研究发现,土贝母具有抗炎和抗癌作用,对免疫功能也有多方面的作用。土贝母能够散结消痈、扶正祛邪,从而抑制肝癌的增殖。
Ki67可以体现肿瘤的增殖活性,其表达水平的改变能够反映肿瘤进展情况,是判断肿瘤治疗效果的重要指标[11]。Ki67作为目前已知增殖能力最强的基因之一,是恶性肿瘤理想的标志物[12]。Ki67在细胞分裂的G0期不表达,在G1期表达水平逐渐上升,M期达到峰值[13]。有研究发现,Ki67的阳性表达率与恶性肿瘤的治疗难度及预后呈负相关,其阳性表达率越高,治疗难度越高,预后越差;另外,其与恶性肿瘤的病理分级呈正相关,阳性表达率越高,肿瘤组织分化程度越低,恶性程度越高[14-15]。因此,Ki67阳性表达率可用于评估肿瘤的治疗效果。本研究结果显示,不同浓度土贝母组小鼠肿瘤组织中Ki67阳性表达率均显著低于模型组,提示土贝母能够有效抑制肝癌细胞的增殖。
细胞凋亡是一种程序性死亡,主要表现为细胞皱缩、染色质断裂和固缩、凋亡小体形成,而细胞膜保持完整,并通过周围巨噬细胞的吞噬作用被迅速清除,从而避免炎症反应发生[16-17]。细胞凋亡主要通过外源性(死亡受体)和内源性(线粒体)信号通路被激发,这2条通路均与caspases级联反应有关[17]。有研究发现,caspase是可以调节细胞凋亡活性的药物发展靶标[18]。在外源性途径中,死亡受体激活caspase-8和caspase-10,使其裂解并激活caspase-3和caspase-7;在内源性途径中,线粒体膜被破坏,线粒体蛋白如细胞色素C被释放。在凋亡的caspase级联反应中,释放的细胞色素C死亡蛋白酶激活因子1活化caspase-9,活化的caspase-9激活在细胞凋亡的破坏阶段起关键作用的执行者caspase-3[19]。在此2种死亡途径中,凋亡的触发均是通过不同信号复合体内启动子caspase的强制二聚化实现的[18]。Caspase-3位于凋亡通路的下游,是凋亡执行子,在内源性和外源性通路中最终均通过激活caspase-3而引发细胞凋亡[20]。细胞焦亡是近年来发现并被证实的一种新型程序性细胞死亡方式,其过程主要依赖于caspase-1。细胞焦亡由细胞内炎症小体及caspase-1介导发生,伴随着细胞膜孔腔形成及炎症介质、电解质和细胞内容物的释放。炎症介质通过招募免疫细胞诱导炎症反应,细胞膜内外电解质失衡产生电化学反应和渗透梯度,水分的进入造成细胞膜破裂[21]。本研究以细胞凋亡及细胞焦亡2条信号途径为切入点,通过探讨细胞凋亡途径中caspase-3、caspase-9蛋白表达及细胞焦亡途径中caspase-1蛋白表达研究土贝母对H22肝癌小鼠的作用。
本研究结果显示,与对照组相比,模型组小鼠平均进食量下降,体质量上升,且增幅较大,主要与肿瘤增长较快有关;而给予土贝母治疗后能够增加小鼠进食量、降低小鼠体质量,主要与抑制小鼠肿瘤增长有关。模型组小鼠毛色暗淡粗糙,活动受限明显;与模型组相比,高、中、低浓度组小鼠平均进食量增加,毛色较模型组光滑,活动受限较轻,表明土贝母能明显改善H22肝癌荷瘤小鼠的生存状态。本研究还发现,30 d 给药结束后,低浓度组、中浓度组、高浓度组小鼠肿瘤体积均显著小于模型组,其中中浓度组小鼠肿瘤体积降低最为明显,但低浓度组、中浓度组、高浓度组间比较差异无统计学意义,表明土贝母能够有效地抑制肿瘤生长。病理学结果显示,模型组小鼠肿瘤细胞核大深染,呈肿瘤组织明显特征,表明肝癌模型建立成功;与模型组相比,各浓度组均出现不同程度的细胞密度降低、间隙增宽及细胞肿胀、破裂等特征,且有不同程度的坏死和凋亡区域,提示土贝母可能会促进癌细胞的破裂,杀灭肿瘤细胞。本研究结果显示,土贝母能够降低肿瘤标志物Ki67的阳性表达率,且以低浓度组最为明显,提示土贝母对肝癌的治疗效果佳,能有效抑制肿瘤细胞的增殖,但其表达不呈浓度依赖性,考虑可能与中药的最佳浓度及中药作用的多靶点多通路有关,后期课题组将进一步进行药物量效关系及其他药物靶点相关性的研究。本研究Western blot结果显示,与模型组相比,低浓度组、中浓度组、高浓度组小鼠肿瘤组织中caspase-1、caspase-3、caspase-9蛋白的表达量显著上调,且存在一定的剂量依赖性,其中低浓度组上调最为显著,表明土贝母可能通过激活细胞凋亡及细胞焦亡途径实现抗肿瘤作用。
综上所述,土贝母具有抗肿瘤作用,能明显抑制肿瘤生长,降低肿瘤标志物Ki67的阳性表达率,其作用机制可能是通过上调caspase-1促进细胞焦亡及上调caspase-3、caspase-9促进细胞凋亡产生抗肿瘤作用,其诱导细胞凋亡的机制可能与线粒体相关的内源性死亡途径相关,但其机制尚需进一步深入研究。
