ICU患者万古霉素血药浓度监测及其临床应用
2021-05-18方芳李宁徐春丽杨继红郑志昌
方芳,李宁,徐春丽,杨继红*,郑志昌*
(1.贵州医科大学附属医院药剂科,贵州 贵阳 550001;2.中国药科大学,药学国家实验教学示范中心,江苏 南京 211198)
近年来,随着革兰阳性菌多重耐药的问题日益突出。特别是耐甲氧西林金黄色葡萄球菌(MRSA)及耐甲氧西林表皮葡萄球菌(MRSE)的检出率逐年增加。一项在54个国家222家医院开展的多中心临床试验表明,各个国家由MRSA引起的肺炎的总发生率为3.0%(亚洲为7.4%)[1]。万古霉素(vancomycin,VAN)是一类三环糖肽类抗菌药物,在临床上是治疗耐甲氧西林金黄色葡萄球菌(MRSA)、耐甲氧西林表皮葡萄球菌(MRSE)和肠球菌等引起的重症感染的首选药物[2]。然而,由于万古霉素的治疗窗较窄,最低有效浓度与中毒浓度较为接近,因此一个可靠的万古霉素血药浓度监测方法对保证用药安全有效具有十分重要的意义。
目前,在万古霉素的治疗药物监测(TDM)中最常用的是荧光偏振免疫分析法(FPIA)及高效液相色谱法(HPLC)。FPIA的样品制备过程较为简单,但其仪器设备及检测试剂较贵,会增加患者的经济负担[3]。HPLC常规用于生物样本中目标物的检测,具有较高的灵敏度、准确度和精密度,但用紫外检测器(UV)时分析时间较长,这大大限制了HPLC在临床中的应用。UHPLC法[4-6]是在HPLC法基础上开发能够耐受高压的新型色谱分析技术,其运行粒径低于2 μm,相比于传统的HPLC法,它提高了检测灵敏度及分离效果,减少了采血量,缩短了分析时间,大大提高了检测效率,对于临床血药浓度监测更为有利。某些研究比较了FPIA 与 UHPLC两种检测方法[7-8],表明两种方法的万古霉素血药浓度检测值没有明显的差异。但其中一项研究发现[8],在低浓度时,UHPLC的准确度更高。并且,Wilson等[9]发现在检测中FPIA的专属性令人不太满意。因此UHPLC更适用于万古霉素的血药浓度监测。然而目前很少有研究报道UHPLC-UV应用于万古霉素的TDM。因此,建立一个快速、简便、可靠地UHPLC-UV用于测定万古霉素血药浓度,以便用于临床常规的TDM是必要的。
重症监护病房(ICU)患者由于病情复杂,大多具有年龄偏大、合并疾病较多、肝肾功能不全、联合用药等特点,导致万古霉素在患者体内的药代动力学参数发生变化,出现个体差异[10]。本研究将对ICU中肾功能不全的患者及潜在肾功能不全的老年患者进行血药浓度监测,探讨万古霉素血药峰谷浓度与临床疗效及安全性的相关性,以验证国内外指南对万古霉素血药浓度范围的推荐是否适合中国人,为临床合理用药提供参考。
1 材料与方法
1.1 仪器与试药 万古霉素标准品(批号:C17900500)及去甲万古霉素标准品(批号:30338-200303,内标)购买于中国药品生物制品检定所(纯度>99%)。乙腈(色谱纯)购买于Merck公司。其他试剂如磷酸二氢钾、高氯酸、磷酸、三乙胺为分析纯。
1.2 色谱条件 Waters Acquity H-Class UPLC 超高效液相色谱仪,色谱柱为Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm),流动相为乙腈:0.005 mol·L-1磷酸二氢钾缓冲液(含0.1%三乙胺,磷酸调pH 3.4)(流动相洗脱程序为0~0.5 min为7%乙腈,0.5~3 min乙腈升至12%,3~3.1 min乙腈升至98%,3.1~4 min维持98%乙腈,4~4.1 min 乙腈降至7%,4.1~6 min 维持7%乙腈),柱温为40 ℃,流速为0.3 mL·min-1,检测波长为210 nm,进样量为10 μL,检测器为二级阵列检测器(PDA),整个分析时间为6 min。
1.3 储备液、标准曲线及质控样品的配制 万古霉素(600 mg·L-1)及去甲万古霉素(800 mg·L-1)储备液用超纯水制备并储存于4 ℃冰箱中保存备用(超纯水由Milli-Q Millipore系统制备)。25~600 mg·L-1的万古霉素标准工作液按照逐级稀释法用蒸馏水制备。取适量人空白血清加入万古霉素标准工作液以制备2.5、5、10、25、50、120 mg·L-1不同浓度的标准曲线及4、20 及60 mg·L-1的质控样品。
1.4 样品制备 取100 μL血清样品加入10 μL内标液(800 mg·L-1去甲万古霉素),加入10%高氯酸25 μL沉淀血清中蛋白,涡旋2 min,16 000 r·min-14 ℃离心10 min获得上清液,取10 μL上清液进样。
1.5 方法学验证 根据原国家食品药品监督管理局及欧洲医药局推荐,该检测方法以专属性、批内、批间精密度、准确度、稳定性、回收率进行方法学验证。取6份人空白血清做专属性验证,稳定性实验在不同储存条件下进行:样品处理前室温放置12 h,样品处理后4 ℃放置24 h,-80 ℃下放置2个月以测定长期稳定性。回收率以万古霉素质控样品中的峰面积除以相应浓度万古霉素的标准水溶液获得。
1.6 万古霉素的临床应用
1.6.1 一般资料 选择2017年9月至 2018年9月我院ICU病房收治的使用万古霉素治疗的感染患者。纳入标准:①药物敏感试验提示对万古霉素敏感; ②万古霉素疗程>3 d;③65岁以下伴肾功能不全,即肌酐清除率(CCr)<50 mL·min-1的患者;④65岁及65岁以上的老年患者。排除标准:①预防用药者;②患者及家属不愿意配合者。
1.6.2 万古霉素血药浓度测定时间 万古霉素静脉滴注时药代动力学呈二房室模型,肾功能正常者,万古霉素的半衰期为 4~6 h;而肾功能不全者,平均消除半衰期为7.5 d[11]。经4~5个半衰期可达到稳态血药浓度。根据2009年美国药师协会、美国感染疾病协会和美国感染病药师协会联合发布的《万古霉素治疗成人金黄色葡萄球菌感染的治疗监测实践指南》[12],2011年《万古霉素临床应用中国专家共识》[13],2016年《万古霉素临床应用剂量中国专家共识》[14],推荐万古霉素血清峰浓度应在达稳态并静脉滴注结束后 30 min 留取,血清谷浓度则在达稳态后给药前 30 min 留取,并推荐谷浓度的监测应在第四或第五剂给药前进行。因此,本研究拟在第四次给药后30 min及第五次给药前30 min用EDTA管抽取患者静脉血3 mL,用以测定万古霉素的峰浓度及谷浓度。所有血清样品储存于-80 ℃直到分析测定。
1.6.3 疗效评价 万古霉素用药结束时判断其疗效。疗效判断标准参照原卫生部 2010 年的《抗菌药物临床应用指导原则》分为:①痊愈:症状、体征、实验室数据、病原学检查均恢复正常;②显效:以上指标有 1 项未完全恢复正常;③进步:用药后病情有所好转,但不十分明显;④无效:用药 72 h 后,病情无明显好转或加重。
1.6.4 安全性评价 根据注射用盐酸万古霉素的说明书,万古霉素常见不良反应为肾、耳毒性,并提示严重肝肾功能不全者禁用。由于本文的研究对象为ICU患者,大部分为昏迷状态,因此本文主要通过肝肾功能来进行安全性评价。以药物性肝损伤标准来评价万古霉素的肝损伤,使用万古霉素治疗后,至少2~3次连续监测到血清肌酐水平上升,且绝对值上升44.2 μmol·L-1或升高值大于或等于基线水平的50%(以最高值为准)判断为发生肾毒性[10]。
2 结果
2.1 方法学验证
2.1.1 专属性 选取6名一周内未服用任何药物的健康志愿者以获得人空白血清,精密量取空白血清与含药血清按“4样品制备”项下处理后测定得万古霉素血药浓度色谱图(见图1),样品峰及内标峰的保留时间分别为1.91 min及1.58 min。结果表明万古霉素在该条件下分离度高、峰形较好,样品峰与内标峰未受其他杂质峰影响。且高浓度样品对低浓度样品没有明显的残留效应。
2.1.2 标准曲线 精密量取空白血清90 μL于EP管中,加入万古霉素标准溶液,混匀,使其成为浓度分别为2.5、5、10、25、50、120 mg·L-1的溶液,按“4样品制备”项下处理后进样测定,以万古霉素峰面积(Ai)对内标峰面积(As)的比值为纵坐标(Y),以质量浓度(X)为横坐标进行线性回归,得回归方程Y=0.012 5X+0.010 3(r2=0.999 5)。血清中万古霉素定量下限为2.5 mg·L-1,万古霉素在2.5~120 mg·L-1线性关系良好,预期可覆盖万古霉素人体血药浓度。
2.1.3 准确度及精密度 精密量取空白血清90 μL,加入万古霉素标准溶液,制备成浓度分别为4、20、60 mg·L-1的样品,每一质量浓度均制备5份样品,按“4样品制备”项处理测定,连续测定3 d,评价该方法的精密度、准确度。如表1所示,质控样品的准确度及批内、批间精密度的RSD值均在15%内,满足生物样品测定的要求。
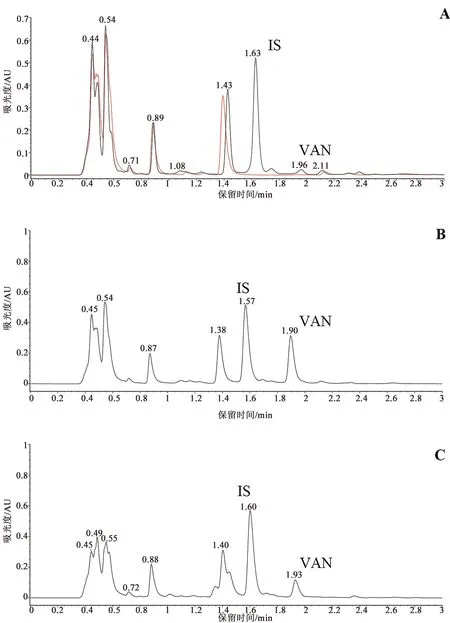
A.空白血清(红色)及定量下限(黑色);B.含药血清(500 mg·L-1万古霉素及800 mg·L-1内标);C.患者暴露于万古霉素后血清图1 色谱图

表1 UHPLC测定万古霉素血药浓度的准确度及批内、批间变异(n=5)
2.1.4 回收率 配制低、中、高(4、20、60 mg·L-1)3种血清样品,每种浓度5份;同浓度又以超纯水为基质配制3份,按“4样品制备”项处理后检测,以峰面积比值计算低、中、高浓度绝对提取回收率,分别为94.90%、97.70%、101.16%,说明用高氯酸沉淀蛋白能得到较高的回收率。
2.1.5 不同储存条件下的稳定性 根据临床实际情况来设置处理前、处理后稳定性及长期稳定性试验,结果如表2所示。
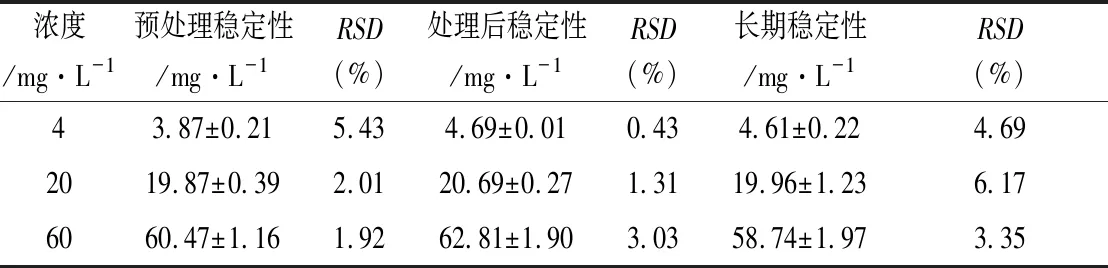
表2 万古霉素在不同条件下的稳定性(n=5)
未处理的质控样品(4、20、60 mg·L-1)室温放置12 h后测定,其平均准确度分别为96.78%、99.36%、100.78%,处理后样品放置于进样盘中24 h后测定,其平均准确度分别为114.16%、103.47%、104.68%,血样放置于-80 ℃冰箱2个月后测定,万古霉素没有明显的降解,其平均准确度分别为114.35%、99.79%、97.89%。表明该方法万古霉素在不同储存条件下的稳定性良好。
2.2 万古霉素UPHLC-UV测定法的临床应用 在ICU患者中收集到符合入组条件的肾功能不全或老年患者共28例。其血清峰谷浓度测定值及疗效和肝肾毒性情况如表3所示。经UHPLC-UV测定,其血清峰谷浓度分别为15.42~89.12 mg·L-1(峰浓度) 及 7.30~55.46 mg·L-1(谷浓度),说明本文所建立的测定方法能满足临床测定要求。

表3 患者万古霉素血清浓度测定结果及疗效与安全性
2.2.1 血清峰谷浓度与临床疗效相关性 本研究监测28例使用万古霉素的ICU患者,其中1例痊愈,12例显效,11例进步,4例无效。将疗效无效、进步、显效、痊愈分别打分为0、1、2、3,以Spearman进行相关性分析,相关系数r绝对值在0.0~0.2为极弱相关或无相关,0.2~0.4为弱相关,0.4~0.6为中等程度相关,0.6~0.8为强相关,0.8~1.0为极强相关。发现血清峰浓度与疗效的Spearman相关系数r值为0.442 9(P为0.099 2),谷浓度与疗效的Spearman相关系数r值为0.178 7(P为0.362 9),说明血清峰浓度与疗效有中等程度相关性,血药谷浓度与临床疗效无明显相关性。
2.2.2 血清峰谷浓度与肝肾毒性相关性 28例患者用药期间有6例发生肾毒性,其中2例用药前轻度肾功能不全,有6例发生肝毒性,其中4例在用药前肝功能异常,以Spearman相关性分析,分别对血清峰谷浓度与肝肾毒性进行相关性评价,用药后未发生肝、肾毒性及发生肝、肾毒性分别打分为0及1,经分析发现谷浓度与发生肝、肾毒性的Spearman相关系数r值分别为-0.010 8(P为0.956 6)及0.377 2(P为0.047 9),说明血清谷浓度与肝毒性无明显相关性,与肾毒性有弱相关性且有统计学意义,血清峰浓度与发生肝、肾毒性的Spearman相关系数r值分别为0.115 7(P为0.734 1)、0.418 7(P为0.137 7)说明血清峰浓度与肝毒性无相关性,但与肾毒性有中等程度相关性但无统计学意义。
发生肾毒性组(n=6)与未发生肾毒性组(n=22)患者的血清谷浓度分别为(36.08 ± 10.23)mg·L-1、(19.66 ± 11.13)mg·L-1,两组间有极显著性差异(P=0.005),如表4所示。从表3可看出发生肾毒性最低谷浓度为24.85 mg·L-1。两组间血清峰浓度分别为(50.77 ± 27.51)mg·L-1、(29.82 ± 10.50)mg·L-1,两组间有显著性差异(P=0.04),发生肾毒性组最低峰浓度为29.23 mg·L-1。发生肝毒性组(n=6)与未发生肝毒性组(n=22)患者的血清峰谷浓度比较,无统计学差异。
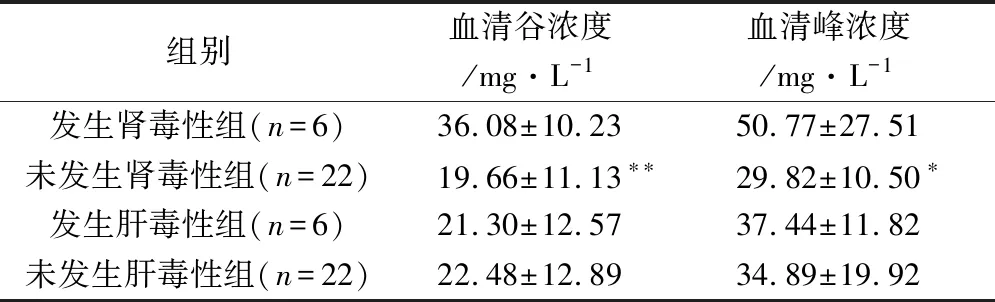
表4 万古霉素血清峰谷浓度与肝肾毒性的情况
3 讨论
本研究建立了一个具有高度选择性、高灵敏度、快速的UPHLC-UV法来测定人血清中万古霉素的浓度,并通过专属性、准确度、精密度、回收率、稳定性等进行方法学验证。通过对临床选取的样本进行测定,说明该测定法能应用于临床作为万古霉素的TDM,可及时有效的测定万古霉素的血药浓度。
目前,在万古霉素的血药浓度测定方法中,曾经报道的有经过液液提取[7-8,15]或固相萃取[16-18]后用HPLC-MS/MS进行测定。然而,在样品处理方法中,液液提取法耗时长,且提取回收率并不理想,重复性较差。利用固相萃取柱(SPE柱)来处理样品需经过SPE柱的预活化-上样-有机溶剂洗脱-目标洗脱液收集-挥发及浓缩等操作,步骤较为烦琐,时效较低,且SPE小柱成本较高。广泛应用于生物样品处理的甲醇或乙腈直接沉淀蛋白法较为简单、快速,但存在万古霉素被有机溶剂稀释的问题,用紫外检测器无法检测到低浓度样品。本研究采用10%高氯酸沉淀蛋白,可获得澄清的上清液,且对万古霉素无明显的稀释作用,可直接用紫外检测器检测,线性范围可以完全覆盖临床血清样本中的万古霉素。
在波长的选择上,HPLC测定法中236,230,215 nm均有报道过[8,16],通过UV检测器扫描万古霉素的最大吸收峰在210 nm处,因此本研究的测定波长设置为210 nm。另外,在流动相的优化上,通过加入0.1%的三乙胺到磷酸二氢钾缓冲液中以避免峰拖尾,再用磷酸调磷酸二氢钾缓冲液的pH值到3.4以获得万古霉素及内标的对称度较高的窄峰,万古霉素的保留时间为1.91 min,溶剂峰不影响其检测。
既往研究推荐万古霉素血药谷浓度应维持在5~10 mg·L-1[3]。但随着近年来万古霉素的广泛应用,中度耐万古霉素的金黄色葡萄球菌(VISA)和异形万古霉素中敏金黄色葡萄球菌(hVISA)的发现,2009年美国药师协会、美国感染疾病协会和美国感染病药师协会联合发布的《万古霉素治疗成人金黄色葡萄球菌感染的治疗监测实践指南》[12],2011年我国的《万古霉素临床应用中国专家共识》[13],随后2016年我国出台的《万古霉素临床应用剂量中国专家共识》等资料[14],均建议将万古霉素血药谷浓度提高至10~20 mg·L-1,以避免耐药菌的发生。对 MRSA 引起的复杂及重症感染(如血流感染、脑膜炎、重症肺炎及感染性心内膜炎等)建议将谷浓度维持在15~20 mg·L-1,以保证临床疗效。因此本研究最低检测限为2.5 mg·L-1能满足临床检测要求。在临床的样本测定中,本研究设置的线性范围也符合临床实际需求。
在临床应用中,发现血清谷浓度与临床疗效无相关性,但与肾毒性有弱相关性(相关系数r为0.377 2)且有统计学意义。本研究还发现血清谷浓度的影响主要来自患者的肾功能,肾功能不全的患者暴露于万古霉素后可能会更快发生肾毒性,与呋塞米、甘露醇等易致肾损害的药物合并使用,使用万古霉素后发生肾毒性的风险增加。这与文献报道一致[10,21-22]。本研究中发生肾毒性患者的最低谷浓度为24.85 mg·L-1,这与一篇文章指出的万古霉素中毒浓度(>25 mg·L-1)基本一致[7],说明在ICU患者中,一个安全的谷浓度范围较窄,肾功能不全患者需要及时监测谷浓度,一旦发现谷浓度大于20 mg·L-1时,需调整给药剂量或间隔,以保证临床安全用药。
本研究中,发现峰浓度与疗效及肾毒性均有中等程度相关性但无统计学意义。在一篇研究血药峰浓度与临床结局相关性系统性评价的文章中[20],指出血药峰浓度的高低与临床疗效及肾毒性均无明确证据证明其有相关性。因此,说明并不是峰浓度越高,疗效越好。
综上所述,本研究建立的UHPLC-UV万古霉素测定法具有灵敏,快速,准确,试剂消耗少等特点,适用于临床作为万古霉素常规的治疗药物监测和其他相关研究。
致谢:感谢贵州省科技计划项目黔科合LH字〔2016〕7255号对本研究的支持。感谢贵州医科大学附属医院临床研究中心提供使用超高效液相色谱仪。
