黄精对联合诱导肝纤维化模型大鼠TGF-β1、ICAM-1基因表达的影响
2021-05-17王晓慧宫铭海杨波郑向群刘宁周忠光
王晓慧,宫铭海,杨波,郑向群,刘宁,周忠光*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.天问山农业综合开发股份有限公司,黑龙江 哈尔滨 150323)
肝脏疾病已经成为临床常见疾病之一,对人类健康产生巨大的威胁。肝纤维化(hepatic fibrosis,HF)是多种慢性肝病发展的必经阶段,肝细胞具有很强的再生能力,当肝细胞受到损伤之后,会发生炎症反应和代偿性的修复反应,出现细胞外基质(extracellular matrixc,ECM)的沉积,如果损伤因素持续存在,会导致细胞外基质过量沉积从而引起肝纤维化,如果没有得到有效的干预,肝纤维化程度会持续加重,很快转化为肝硬化甚至肝癌[1-2]。延缓或控制HF的继续发展,甚至逆转HF,使患者肝脏的组织结构与相应的功能得以提高或恢复,减少恶性肝脏疾病的发生,一直是医学工作者努力的目标[3-4]。
黄精在我国是一味常用的补益良药,古代医书记载其有补气养阴、养肝健脾益肾等功效[5],同时也是一种保健食品,唐代就流行服食黄精来强健身体、保持容颜[6]。现代研究认为,黄精具有保护肝脏、抗菌消炎、降脂、降糖等多种药理作用[7],本文通过建立多种因素联合诱导的大鼠肝纤维化模型,观察黄精对大鼠肝脏的保护作用,并对其作用机制进行初步探讨。
1 实验材料
1.1 主要药品与试剂
黄精提取液(西安天瑞生物技术有限公司,生药量10 g/mL);四氯化碳(天津市大茂化学试剂厂);牛栏山二锅头;4%多聚甲醛固定液(福州飞净生物科技有限公司);水合氯醛(天津市天力化学试剂有限公司);HE染色试剂盒(武汉博士德生物工程有限公司);TGF-β1、ICAM-1 ELISA法测定试剂盒(江苏酶免实业有限公司);Trizol Reagent(Invitrogen);异丙醇(分析纯);三氯甲烷(分析纯);DEPC水;逆转录酶(Promega);RNase抑制剂(TOYOBO);dNTPs(Sangon);Taq DNA聚合酶(TAKARA)。
1.2 实验动物与耗材
48只SPF级SD大鼠,雄性,体质量180~220 g,由黑龙江中医药大学动物实验中心提供,许可证编号:SCXK(黑)2018-001。适应性饲养、造模和给药过程均在黑龙江中医药大学动物实验中心SPF级动物实验室完成,实验室温度为20~24 ℃,相对湿度45%~55%,换气量11~13次/h。标准饲料、清洁饮用水由黑龙江中医药大学动物实验中心提供,高脂低蛋白饲料在79.5%标准饲料基础上添加20%猪油和0.5%胆固醇。
1.3 主要仪器与设备
2135型组织切片机(德国徕卡);TD5AWS台式高速离心机(湖南湘仪实验室仪器开发有限公司);Motic BA210显微镜(厦门麦克奥迪实业集团有限公司);Moticam3000显微摄影成像系统(美国Motic);RT-6100酶标分析仪(深圳生命科学股份有限公司);荧光定量PCR仪(美国stratagene公司);DYY-6C型电泳仪(北京六一仪器厂)。
2 实验方法
2.1 动物分组、模型的建立以及给药
40只大鼠在实验室适应性喂养1周后,按随机数字表法分为4组:正常对照组、模型组、黄精中剂量组(10 g/kg)、黄精高剂量组(15 g/kg),每组10只,正常对照组大鼠自由进食标准鼠粮、饮用清洁水源,其余各组大鼠采用联合诱导方法建立大鼠肝纤维化模型,即喂养高脂饲料,以20%酒精作为唯一饮用水源,将40% CCl4溶于橄榄油内,在颈后进行皮下注射(第一次注射剂量为0.5 mL/100 g,以后每隔3 d注射1次,剂量为0.3 mL/100 g),模型建立期6周。第6周末随机选取3只大鼠处死,摘取肝脏制作病理切片,观察确认造模成功后,黄精中、高剂量组给予相应剂量黄精灌胃治疗,正常组和模型组给予等量蒸馏水灌胃,每日1次,持续6周。最后一次灌胃给药后不再给予饲料,但仍可饮水,次日麻醉后进行取材。
2.2 组织切片的制作
大鼠麻醉后,开腹摘取肝脏,经生理盐水漂洗后,在肝脏左叶同一部位取材,经甲醛溶液固定48 h后,按照常规操作步骤依次进行梯度酒精脱水、二甲苯透明、石蜡包埋和切片,按HE染色试剂盒染色后,在光镜下观察肝脏组织结构的变化。
2.3 ELISA法测定血清TGF-β1、ICAM-1含量
大鼠麻醉后,用真空采血管自腹主动脉取血置于抗凝管内,室温下静置1 h后,放入离心机3 000 r/min离心15 min,吸取上层血清,按照ELISA试剂盒说明书的步骤进行操作,检测各组血清中TGF-β1、ICAM-1的含量。
2.4 肝脏TGF-β1、ICAM-1基因表达水平的测定
漂洗后的肝脏,在肝脏右叶同一部位取组织块放入冻存管内,经液氮转移至-80 ℃冰箱冻存备用,经RT-PCR检测肝脏TGF-β1、ICAM-1基因表达水平的变化。
TGF-β1、ICAM-1及内参引物均由上海艾博思生物科技有限公司设计。GAPDH引物序列为:上游5′-GATGACATCAAGAAGGTGGTGA-3′,下游5′-ACCCTGTTGCTGTAGCCATATTC-3′,总长度206 bp;TGF-β1引物序列为:上游5′-CATGGAGCTGGTGAAACGGAAG-3′,下游5′-GACTGGCGAGCCTTAGTTTGGAC-3′,长度74 bp;ICAM-1引物序列为:上游5′-GCCATACGTACCCTGTCGTC-3′,下游5′-5GGAAGCTGGACAGCCAGGC-3′,长度115 bp。肝脏组织总RNA用Trizol法提取,所得RNA溶解于DEPC处理的ddH2O中。采用琼脂糖凝胶电泳分析RNA的完整度,采用分光光度法测定RNA的浓度和纯度,确定提取的总RNA质量较好后,逆转录为cDNA,进行荧光定量PCR检测。反应条件为95 ℃,3 min变性;94 ℃,20 s,62 ℃,40 s,共40个循环。对实验所得数据进行分析,mRNA表达的相对水平=2-ΔΔCT,其中ΔΔCT指其余样品的ΔCT值和对照样品相应基因的ΔCT值之差。
2.5 统计学方法
3 结果
3.1 黄精对联合诱导肝纤维化模型大鼠肝脏组织结构的影响
HE染色结果可见,如图1所示,正常组大鼠肝小叶结构完整,肝细胞排列成条索状,以中央静脉为中心向四周放射状排列,肝细胞轮廓清晰,未见脂肪变性和炎细胞分布;模型组大鼠肝小叶结构被破坏,小叶间可见大量粗条状结缔组织增生,肝细胞肿胀坏死,可见弥漫性脂肪变性和炎细胞浸润;黄精中、高剂量组大鼠肝脏病变明显减轻,脂肪变性明显减少,近乎消失,炎细胞浸润区域减少。
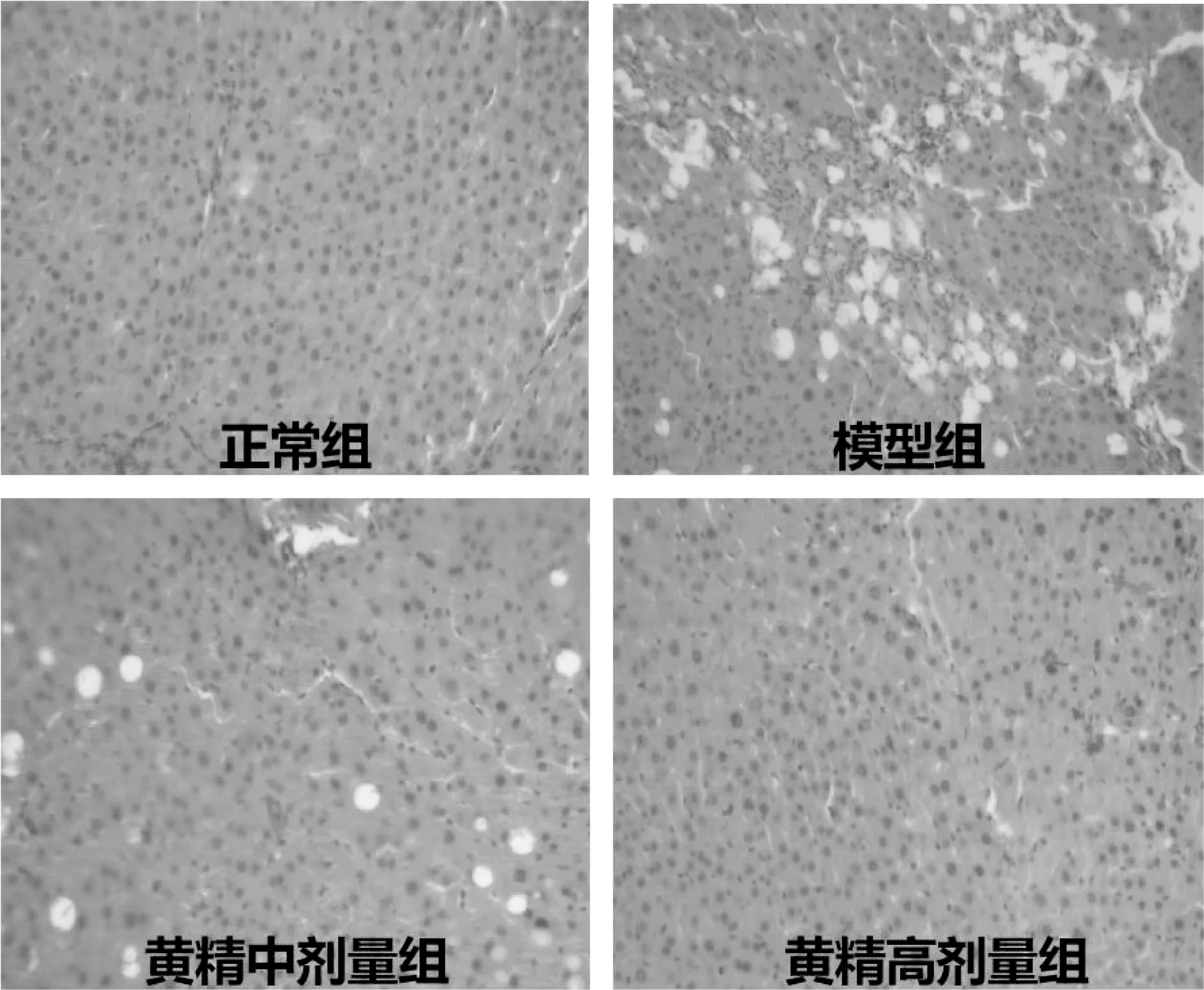
图1 黄精对联合诱导肝纤维化模型大鼠肝脏组织结构的影响(HE染色,×400)
3.2 黄精对联合诱导肝纤维化模型大鼠血清TGF-β1、ICAM-1水平的影响
ELISA结果显示,如表1所示,模型组大鼠血清与正常组相比TGF-β1、ICAM-1水平显著提高(P<0.01),而黄精治疗组大鼠血清TGF-β1、ICAM-1水平比模型组显著下调(P<0.01)。

表1 黄精对联合诱导肝纤维化模型大鼠血清TGF-β1、ICAM-1水平的影响
3.3 黄精对联合诱导肝纤维化模型大鼠TGF-β1、ICAM-1基因表达水平的影响
RT-PCR结果显示,如表2所示,模型组大鼠与正常组相比TGF-β1、ICAM-1基因表达水平有显著提高(P<0.01),而黄精治疗组大鼠血清TGF-β1、ICAM-1水平比模型组显著下调(P<0.01)。
表2 黄精对联合诱导肝纤维化模型大鼠TGF-β1、ICAM-1 mRNA表达水平的影响
4 讨论
现代生活环境中,多种因素如高脂饮食、大量饮酒、化学性药物、病毒、炎症、毒素和自身免疫性疾病的累加,都会造成肝细胞损伤,长期持续发展可以转变为脂肪肝、肝硬化(liver cirrhosis,LC),甚至肝癌等众多肝脏疾病。在众多慢性肝病的发生发展进程中,肝纤维化(hepatic fibrosis,HF)是一个必经环节[8]。如果没有得到有效的干预,肝纤维化程度会持续加重,很快转化为肝硬化甚至肝癌。现代研究已经证实,当病程发展至肝硬化阶段时,已经很难治愈,而在肝纤维化阶段,则是可以逆转的[9-10]。因此,如何预防肝纤维化,延缓肝纤维化发展,寻找抑制肝纤维化发展过程中的可能靶点,是治疗慢性肝病,防止肝硬化甚至肝癌出现的重中之重。
在肝纤维化的形成过程中,有众多因子和信号转导通路参与其中,ICAM-1是一种细胞黏附因子,在肝损伤因素作用下会大量表达,参与肝细胞的炎症反应,导致肝损伤的发生[11-12];TGF-β1是纤维化进程中发挥重要作用的细胞因子之一,与肝纤维化程度密切相关,研究发现TGF-β1可以促进肝星状细胞的增殖,并促使其分化为肌成纤维细胞,使细胞外基质生成增加;同时抑制基质金属蛋白酶(MMP)的产生,并促进组织抑制因子(TIMP-1)的生成,从而使得细胞外基质的降解量减少,细胞外基质的生成大于降解,导致细胞外基质大量沉积,引起肝纤维化[13-16]。本研究显示,模型组大鼠肝纤维化明显,血清和肝组织中TGF-β1、ICAM-1表达显著升高,提示细胞黏附引发的炎症反应以及肝星状细胞的增殖活化是肝纤维化发生过程中的重要因素;而黄精治疗组大鼠的肝纤维化程度有明显减轻,且血清和肝组织中TGF-β1、ICAM-1表达明显降低,说明黄精对肝纤维化模型大鼠的肝脏有保护作用,该保护作用可能与其抑制了血清和肝组织中TGF-β1、ICAM-1的表达,从而减轻了炎症反应,减少细胞外基质的生成有关。
