结直肠癌同时性肝转移患者原发灶切除的预后分析
2021-05-17马晓龙关旭杨润坤刘恩瑞魏然赵志勋黄海洋陈海鹏刘正姜争陈瑛罡王锡山
马晓龙关旭杨润坤刘恩瑞魏然赵志勋黄海洋陈海鹏刘正姜争陈瑛罡王锡山
结直肠癌是最常见的恶性肿瘤之一。2018年GLOBOCAN发布的恶性肿瘤排名中,结直肠癌发病率位列第三位,死亡率位列第二位[1]。在确诊结直肠癌时,15%~25%的患者同时存在肝转移,而其中约80%~90%的肝转移灶初始无法获得根治性切除[2-4]。
目前的NCCN和ESMO指南推荐中,全身化疗依旧是结直肠癌同时性肝转移患者的一线治疗方案[5-8]。在IV期肠癌患者中,原发灶切除(primary tumor resection,PTR)往往是用来处理肿瘤相关并发症,如梗阻、出血或穿孔等。而对于转移灶无法切除,且原发灶无症状或症状轻微的患者,PTR能否使该类人群生存获益,目前仍有争议。本研究对国家癌症中心数据库中结直肠癌同时性肝转移患者进行回顾性分析,探讨接受原发灶切除+化疗(原发灶切除组)或单纯化疗(单纯化疗组)两种不同治疗策略的肝转移灶无法切除患者的生存差异。
资料与方法
一、研究对象
筛选2010年1月~2018年2月在国家癌症中心/中国医学科学院肿瘤医院诊断和治疗的结直肠癌同时性肝转移患者2 474例。
二、纳入与排除标准
1.纳入标准:(1)经病理学诊断为结直肠腺癌或黏液腺癌;(2)转移灶仅限为肝脏,且经MDT团队讨论认为肝转移灶无法手术切除;(3)患者原发灶无临床症状或症状轻微;(4)所有患者均接受化疗,原发灶切除组患者包括化疗+手术+化疗和手术+化疗两种治疗模式。
2.排除标准:(1)病理诊断为神经内分泌肿瘤、间质瘤等患者;(2)合并肝外转移者;(3)失访患者。
本研究最终共纳入371例患者,所有患者均接受化疗,其中162例患者同时接受原发灶切除手术(原发灶切除组),209例患者未接受原发灶切除手术(单纯化疗组)。随访截止时间2020年10月31日。随访内容包括生存情况、死亡原因及死亡日期。随访过程中发现入组患者死亡均为肿瘤相关性死亡,因此本研究采用肿瘤特异性生存时间(cancer specific survival,CSS)替代总生存时间(overall survival,OS)。CSS定义为结直肠癌肝转移确诊时间至患者死亡时间。
三、统计学方法
使用SPSS 23.0和GraphPad Prism 8.0软件进行统计学分析。计数资料采用卡方检验或Fisher's精确检验,采用Kaplan-Meier法绘制生存曲线,应用Log-rank法比较生存率。应用Cox比例风险模型分析影响结直肠癌同时性肝转移患者预后因素。同时为避免基线资料不均衡引起的偏倚,本研究采用倾向得分匹配法对两组患者进行1∶1匹配,预测变量为性别、年龄、肿瘤部位、CEA水平、组织学分级、病理类型及淋巴结转移情况,匹配容差0.7,抽样方法为不放回抽样。以P<0.05为差异有统计学意义。
结 果
一、纳入患者的基线资料
本研究共纳入371例结直肠癌同时性肝转移患者,其中单纯化疗组209例,原发灶切除组162例。入组患者中右半结肠指盲肠、升结肠以及横结肠近2/3段;左半结肠指横结肠远1/3段、降结肠、乙状结肠及直肠。两组患者在组织学分级、淋巴结转移之间差异有统计学意义(χ2=24.26,9.37;P<0.05)。倾向得分匹配后,共纳入288例患者(两组各144例),组间差异无统计学意义(P>0.05)。详见表1。

表1 两组患者临床病理资料[例(%)]
二、影响结直肠癌同时性肝转移患者预后的相关因素
对纳入的288例患者单因素分析发现,肿瘤位置、病理类型、有无淋巴结转移、CEA水平和原发灶是否手术均与CSS相关。多因素分析显示,原发灶未切除、右半结肠、黏液腺癌,淋巴结转移以及CEA异常是同时性肝转移患者的独立危险因素(表2)。

表2 结直肠癌同时性肝转移患者预后的单因素和多因素COX分析
三、单纯化疗与原发灶切除组患者的生存分析及亚组分析
原发灶切除组患者预后明显优于单纯化疗组(χ2=18.25,P<0.01)。倾向得分匹配后同样表明原发灶切除组预后更好(χ2=20.37,P<0.01),见图1。原发灶切除组患者的中位生存时间为22个月,而单纯化疗组仅16个月。同时原发灶切除组患者的3年CSS达到20.2%,而单纯化疗组只有11.1%。亚组分析表明,右半结肠癌、无淋巴结转移的患者并未从原发灶切除手术中获益,其余亚组患者均能从原发灶切除中获益,见图2。

图1 单纯化疗与原发灶切除组总体生存情况。1A:倾向得分匹配前Kaplan-Meier曲线。1B:倾向得分匹配后Kaplan-Meier曲线
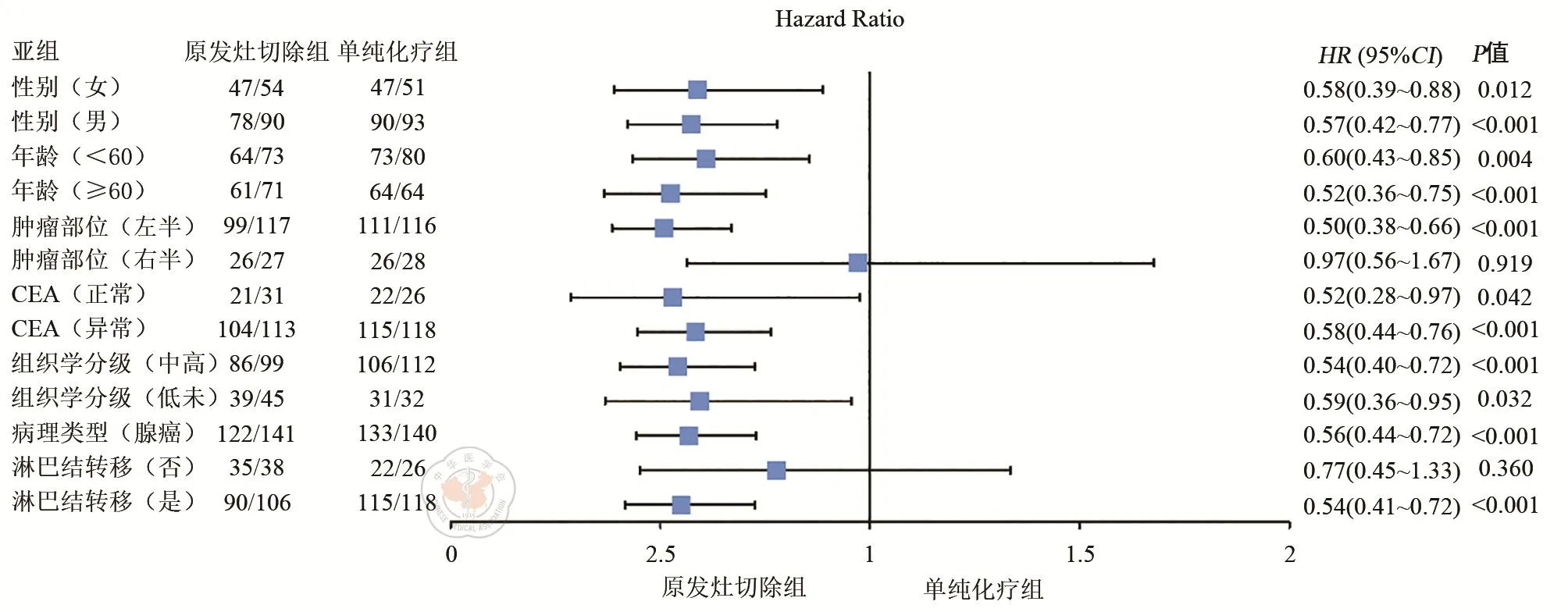
图2 亚组分析森林图
讨 论
对于转移灶无法切除的结直肠癌患者,原发灶切除主要目的是预防原发肿瘤相关的并发症。尽管在初诊时原发灶无临床症状或症状轻微,但并非所有的患者都能从化疗中获益,随着疾病进展,可能会发生与肿瘤相关的严重并发症,包括肿瘤大出血,肠梗阻或穿孔等[9-10]。目前全身化疗药物的不断发展,使得原发灶相关的并发症及急诊手术的比例较前降低[11-12]。一项荟萃分析显示转移灶不可切除的IV期患者最初接受化疗时,约22%的患者存在原发性肿瘤相关并发症,其中87%需要急诊手术[13]。与择期手术相比,急诊手术的并发症发生率和死亡率更高[14-15]。化疗期间原发灶出现并发症的患者预后较差[13,16]。因此,原发灶切除在某些转移性结直肠癌患者中是不可避免的。
本研究表明对于肝转移灶无法切除的结直肠癌患者中,原发灶切除组(接受原发灶切除+化疗)患者预后明显优于单纯化疗组患者。对入组患者倾向得分匹配后仍旧表明患者可以从原发灶切除中生存获益。原发灶切除组患者3年肿瘤特异性生存率达到20.2%。既往的回顾性研究表明,同时性mCRC患者可能从原发灶切除中获益[17-19]。一项前瞻性多中心随机对照试验结果表明,原发灶切除组的2年CSS显著高于单纯化疗组(72.3%vs.47.1%;P=0.049)。尽管2年OS没有达到统计学差异,但原发灶切除组OS达到69.5%而单纯化疗组仅为44.8%[20]。同时该研究拟入组480例患者,但因招募困难,仅纳入52例患者,便提前终止试验。随访时间短,仍需进一步随访。原发灶切除提高mCRC患者生存时间的机制目前尚未明确。有研究认为,原发肿瘤切除与免疫系统的恢复相关,进而提高了生存率。mCRC患者的中性粒细胞-淋巴细胞比率(NLR)升高,切除原发灶可使NLR逆转,同时发现患者的生存率也得到了提高。这表明切除原发肿瘤可能会消除由原发肿瘤引起的全身性炎症的负面预后效应[21]。既往的研究证实,在转移性肾癌或卵巢癌中,通过切除原发灶降低肿瘤负荷可使患者生存获益[22-23]。一项研究表明,原发肿瘤切除可以通过增加血管生成标记物(如VEGF-A,VEGFR-1,VEGFR-2和PIGF)来预防肝脏内的微转移[24]。也有研究发现原发灶切除续贯化疗提高生存率也可能是由于减轻全身肿瘤负荷后,患者对化疗的反应更好[25]。
本研究还发现原发肿瘤位置是肝转移灶无法切除的结直肠癌患者的独立预后因素,右半结肠癌患者预后差于左半结肠癌。本研究结果与既往的研究结果相一致[26-29]。其可能的原因包括:(1)右半结肠与左半结肠不仅在胚胎发育和血液供应上不同,而且在大体病理及临床病理特点上也存在差异[30-31]。左半结肠癌更容易出现肠梗阻或其他临床症状,而右半结肠癌多症状轻微或隐匿。右半结肠癌患者确诊时比左半结肠癌患者年龄更大,且有更多的合并症[31];(2)右半结肠癌分化差的腺癌比例更高[32];(3)右半结肠癌BRAF、KRAS突变及MSI-H比例更高[33];(4)右半结肠癌在生物学行为上侵袭性更强[34]。同时从亚组分析中发现原发灶切除能提高左半结肠癌患者CSS,而右半结肠癌患者CSS却未能改善。Zhang等[26]的研究也发现对于转移灶无法切除的结直肠癌患者,姑息切除右半结肠并不能改善预后。可能的原因是右半结肠癌患者KRAS突变比例更高[33],而KRAS突变是手术切除效果的负性影响因子[35-36]。
淋巴结转移是结直肠癌患者预后的不良因素,在Ⅰ~Ⅲ期结直肠癌中已经得到证实。但在IV期结直肠癌中对于患者预后的影响报道较少。本研究发现淋巴结转移是结直肠癌同时性肝转移患者的独立危险因素。Liu等[37]对496例IV期患者进行分析发现,N分期与患者的预后显著相关,N2、N1期患者的预后明显差于N0期患者。Scherman等[38]的研究也证实淋巴结转移是接受根治性手术的结直肠肝转移患者不良预后因素。但在本研究中,淋巴结转移患者可从原发灶切除中获益,而无淋巴结转移的患者可能无法从手术中获益。其具体机制尚不清楚,可能与降低肿瘤负荷的程度有关,但仍需大样本数据进一步验证。
本研究存在一定的局限性。首先,本研究属于单中心回顾性研究,难免存在选择偏倚。其次,本研究患者接受化疗及靶向治疗方案存在不同,肿瘤基因突变情况可能会影响患者的生存情况。
综上所述,本研究表明,原发灶切除能够使结直肠癌同时性肝转移患者生存获益,但仍需大样本的前瞻性随机对照试验进一步验证。
