混倍体参薯再生植株的倍性与性状分析
2021-05-17周建金邓才生施小梅黄伟群华树妹
周建金, 叶 炜, 邓才生, 施小梅, 黄伟群, 华树妹
(1.三明市农业科学研究院,福建 沙县 365500;2.福建省种子总站,福建 福州 350000)
参薯(DioscoreaalataLinn.)又名大薯,系薯蓣科薯蓣属多年生藤质草本植物,主产于浙江、广东、广西、湖南、湖北、福建、四川、江西等省,其块茎富含淀粉和粗蛋白,可作粮食和蔬菜食用,也可制取淀粉[1-2]。此外,参薯还是药用植物,具有健脾养胃、生津益肺、补肾益精和益脑养颜的功效,常用于抗衰老与治疗糖尿病、心血管疾病和消化不良等[3]。
在福建省,参薯主要用于菜肴和制作特色小吃,种植历史悠久,发展前景广阔[4]。三明市农科院淮山课题组对福建栽培的参薯进行倍性鉴定发现,部分参薯是混倍体。田间种植此混倍体时,植株叶片、藤蔓和地下块茎颜色等生物学性状极不稳定。通过多次种植提纯,仍无法得到性状稳定的株系,致使混倍体参薯难以在育种中使用。Huang et al[5]通过组织培养,将混倍体盾叶薯蓣的叶片诱导愈伤组织并形成芽,获得二倍体、混合倍体和四倍体再生植株。目前,通过组织培养,已从混倍体膜荚黄芪[6]、混倍体紫松果菊[7]和混倍体胡杨[8]中纯化出二、三、四、六或八倍体再生植株。因此,本研究采用组织培养,以四倍体和六倍体的混倍体参薯茎段为外植体,对再生植株进行倍性鉴定和性状观测,以期获得单一倍性、性状稳定的植株,为丰富参薯种质资源开辟新途径。
1 材料与方法
1.1 供试材料
混倍体参薯材料采自龙岩市上杭县。组织培养和染色体观察所用生化试剂均购自西陇化工股份有限公司。
1.2 组织培养


1.2.3 生根壮苗 待愈伤组培分化的芽苗(未进行再增殖培养)长至3 cm高时,直接切下小苗接入生根培养基:1/2MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA+0.5 g·L-1AC。
以上组织培养所涉及的培养基均加入20 g·L-1蔗糖、5 g·L-1琼脂,pH值5.8;培养环境的温度为(25±2) ℃,光照强度1 500-2 000 lx,光照时间为12 h·d-1。
1.3 根尖染色体数鉴定
选取有3条以上根的小苗,自来水冲去琼脂,取其根尖进行染色体观察,统计倍体获得率,20株为一重复,3次重复。根尖染色体制片参照周建金等[9]的方法。选取染色体分散好的细胞拍照和计数。计数时,每个根尖至少统计20个细胞,取85%以上具有恒定、一致的染色体数作为该植株的染色体数。
1.4 生物学性状与染色体倍性稳定性的鉴定
将单一倍性的组培苗栽种到基质(泥炭土∶砂子=2∶1)中,每隔7 d施用1次营养液,驯化3个月后移栽大田种植。在再生植株中选取倍性稳定、生物学性状差异明显的3个单株,将单株进行连续切块种植,繁殖后代分别编号为1、2、3号株系。每个株系分成60块,每重复20块,3次重复,以混倍体参薯为对照。观察或测定供试材料的生物学性状和根尖染色体倍数,分析子代的生物学性状和染色体数目的稳定性。重点观测特异的生物学性状,包括:叶形、叶色、叶脉颜色、叶柄两端颜色、叶长、叶宽、薯皮颜色和薯肉颜色。植株地上部分的观察记录时间为2018年6月,地下块茎的考察与记录时间为2018年10月。
2 结果与分析
2.1 培养基配方对参薯愈伤组织生长诱导的影响
从表1可见,添加2,4-D的①、②、③号培养基均诱导出愈伤组织,且①、②、③号培养基的愈伤组织诱导率差异不显著,愈伤组织诱导率最高达51.67%。添加KT而未添加2,4-D的④号培养基,未能诱导出愈伤组织,说明KT对愈伤组织诱导没有显著影响,2,4-D对诱导出愈伤组织起关键作用。①号培养基比②、③号培养基多添加了椰子汁,其愈伤组织质量和分化率显著高于②、③号培养基,分别达6.06 g和46.67%,说明椰子汁能有效促进愈伤组织的生长发育。③号培养基比②号多添加了KT,两者的愈伤组织质量和分化率差异不明显,说明KT对愈伤组织质量和分化率没有显著影响。
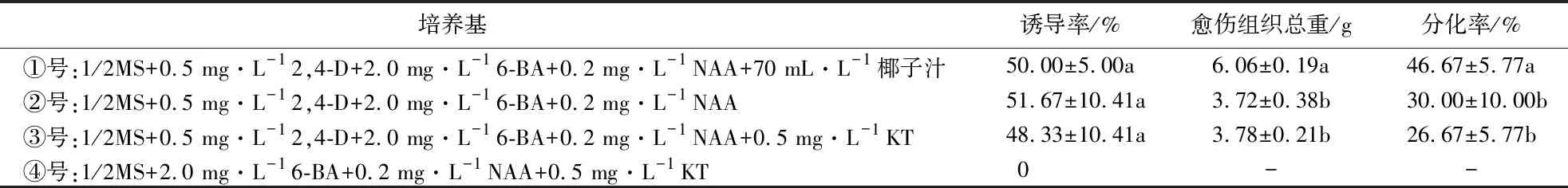
表1 诱导培养基对参薯愈伤组织诱导的影响1)Table 1 Effecs of induction medium on callus induction of D.alata
2.2 再生植株性状与倍性分离
2.2.1 性状分离 图1A中,外植体经诱导产生了愈伤组织,愈伤组织经分化后产生了不同颜色叶片的芽苗;图1B~1D中,芽苗经生根和驯化后产生了差异明显的外观性状;图1B为生根45 d的再生植株,其叶片、茎秆和根部薯块的颜色差异明显;图1C、1D均为驯化3个月的组培苗,再生植株的新叶有紫色、淡紫色和绿色。以上说明,组培后混倍体参薯再生植株性状出现了分离。

A.愈伤组织;B.再生植株生根;C、D.驯化3个月的再生植株。图1 混倍体参薯再生植株的性状分离Figure 1 Traits separation among regenerated plants from mixoploids in D.alata
2.2.2 倍性分离 四倍体和六倍体的混倍体参薯愈伤组织分化芽苗经生根后,通过根尖染色体数鉴定,再生植株中检测到3种不同的倍性水平(四倍体、六倍体以及四倍体和六倍体的混倍体)。从表2可见,再生植株中混倍体的获得率最高,占56.67%;四倍体次之,占28.33%;六倍体获得率最低,占20.00%。
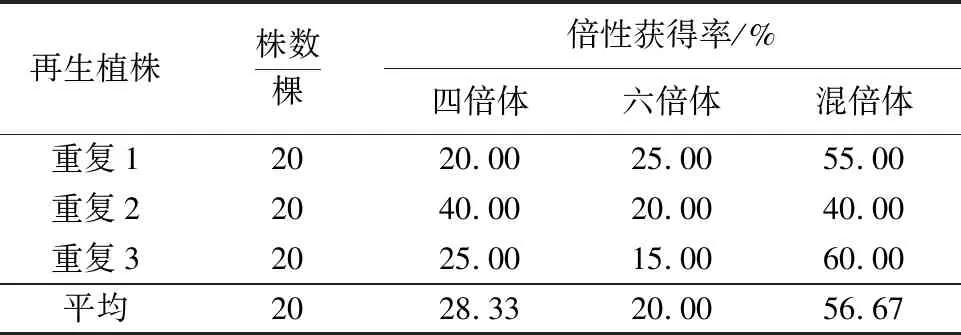
表2 混倍体参薯组培再生植株的倍性分离Table 2 Ploidy separation among regenerated plants from mixoploids in D.alata
2.3 再生植株倍性与生物学性状稳定性分析
2.3.1 倍性稳定性 从表3、图2可见, 1号(图2B)、2号(图2C)株系染色体均为40条,3号(图2D)再生植株染色体为60条。3个单株经过反复切块繁殖后,其染色体数目、倍性均稳定一致,而混倍体参薯经过多次的切块繁殖后仍是混倍体。以上表明,组织培养后混倍体参薯不仅能获得倍性不同的再生植株,还能获得倍性稳定性良好的繁殖后代。
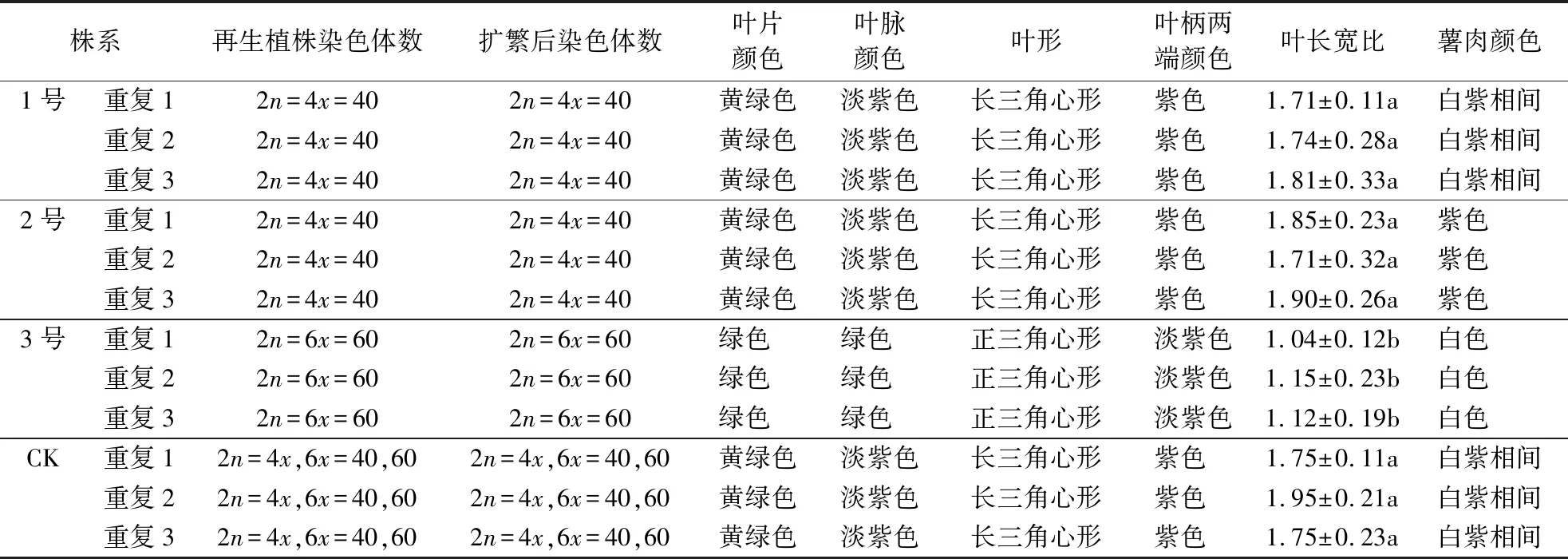
表3 混倍体参薯再生植株的生物学性状和倍性1)Table 3 Biological characteristics and ploidy of regenerated plants from mixoploids in D.alata
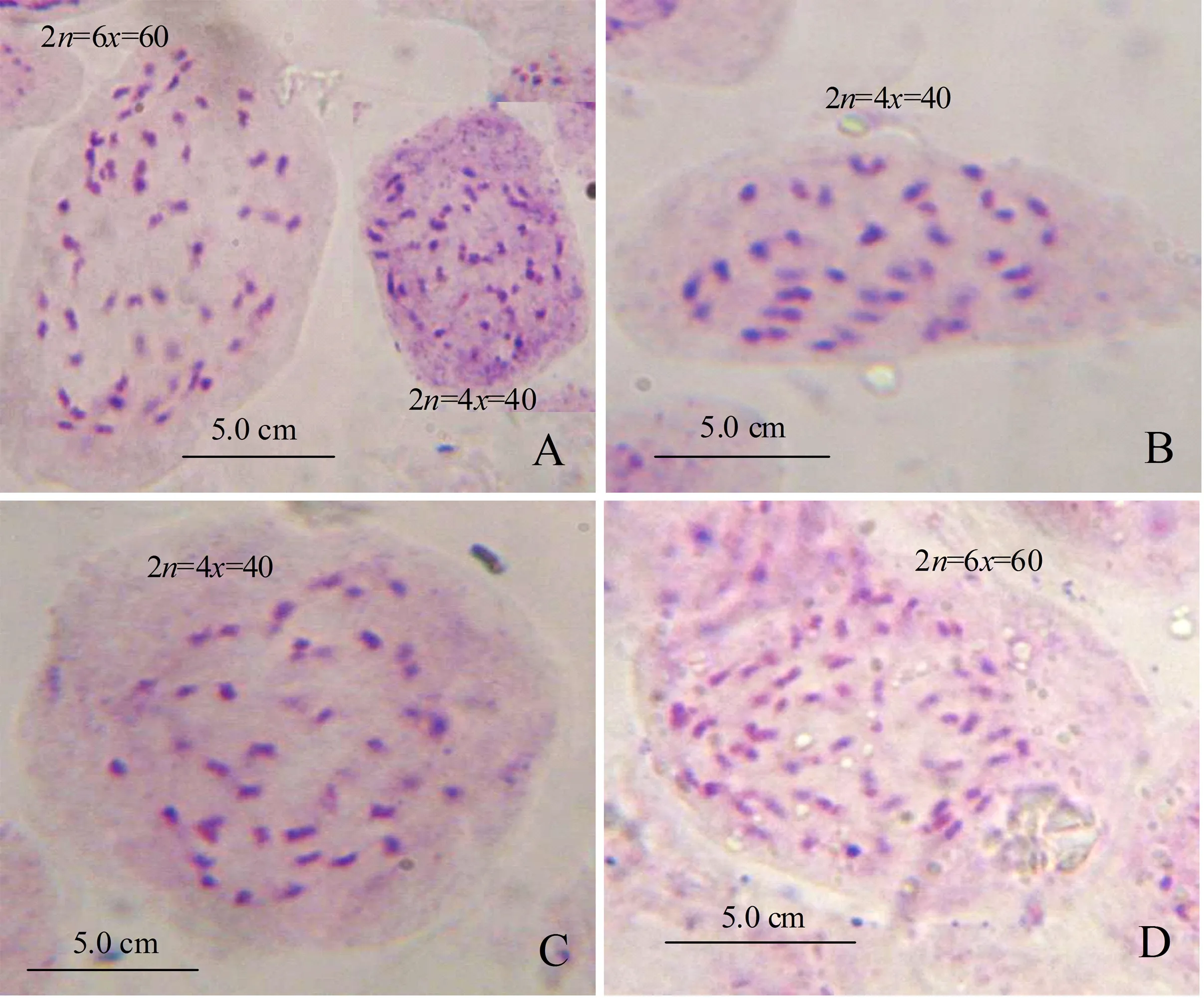
A.混倍体参薯(2n=4x=40,2n=6x=60);B.1号株系再生植株(2n=4x=40);C.2号株系再生植株(2n=4x=40); D.3号株系再生植株(2n=6x=60)。图2 混倍体参薯与3组再生植株的染色体Figure 2 Chromosomes of mixoploids in D.alata and three groups of regenerated plants
2.3.2 生物学性状稳定性 从表3、图3可见,选取的3个再生单株经切块繁殖后,相同株系的质量性状均稳定一致,数量性状差异不显著。以上说明,组培后单一倍性的混倍体参薯再生植株后代生物学性状稳定性良好。但不同株系之间生物学性状差异明显,如1号(图3B、3F)、2号(图3C、3G)、3号(图3D、3H)再生植株,薯肉的颜色均与对照(图2A、2E)不同;3号(图3D、3H)再生植株的生物学性状几乎不同于对照(图3A、3E),表现为叶片、叶脉颜色变成了绿色,叶形变成正三角心形、叶柄变成淡紫色,叶长和叶宽与对照、1号和2号再生植株差异显著。

A为对照的地上部分;B~D分别为1号、2号、3号株系的地上部分;E为对照的薯块;F~H分别为1号、2号、3号株系的薯块。图3 混倍体参薯与3组再生植株的地上部分和薯块Figure 3 Above-ground parts and potato pieces of mixoploids in D.alata and three groups of regenerated plants
综上所述,通过对混倍体参薯进行组织培养,不仅能获得倍性和生物学性状稳定的再生植株,还能获得染色体倍性和生物学性状不同的再生植株。
3 讨论
黄涛等[10]对黄姜(薯蓣科薯蓣属植物)种内染色体数目研究表明,黄姜个体内存在混倍体现象,可能通过细胞内有丝分裂形成了混倍体现象,阐明了黄姜多倍体起源的一种可能途径。此混倍体现象在黄山药[11]、圆山药[12]中也有报道。本研究亦发现福建参薯个体内存在四倍体和六倍体的混倍体。综上表明,混倍体现象在薯蓣科薯蓣属植物中常有发生,而混倍体植物自然发生为多倍体育种带来新的前景。
本研究通过对四倍体和六倍体的混倍体参薯进行组织培养,获得了四倍体、混倍体和六倍体的再生植株,再对再生植株进行田间种植,不仅获得了生物学性状稳定、染色体倍性单一的株系,还获得了生物学性状和倍性不同的多组株系,丰富了参薯的种质资源。这与前人的研究结果相一致[5-8]。因此,利用组织培养分离纯化混倍体,是创建稳定植株和种质资源的有效方法。
