3-(2-吡啶-3-乙烯基)-1H-吲哚钌配合物的合成及抗肿瘤性能
2021-05-16钱晓婷吕梦迪薛旭玲刘红科
钱晓婷 吕梦迪 王 裙 陶 钦 薛旭玲 刘红科
(南京师范大学化学与材料科学学院,南京 210023)
癌症作为全球人类死亡的第二大杀手,给人们的生命健康带来了极大的威胁。作为临床常用的金属化疗药物,铂类药物具有较好的药理学特性,对多种实体瘤都具有很好的治疗效果[1-2],但是这类金属药物的肾毒性及耐药性等问题极大地限制了其药效发挥[3-4]。因此,科学家们逐渐把目标转向其他类金属(如钌、铱、锇及铑等)抗癌配合物[5-8],这类抗癌配合物与铂类药物相比具有低毒性、无耐药性及丰富的光学性质等优良特性。Keppler等报道的KP1019是进入Ⅰ期试验的钌类配合物,研究表明该配合物具有较好的稳定性,且对顺铂耐药的肿瘤细胞也表现出良好的细胞毒性[9]。Sadler课题组报道了一系列具有生物活性的钌类配合物,发现这些钌类配合物具有较小的毒副作用、高的细胞摄取量及生物靶点丰富等优良特性,表现出巨大的应用前景[10-12]。本课题组也通过将金属钌与天然产物甘草次酸、紫苏醇及大黄酸等相连接,设计得到了一系列具有良好抗肿瘤活性的钌配合物[13-14,17]。其中联吡啶钌类配合物因其大的斯托克斯位移、较长的发光寿命、很高的反应活性以及氧化还原等特性,使其成为潜在的诊疗一体化的药物应用于生物体内[15-17]。一些联吡啶钌类药物还可以做到可控药物释放和不同光激发下的实时监测,实现了实时定量监测药物输送过程[18-19]。
吲哚类化合物在自然界中广泛存在,是具有苯并五元氮杂环结构单元的一大类化合物。该类化合物是一类重要的杂环衍生物生物碱,在生物体内显现出了良好的抗肿瘤活性[20-23]。靛玉红、长春碱等吲哚类化合物对慢粒白血病、绒毛膜上皮癌、乳腺癌及宫颈癌等都具有较好的疗效,因而受到广泛关注[24-26]。Sugen公司于2006年上市的舒尼替尼是一种多靶点抑制剂,主要用于治疗恶性间质瘤[27]。这类小分子均通过抑制微管蛋白的合成来影响有丝分裂过程,从而达到抗肿瘤的目的[28-29]。同时还有一些吲哚类的小分子具有抑制肿瘤细胞中2,3-双加氧酶生成的作用,2,3-双加氧酶的过量表达会导致色氨酸的代谢或不足,而导致T细胞的无效性,抑制其生成可以达到免疫治疗的功效[30]。因此,吲哚类小分子化合物在抗癌领域具有广泛的应用前景,值得进一步探究。
在本工作中,我们合成了一种基于吲哚类衍生物的二联吡啶钌配合物,并对其进行了核磁及质谱的表征。使用MTT法对配合物的细胞毒活性进行了评估,通过共聚焦成像、电感耦合等离子体质谱确定了配合物的亚细胞器定位,同时使用流式细胞术及免疫蛋白印迹等手段对配合物诱导肿瘤细胞死亡的方式等进行了深入研究。
1 实验部分
1.1 试剂与仪器
实验所用的试剂及化学药品均为商用分析纯,无需进一步纯化即可直接使用。水合氯化钌(RuCl3·3H2O)、3-吡啶乙酸盐酸盐 (3-pyridylacetic acid hydrochloride)、1H-吲哚-3-甲醛(1H-indole-3-carbaldehyde)、2,2′-联吡啶(2,2′-bipyridine)、氯化锂(lithium chloride)等化学药品购于晚晴化学品公司。六氢吡啶、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)等试剂均购于阿拉丁试剂有限公司。牛血清白蛋白(BSA)、Dulbecco改良的细胞培养基(DMEM)、链霉素和青霉素、胰蛋白消化酶-EDTA、细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒、细胞自噬检测试剂盒、细胞周期检测试剂盒等生物试剂均购于南京凯基生物科技有限公司。
1H NMR使用Bruker Avance Ⅱ 400 MHz波谱仪检测;电喷雾电离质谱(ESI-MS)使用LCQ(Thermo Scientific)质谱仪检测;UV-Vis数据使用Lambda 365紫外可见分光光度计测得;荧光数据使用FS5荧光分光光度计(Edinburgh Instrument)获得;化合物的细胞毒活性通过多功能酶标仪LabServ K3测定;激光共聚集显微镜(A1,Nikon)测试配合物在细胞内的共定位成像;应用流式细胞仪(BD FACSverse,美国)进行细胞凋亡、周期及自噬等分析测定;采用电感耦合等离子体质谱仪(ICP-MS,X Series 2,Thermo Fisher)测定金属元素Ru在细胞器内的含量;在Mini-Protean Tetra System(BIO RAD,Power PacTM HC)上进行蛋白免疫印迹(Western Blot)实验。
1.2 配体及配合物的合成
1.2.1 3-(2-吡啶-3-乙烯基)-1H-吲哚配体Indole的合成
将 3-吡啶乙酸盐酸盐(0.52 g,3 mmol)溶解在1,4-二氧六环(6 mL)中,并加入三乙胺(1 070 μL,7.6 mmol),将混合溶液在环境温度下避光搅拌20 min,随后加入 1H-吲哚-3-甲醛(0.292 g,2.0 mmol)和六氢吡啶(440 μL),并将上述混合液在氩气气氛下避光室温搅拌20 h,使用薄层色谱法(TLC)监测至反应结束后旋干溶剂。将所得粗产物通过快速柱色谱法(石油醚/乙酸乙酯,4∶1,V/V)分离提纯,得到浅黄色固体(0.308 g,70%)。1H NMR(400 MHz,DMSO-d6):δ11.40(s,1H),8.76(d,J=2.0 Hz,1H),8.37(dd,J=4.7,1.5 Hz,1H),8.02(ddd,J=8.0,7.1,4.7 Hz,2H),7.69(d,J=2.6 Hz,1H),7.58(s,1H),7.54(s,1H),7.43(t,J=9.2 Hz,1H),7.36(dd,J=7.9,4.7 Hz,1H),7.25~7.04(m,3H)。ESI-MS(m/z):[Indole+H]+理论值:220.28,实验值:220.15。元素分析按 C15H12N2计算值(%):C 81.79,H 5.49,N 12.72。实验值(%):C 81.87,H 5.51,N 12.65。
1.2.2 二联吡啶钌前体Ru(bpy)2Cl2的合成
将 RuCl3·3H2O(3.6 g,14.9 mmol)、2,2′-联吡啶(4.68 g,30 mmol)、LiCl(4.2 g,1 mmol)和 DMF(25 mL)加入到避光的三口烧瓶中,将混合物在氩气氛围下加热回流搅拌10 h,TCL监测至反应结束后旋干溶剂。待冷却至室温后,将反应液倒入丙酮(125 mL)中,在0℃下冷却过夜。过滤该混合物,分别用水(15 mL×3)、乙醇(15 mL×3)和乙醚(15 mL×3)依次洗涤固体,然后将固体放入真空烘箱中干燥过夜,得到棕黑色粉末即为纯的产品(4.7 g,78%)。1H NMR(400 MHz,DMSO-d6):δ9.97(d,J=4.7 Hz,1H),8.65(d,J=8.0 Hz,1H),8.50(d,J=8.0 Hz,1H),8.14~8.02(m,1H),7.78(dd,J=9.6,3.6 Hz,1H),7.73~7.64(m,1H),7.52(d,J=5.5 Hz,1H),7.19~7.04(m,1H)。ESI-MS(m/z):[Ru(bpy)2]2+理论值:206.67,实验值:206.58。
1.2.3 配合物Ru-Indole的合成
将前体 Ru(bpy)2Cl2(96 mg,0.18 mmol)、配 体Indole(44 mg,0.2 mmol)、10 mL乙醇-水的混合溶剂(8∶2,V/V)加入到三口烧瓶中,并将混合物在氩气氛围下回流24 h,TLC监测至反应结束后旋干溶剂。加入三氯甲烷(2 mL)溶解固体,再加入乙醚(15 mL)将配合物沉淀出来,将混合物在0℃冷却过夜。离心得到固体后,用乙醚(10 mL×2)和丙酮(10 mL×2)洗涤,真空干燥过夜,得到95.1 mg较纯的深红色固体,即为产品Ru-Indole,产率约为75%。1H NMR(400 MHz,DMSO-d6):δ11.50(s,1H),9.91(t,J=22.0 Hz,1H),8.79(t,J=11.1 Hz,1H),8.71~8.64(m,1H),8.60(dd,J=10.0,7.2 Hz,1H),8.25~8.12(m,1H),8.06(d,J=8.0 Hz,1H),7.93(dd,J=9.1,5.2 Hz,2H),7.81~7.74(m,1H),7.71(s,1H),7.63(d,J=5.3 Hz,1H),7.42(dd,J=15.6,7.2 Hz,1H),7.30(dd,J=12.9,6.7 Hz,1H),7.16(dt,J=15.0,6.7 Hz,1H),6.92(d,J=16.6 Hz,1H)。ESIMS(m/z):[Ru-Indole-Cl]+理论值:669.17,实验值:669.11。元素分析按C35H28ClF6N6PRu计算值(%):C 51.64,H 3.47,N 10.32。实验值(%):C 51.73,H 3.55,N 10.27。
1.3 配体及配合物的光物理性质测定
使用紫外可见分光光度计检测了配体Indole及配合物Ru-Indole在298 K下的紫外吸收光谱。用DMSO将配合物及配体溶解并制成20 mmol·L-1的储存液,用水将两者的储存液分别稀释成30 μmol·L-1的含有1% DMSO的样品溶液。测试时石英比色皿与光源路径为1 cm,吸收波长收集范围设定为250~600 nm。使用荧光分光光度计检测配合物及配体在298 K下的荧光发射光谱。用水将两者的储存液分别稀释成10 μmol·L-1的含有1% DMSO的样品溶液,并在488 nm激发波长下使用荧光分光光度计记录下550~700 nm范围内的发射光谱。
1.4 配体及配合物的脂水分配系数
使用摇瓶法测试Indole、Ru(bpy)2Cl2及配合物Ru-Indole的脂水分配系数。使用正辛醇与0.9% NaCl溶液等体积摇动48 h使水相与有机相互饱和。将三者分别溶解在分离出的NaCl溶液中,再加入等体积的分离出的正辛醇溶液,在室温下摇动2 h,使样品在两相中达到分配平衡。用7 000 r·min-1的转速将样品离心5 min,分别吸出有机相及水相,使用紫外可见分光光度计测试两相中的吸光度,通过在有机相及水相中的吸光度的比值求对数计算出脂水分配系数lgPo/w值。
1.5 体外细胞毒活性检测
选用人源肿瘤细胞系宫颈癌细胞(HeLa)、人非小细胞肺癌细胞(A549)、乳腺癌细胞(MCF-7)、肝癌细胞(HepG2)及人正常肝细胞(LO2),对配体Indole、配合物前体Ru(bpy)2Cl2、配合物Ru-Indole以及对照药物顺铂(cisplatin)采用 MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)法[31]进行细胞毒活性测定。细胞在含有10% FBS(胎牛血清,Gibco BRL)、100 μg·mL-1链霉素和100 μg·mL-1青霉素(Gibco BRL)的DMEM(Dulbecco改良的Eagle培养基,Gibco BRL)中培养。在96孔细胞培养板中接种(每孔5 000个)对数生长期的细胞,将细胞在5%(体积分数,下同)的CO2、310 K条件下培养过夜以确保细胞贴壁且正常生长,加入不同浓度的待测药物(培养基中含1%的DMSO溶液)继续孵育48 h。然后每孔加入20 μL的浓度为5 mg·mL-1的MTT溶液,继续于培养箱中孵育4 h。吸出培养液,在每个孔中加入150 μL的二甲亚砜溶液,振荡5 min后,使用LabServ K3酶标仪读取590 nm处吸光度值,计算各物质对癌细胞在48 h内增殖的半数抑制浓度(IC50值)[32]。
1.6 配合物的亚细胞器分布
激光共聚焦成像实验:分别使用探针Mito-green、Lyso-blue、Hoechst 33342检测Ru-Indole在HeLa细胞中线粒体、溶酶体和细胞核中的分布。将HeLa细胞以5×105mL-1的密度接种于12孔板中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含20 μmol·L-1待测药物的DMEM培养基(含有1% DMSO)溶液,继续孵育12 h。吸出培养基,用磷酸盐缓冲液(PBS)洗涤3次,将浓度为2 μmol·L-1的线粒体、溶酶体及细胞核染料分别加入对应的孔中,孵育30 min后吸出染料,并用PBS洗涤3次,取出盖玻片并倒扣在载玻片上,在共聚焦显微镜下进行测试。商业染料为Mito-green(λex=490 nm,λem=516 nm)、Lyso-blue(λex=373 nm,λem=425 nm)、Hoechst 33342(λex=346 nm,λem=460 nm)。
电感耦合等离子体质谱(ICP-MS):将HeLa细胞以2×106mL-1的密度接种在10 cm细胞培养皿中,并将细胞在5% CO2、310 K条件下孵育12 h。然后将含20 μmol·L-1Ru-Indole的DMEM培养基(含有1% DMSO)溶液添加到细胞中,继续孵育12 h,收集细胞并用PBS洗涤2次。然后用线粒体/细胞核制备试剂分别提取细胞核、线粒体和细胞质。分别向提取到的细胞核、线粒体和细胞质中依次添加浓硝酸(100 μL,95 ℃,2 h)、30%过氧化氢(50 μL,95 ℃,1.5 h)和浓盐酸(50 μL,95 ℃,0.5 h),将细胞器完全消解。待溶液冷却至室温后,将消化得到的液体过滤并用超纯水稀释至2 mL。样品中钌元素的含量通过ICPMS(X系列2,Thermo Fisher,美国)测定。每个样品测试3次,将平均值作为最终结果。
1.7 细胞周期阻滞检测
使用细胞周期检测试剂盒(RNase A/PI)研究Ru-Indole对HeLa细胞周期的影响。将HeLa细胞以1.5×106mL-1的密度接种于6孔板中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含有不同浓度梯度(0、10、20、40 μmol·L-1)的配合物的DMEM培养基(含有1% DMSO)溶液,继续孵育24 h。收集细胞,用PBS洗涤2次,缓慢加入体积分数为70%的冰乙醇来重悬细胞,并置于4℃的冰箱中过夜固定。离心除去固定液收集细胞,用PBS洗涤2次,然后将根据一定比例(PI/RNase A,9∶1,V/V)配制的染色液加入到细胞中并在黑暗条件下孵育30 min。在30 min内使用BD FACSverse流式细胞仪分析样品,选择的通道为FL2(λex=488 nm,λem=620 nm),使用FlowJo10.1软件分析实验结果。
1.8 细胞凋亡检测
使用Annexin V-FITC/PI细胞凋亡检测试剂盒探究Ru-Indole诱导HeLa细胞的死亡方式。将HeLa细胞以1.5×106mL-1的密度接种于6孔板中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含有不同浓度梯度(0、10、20、40 μmol·L-1)的Ru-Indole的DMEM培养基(含有 1% DMSO)溶液继续孵育24 h。收集细胞,用PBS缓冲液洗涤细胞2次,并用500 μL的Binding buffer重悬细胞。每个孔中分别加入5 μL的V-FITC和5 μL的PI对细胞进20 min的避光染色处理,0.5 h内使用BD FACSverse流式细胞仪对样品进行检测。PI的激发波长:488 nm,发射波长:550~610 nm;FITC的激发波长:488 nm,发射波长:500~560 nm。
1.9 线粒体膜电位(MMP)的检测
使用线粒体膜电位检测试剂盒JC-1检测Ru-Indole处理的HeLa细胞MMP的变化。将HeLa细胞以1.5×106mL-1的密度接种于6孔板中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含有不同浓度梯度(0、10、20、40 μmol·L-1)的配合物的 DMEM 培养基 (含有 1% DMSO)溶液继续孵育24 h。收集细胞,用PBS洗涤2次,并添加到配制的JC-1工作溶液中染色25 min。离心收集细胞,用PBS洗涤细胞2次,之后将细胞重悬于PBS缓冲液中。0.5 h内使用BD FACSverse流式细胞仪分析样品,选择的通道为FL1(λex=488 nm,λem=510~550 nm)和 FL2(λex=525 nm,λem=560~620 nm),最后使用FlowJo10.1软件进行实验结果分析。
1.10 细胞自噬分析
激光共聚焦成像实验:使用细胞自噬检测试剂盒对配合物Ru-Indole诱导细胞产生自噬的细胞群进行荧光成像分析。将HeLa细胞以5×105mL-1的密度接种于12孔板中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含20 μmol·L-1待测药物的 DMEM 培养基(含有 1% DMSO)溶液,继续孵育24 h。用PBS缓冲液洗涤细胞2次,加入3.7%甲醛固定,并在室温下孵育20 min,除去溶液,用PBS洗涤2次后向12孔板中加入0.2% Triton X-100渗透液共孵育15 min后去除,加入一抗LC3兔多抗工作液,在黑暗条件下室温孵育2 h,然后用PBS缓冲液洗涤细胞3次。再加入FITC标记的山羊兔抗IgG的二抗在黑暗中继续孵育1 h,用PBS洗涤细胞3次。然后加入DAPI工作液孵育3~5 min来染色细胞核,用PBS洗涤细胞2次,立即使用共聚焦显微镜进行拍摄。DAPI的激发波长:357 nm,发射波长:430~490 nm;FITC的激发波长:488 nm,发射波长:500~560 nm。
蛋白免疫印迹实验:将HeLa细胞以2×106m L-1的密度接种于10 cm培养皿中,在5% CO2、310 K条件下孵育12 h以确保细胞贴壁生长。然后向其中加入含有不同浓度梯度(0、10、20、40 μmol·L-1)的Ru-Indole的DMEM培养基(含有1% DMSO)溶液继续孵育24 h。之后,通过离心收集全细胞,使用RIPA细胞裂解试剂盒在0℃条件下提取全细胞裂解液和蛋白,并用BCA蛋白浓度检测试剂盒测定蛋白质的浓度。将不同浓度配合物处理过的蛋白样品进行归一化处理,向归一化的样品中加入SDSPAGE上样缓冲液(1×),随后将蛋白样品在95℃条件下加热15 min。冷却至室温后,蛋白质样品在十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE,12%分离凝胶和15%浓缩凝胶)上电泳,然后在电流(200 mA,1 h)和冰浴条件下,将蛋白转印到PVDF膜上。膜转移后,用脱脂奶粉(溶于5% PBST,即含吐温-20的PBS缓冲液)密封蛋白2 h,然后选用合适的一抗将其稀释至特定的浓度,将膜在一抗中孵育过夜使其与特异性蛋白结合。结束后,使用PBST缓冲液进行洗涤(5×8 min)。将洗净的膜置于预先配制好的二抗孵育液中孵育1 h,再使用PBST缓冲液进行洗涤(5×8 min)。将等体积配制好的ECL显影液覆盖在PVDF膜上,孵育2 min后使用Power PacTM HC(新加坡)的BIO RAD成像,通过Image Lab软件分析图像。
2 结果与讨论
2.1 合成与表征
选取具有抗肿瘤活性的3-吲哚甲醛[33-34],将其与3-吡啶乙酸盐酸盐通过羟醛缩合反应进行化学修饰得到配体3-(2-吡啶-3-乙烯基)-1H-吲哚(Indole);二联吡啶钌前体Ru(bpy)2Cl2的合成参考文献通过将RuCl3·3H2O与2,2′-联吡啶在DMF中通过配位成键得到[35];继续将Indole与Ru(bpy)2Cl2在乙醇和水的体系中加热回流重结晶提纯,即可通过氮原子与钌原子进行配位成键的方式得到具有抗肿瘤活性的配合物Ru-Indole。合成路径如图1所示。通 过1H NMR及 ESI-MS对 配 体 Indole、前 体Ru(bpy)2Cl2及配合物Ru-Indole进行了表征。
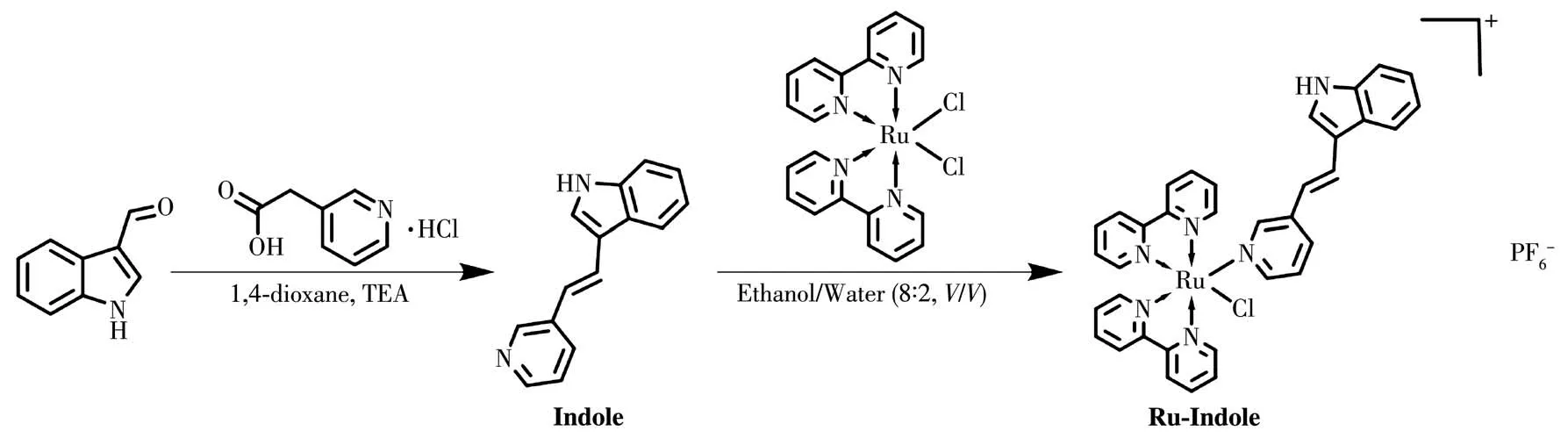
图1 配体Indole及配合物Ru-Indole的合成路线Fig.1 Synthetic routes of ligand Indole and complex Ru-Indole
2.2 配体及配合物的光物理性质
研究金属配合物的光物理性质有望实现配合物在细胞内的可视化跟踪进而探究其对细胞的生理学功能[36-37]。我们使用紫外可见分光光度计及荧光分光光度计测试了配体Indole及配合物Ru-Indole的紫外吸收及荧光发射光谱,结果如图2所示。图2A为配体的紫外吸收及荧光发射谱图,配体的紫外吸收波长为320 nm,荧光发射波长为490 nm。图2B为配合物的紫外吸收及荧光发射谱图。从图中可以看出Ru-Indole的吸收带范围为260~550 nm,其中295 nm处的吸收带归属于Ru-Indole分子中自旋允许的联吡啶N^N为中心(1LC)的π-π*跃迁,在330 nm处的吸收带归属于金属到配体的电荷转移(1MLCT及3MLCT)及配体到配体的电荷转移(LLCT)[38]。同时发现配合物Ru-Indole在用450 nm的光激发时,在590 nm处有较强的荧光发射峰。这与无荧光发射的钌类配合物相比有望实现配合物在细胞内的可视化跟踪成像。
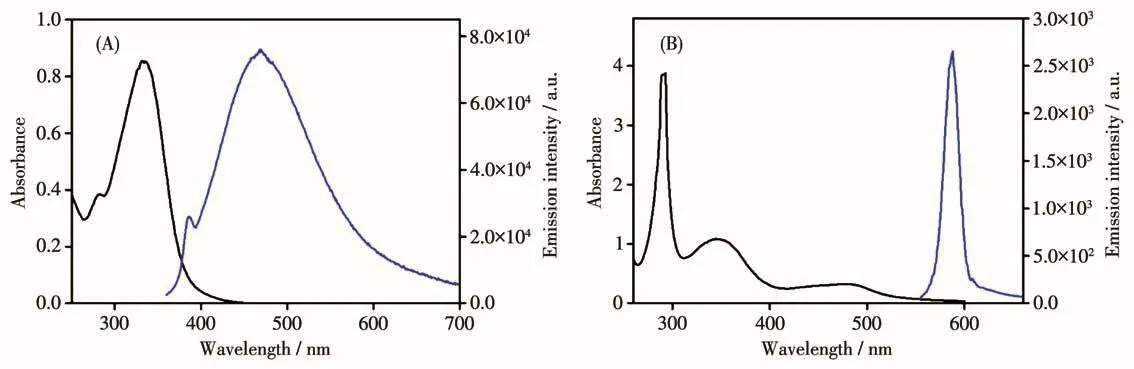
图2 配体Indole(A)及配合物Ru-Indole(B)在水溶液中的紫外吸收及荧光发射谱图Fig.2 UV absorption and fluorescence emission spectra of ligand Indole(A)and complex Ru-Indole(B)in aqueous solution
2.3 配合物的脂水分配系数
化合物的亲脂性是衡量细胞摄取量的重要指标[39],研究表明,亲脂性较强的物质更易透过细胞膜的磷脂双分子层而进入细胞内,从而更有利于其发挥药效[40]。反之,亲水性较强的化合物,则不易进入细胞内。我们使用摇瓶法对配合物、配体及前体的脂溶性进行了测试,并用lgPo/w说明化合物的亲脂性能。lgPo/w值是物质在正辛烷(油)和水中的分配系数的对数值,能反映物质在油水两相中的分配情况。lgPo/w值越大,说明该物质亲脂性越强;反之,lgPo/w值越小,则亲水性越强[41]。结果如表1所示。该结果表明引入的配体有效地增强了配合物的脂溶性,从而使配合物更容易进入细胞;而前体Ru(bpy)2Cl2具有较小的lgPo/w值,说明其透过细胞膜的能力不如配合物Ru-Indole。
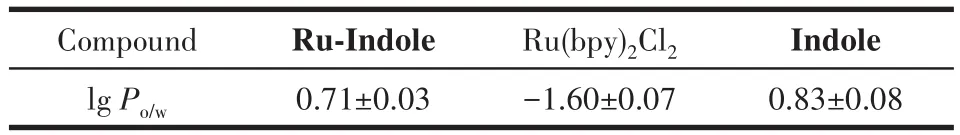
表1 配合物Ru-Indole、前体Ru(bpy)2Cl2及配体Indole的脂溶性数值Table 1 Lipid solubility values of complex Ru-Indole,precursor Ru(bpy)2Cl2 and ligand Indole
2.4 细胞毒活性研究
采用MTT法测定了配体Indole、前体Ru(bpy)2Cl2及配合物Ru-Indole对宫颈癌细胞(HeLa)、人非小细胞肺癌细胞(A549)、乳腺癌细胞(MCF-7)、肝癌细胞(HepG2)及人正常肝细胞(LO2)在48 h的细胞毒性,并以顺铂cisplatin作为对照。由配合物IC50值结果(表2)可以看出,配体Indole及前体Ru(bpy)2Cl2对肿瘤细胞几乎没有表现出细胞毒性,其中Indole对几种细胞的 IC50值均大于 100 μmol·L-1,Ru(bpy)2Cl2的IC50值均大于 200 μmol·L-1,这是因为 Ru(bpy)2Cl2的细胞摄取量较低,并且可能与细胞外的分子发生反应[42-43]。而当两者配位后得到的配合物Ru-Indole对几种细胞有5倍甚至10倍毒性的提高,对HeLa细胞的毒性最好,IC50值为20.2 μmol·L-1。此结果有望为新型抗肿瘤金属药物的开发提供设计思路[44]。为了探究配合物对几种肿瘤细胞毒性提高的原因,我们对配合物Ru-Indole在细胞内的相关性质进行了进一步的研究。
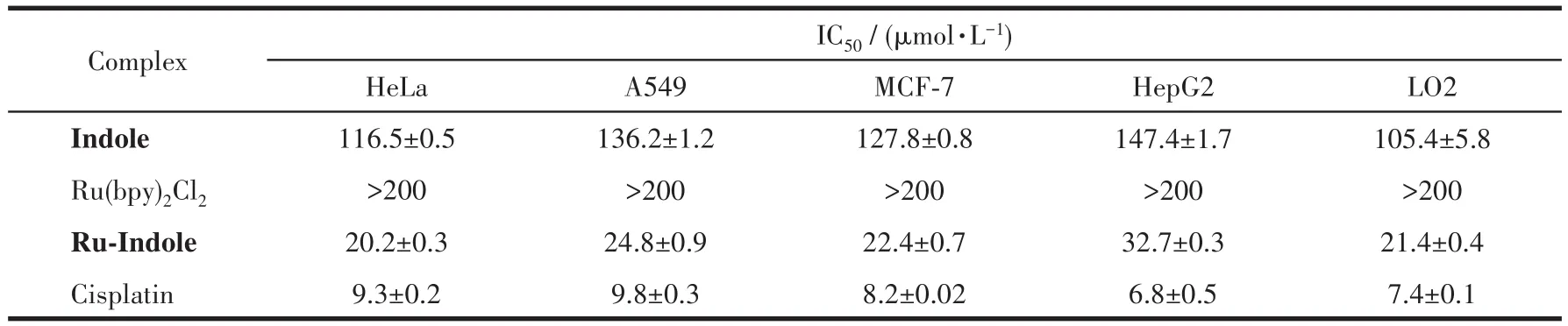
表2 配体Indole、Ru(bpy)2Cl2及配合物Ru-Indole在48 h后对不同类型细胞株的IC50值Table 2 IC50 values towards different cells after treated with Ru(bpy)2C l2,Indole,and Ru-Indole for 48 h
2.5 配合物的亚细胞器分布
了解药物的细胞器富集情况有助于进一步研究其抗肿瘤活性的作用机理[45],探讨药物的细胞定位常用的方法有激光共聚焦成像法和电感耦合等离子体质谱法等[46]。配合物Ru-Indole具有良好的光物理性质,在一定波长的光激发下可以产生荧光,因此我们首先通过共聚焦激光扫描显微镜研究了Ru-Indole在HeLa细胞中的亚细胞器分布情况。如图3所示,配合物孵育细胞6 h后,细胞内就有较强的荧光信号,说明Ru-Indole具有良好的细胞膜通透性。当Ru-Indole的荧光信号分别与3种商用染料Mito-green、Lyso-blue及Hoechst 33342共孵育时,可以看出,Ru-Indole的红色荧光信号与Mitogreen和Lyso-blue的荧光信号均具有较好的重叠,这说明Ru-Indole可以分布在线粒体和溶酶体中。为了进一步确定配合物在亚细胞器中的分布情况,我们又提取了Ru-Indole孵育12 h后HeLa细胞的细胞器,利用ICP-MS检测了细胞器如细胞核、线粒体和细胞质中钌元素的相对含量,结果如表3所示。发现Ru在细胞质中的含量达52%(含溶酶体),同时在线粒体中的含量达29%,这一结果与激光共聚焦成像的结果一致,证明配合物Ru-Indole在溶酶体和线粒体中均有富集,而在细胞核中富集量很少,这与文献报道的结果是一致的[47],同时为我们进一步推断配合物的抗肿瘤活性作用机理提供了一定的实验基础。
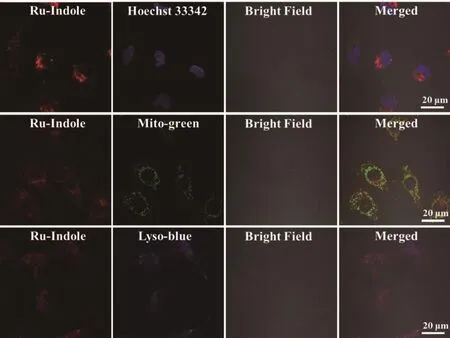
图3 共聚焦显微镜测试配合物Ru-Indole在各细胞器中的定位图Fig.3 Confocal microscopy images of HeLa cells treated with Ru-Indole in different organelles

表3 ICP-MS测试配合物Ru-Indole在亚细胞器中的分布Table 3 Distribution of complex Ru-Indole in subcellular organelles using ICP-MS technique
2.6 配合物诱导HeLa细胞周期阻滞和凋亡
细胞周期分为DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。细胞周期与细胞的增殖有直接的关系[48],有报道表明,通过对细胞周期的调控并将细胞周期阻滞在特定的分裂期可能是金属抗癌药物抑制癌细胞增殖的原因之一[49-50]。为了研究Ru-Indole对细胞周期的影响,我们使用流式细胞仪检测了不同浓度Ru-Indole对HeLa细胞的周期阻滞效果,结果如图4A所示。与对照组相比,当将不同浓度梯度的Ru-Indole孵育HeLa细胞24 h后,随着药物浓度的增加,配合物诱导的G2/M期的细胞比例呈上升趋势,但上升趋势不明显。当配合物浓度达到2倍IC50时,G2/M期细胞含量仅从22.9%上升至30.0%,配合物Ru-Indole不能明显阻滞细胞周期,这说明Ru-Indole不是通过诱导细胞周期发生阻滞从而抑制肿瘤细胞的增殖。
细胞凋亡是细胞基因控制的程序性死亡,一些金属药物通过该路径诱导细胞死亡从而发挥细胞毒性[51-52]。我们使用流式细胞仪检测了配合物Ru-Indole诱导细胞凋亡及坏死情况,结果如图4B所示。经不同浓度梯度(0、10、20、40 μmol·L-1)的Ru-Indole处理24 h后,HeLa细胞的凋亡数目很少且保持不变,当配合物浓度为2倍IC50时,配合物活细胞的比例依然高达90.0%。因此,配合物Ru-Indole诱导癌细胞死亡的途径不是凋亡而是其他途径。
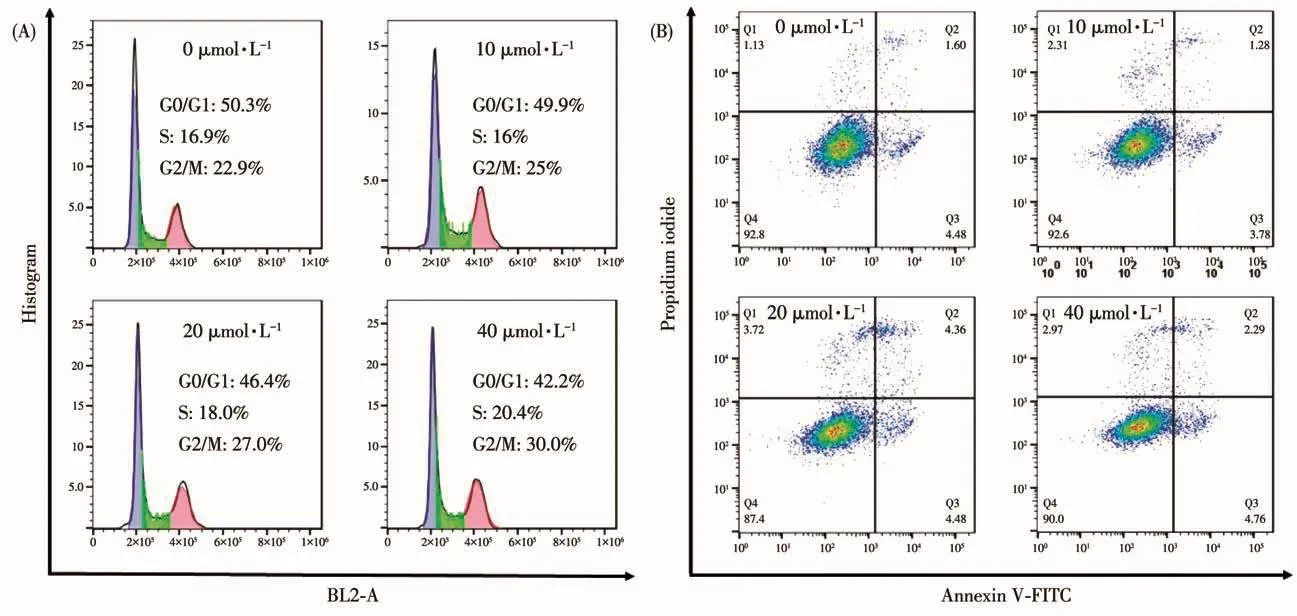
图4 (A)配合物Ru-Indole对HeLa细胞周期阻滞效果;(B)配合物Ru-Indole诱导HeLa细胞凋亡图Fig.4 (A)Effect of complex Ru-Indole on HeLa cell cycle arrest;(B)HeLa cell apoptosis induced by complex Ru-Indole
2.7 配合物诱导线粒体膜电位变化
从上述结果中得知配合物Ru-Indole不是通过阻滞细胞周期和诱导细胞凋亡导致细胞死亡的,因此我们需要从其他方面来进一步探讨Ru-Indole对细胞的影响。从药物摄取结果了解到Ru-Indole有部分可定位于线粒体,因此我们猜测它可能对于线粒体造成损伤从而达到诱导细胞死亡的目的。JC-1是检测细胞线粒体膜电位变化常用的检测试剂盒,当线粒体膜电位较高时,JC-1以聚集体形式存在,同时发出红色荧光(red),而当线粒体膜电位下降时,JC-1会以单体形式存在,发出绿色荧光(green),因此JC-1在2个通道荧光强度的变化经常被用来检测细胞线粒体膜电位变化情况[53]。从图5的结果可以看出,当我们用不同浓度的 Ru-Indole(0、10、20、40 μmol·L-1)处理 HeLa细胞时,未经药物处理(0 μmol·L-1)的细胞的JC-1荧光主要为红色荧光,而随着配合物浓度的增加,绿色荧光强度呈现浓度依赖性增强,同时红色荧光强度与绿色荧光强度的比值也随着配合物浓度的增加逐渐减小,当Ru-Indole的浓度达到 40 μmol·L-1时,绿色荧光群的比例从 0 μmol·L-1的13.8%增加到42.1%。这表明配合物Ru-Indole具有诱导线粒体膜电位降低的功效,药物通过线粒体通路作用是诱导细胞死亡的原因之一[54]。
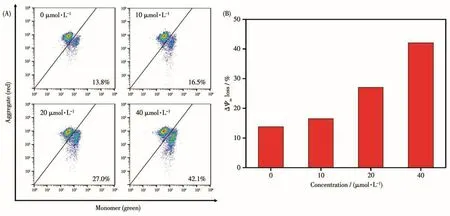
图5 配合物Ru-Indole对HeLa细胞线粒体膜电位的影响:(A)流式细胞术用于检测线粒体膜电位变化情况;(B)线粒体膜电位降低柱状统计结果Fig.5 Effect of Ru-Indole on mitochondrial membrane potential of HeLa cell:(A)Changes in mitochondrial membrane potential detected by flow cytometry;(B)mitochondrial membrane potential reduction histogram
2.8 配合物诱导细胞自噬
细胞死亡方式包含多种途径:自噬、凋亡、坏死及铁死亡等[55-57],其中细胞自噬为常发生的细胞死亡方式。自噬是亚细胞膜结构发生动态变化并经溶酶体介导对细胞内蛋白质和细胞器降解的过程[58]。当发生细胞自噬时,胞浆型LC3(即LC3-Ⅰ)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-Ⅱ),LC3-Ⅱ与LC3-Ⅰ含量比值(wⅡ/wⅠ)的大小可评估自噬水平的高低[59]。前述的实验结果表明细胞不是通过凋亡方式发生死亡的,因此我们进一步通过共聚焦成像和蛋白免疫印迹法研究了细胞自噬的情况。我们首先使用激光共聚焦显微镜探究了配合物Ru-Indole诱导HeLa细胞自噬的情况,结果如图6A所示。与不加药物的对照组相比,加药组(20 μmol·L-1)处理后的细胞内绿色荧光强度有了明显的提高,意味着细胞内产生了大量的自噬小体,这说明Ru-Indole诱导了肿瘤细胞的自噬。为进一步验证该结果,我们使用蛋白免疫印迹法研究了配合物处理HeLa细胞后自噬蛋白LC3表达量的变化。图6B实验结果表明,与未经药物处理的细胞相比,加入 10 μmol·L-1的Ru-Indole处理24 h后,LC3-Ⅱ表达量明显提高。并且随着配合物Ru-Indole浓度的增加,LC3-Ⅱ表达量的增加呈现浓度依赖的趋势,同时wⅡ/wⅠ也明显增加。使用Image Lab软件计算定量分析后(图6C)可以看出,随着Ru-Indole浓度的增加,wⅡ/wⅠ明显增加,配合物浓度与自噬水平之间存在剂量依赖关系,相对于0 μmol·L-1,Ru-Indole浓度为40 μmol·L-1时对细胞自噬蛋白表达量提高了13倍之多。以上实验测试结果表明配合物Ru-Indole也可以通过诱导HeLa细胞自噬的方式诱导细胞死亡。
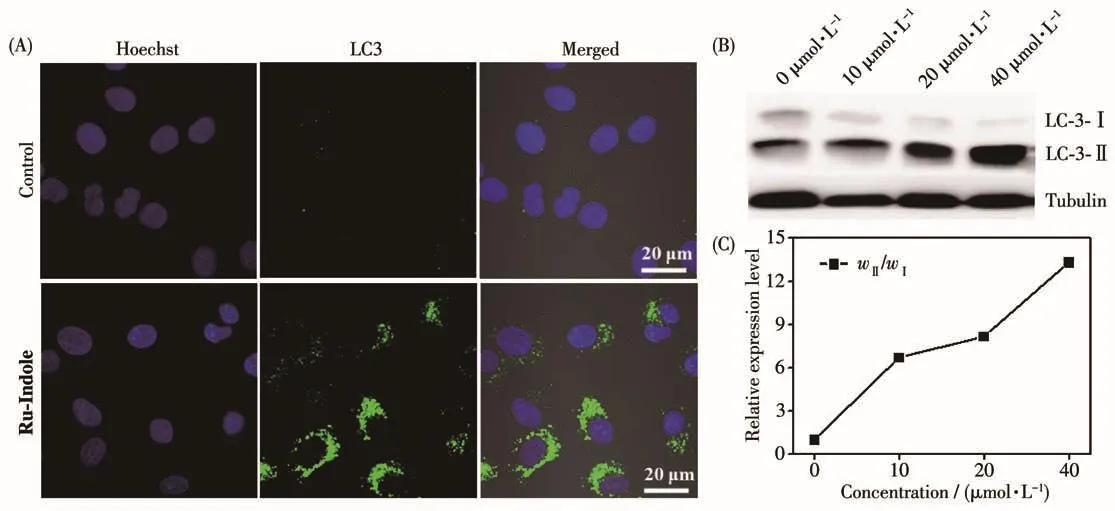
图6 配合物Ru-Indole诱导的细胞自噬:(A)共聚焦显微镜成像图;(B)蛋白印迹法成像图;(C)LC3-Ⅱ与LC3-Ⅰ蛋白定量统计图Fig.6 Autophagy induced by Ru-Indole:(A)confocal microscopy imaging;(B)western blot imaging;(C)ratio of LC3-Ⅱto LC3-Ⅰ (wⅡ/wⅠ)treated with Ru-Indole at different concentrations
3 结 论
我们将无毒性的吲哚类衍生物进行化学修饰后引入到同样无毒的二联吡啶钌前体中,得到了抗肿瘤活性明显提高的钌配合物Ru-Indole,并对配合物的抗肿瘤机理进行了深入研究。研究结果表明,与配体及配合物前体相比,配合物Ru-Indole对肿瘤细胞的毒活性有了极大的提高,同时发现配合物可富集在线粒体和溶酶体中,可以诱导肿瘤细胞线粒体膜电位的降低,通过线粒体通路引起细胞死亡。同时通过激光共聚焦成像及蛋白印迹实验发现配合物Ru-Indole还会引起肿瘤细胞的自噬从而诱导细胞死亡。总之,将吲哚衍生物引入到二联吡啶钌配合物中,不仅提高了钌配合物的抗肿瘤活性,而且拓展了吲哚衍生物在配合物中的应用,为新型联吡啶钌配合物在抗肿瘤方面的应用提供了一定的指导作用。
