基于Co3O4纳米粒子的“串联酶”活性检测葡萄糖的表面增强拉曼光谱策略
2021-05-16夏学敏翁仪瑾唐如意
夏学敏 张 霞 翁仪瑾 张 垒 唐如意
(上海工程技术大学材料工程学院,上海 201620)
0 引 言
表面增强拉曼散射(surface-enhanced Raman scattering,SERS)以其超高的灵敏度和无损检测的特点,已经在表面科学、分析化学和生物化学等领域得到广泛的应用[1-4]。传统的SERS基底仍然是金、银、铜等贵重金属材料,然而其制作成本高、过程复杂且重复性差,所以出现了一些特殊制备的金属纳米材料,也可以作为拉曼基底,例如,Fe3O4纳米颗粒[5-6]、MnO2纳米薄片[7]和 SiO2纳米粒子[8]等。
目前,葡萄糖的检测方法有很多,例如荧光法[9]、分光光度法[10]、层析法[11]、电分析法[12]等。张玲玲课题组[13]发现TiO2纳米管阵列具有过氧化物酶活性,偶联葡萄糖氧化酶(GOx)可以测定葡萄糖,线性范围为4×10-4~3.6×10-3mol·L-1。王炎课题组[14]制备出具有过氧化物酶活性的二维(2D)Ni基金属-有机骨架(MOF)纳米片,得到了检测人体血清中葡萄糖的纳米传感器。但上述方法存在制备方法复杂、灵敏度不高、检测极限有限等缺点,拉曼光谱法具有检测时间短、灵敏度高、检测限低等优点。经拉曼光谱法得到的信号峰尖锐、特征明显且样品制备过程简单,并且可以在30 s内,较低浓度下获得每个样品显著的SERS信号。
随着纳米技术的发展,纳米酶(也称类酶纳米材料)由于制备过程更容易、成本更低、稳定性更强、催化活性更高,实现了在分析化学、催化和癌症治疗等领域的广泛应用,成为了天然酶的替代品。然而,已报道的纳米酶通常局限于有限种类的酶活性,如类过氧化物酶[15-17]和类超氧化物歧化酶活性[18-20]等。同时具有类过氧化物酶和类葡萄糖氧化酶活性的“串联酶”最早被韩磊的课题组[21]提出,他们将“非裸”的Au NPs定义为“串联酶”。
基于以上原因,我们制备了一种金属氧化物纳米粒子作为拉曼基底实现葡萄糖的微量检测。通过简单的湿化学法合成了Co3O4纳米颗粒(NPs),验证了其类过氧化物酶活性和“串联酶”活性并进行“串联酶”的优化,通过调节反应条件使其达到最佳活性,最后通过拉曼散射光谱分析了葡萄糖的含量。单一Co3O4纳米酶极大地促进了催化过程和产物的生成。
1 实验部分
1.1 试剂
六水氯化钴(CoCl2·6H2O)、硼氢化钠(NaBH4)购自中国上海国药控股化学试剂有限公司。牛血清蛋白(BSA)购自Salarbio(北京)。3,3′,5,5′-四甲基联苯胺(TMB)、过氧化氢(H2O2,30%)、甘氨酸-HCl缓冲液(pH=2.0~3.0)、醋酸钠缓冲液(pH=4.0~5.0)和磷酸盐缓冲液(pH=6.0~7.0)均取自上海阿拉丁生化科技有限公司。所有化学品均未经进一步净化而直接使用。
1.2 仪器
采用扫描电子显微镜(SEM,Hitachi S4800)对样品的形貌尺寸进行表征,其主要技术参数:二次电子成像分辨率为1.0 nm@15 kV、加速电压0.1~30 kV。采用X射线衍射(XRD,Rigaku Ultima Ⅳ)对样品的物相结构进行表征,其主要技术参数:工作电压40 kV、辐射源CuKα靶、波长0.154 nm、扫描范围20°~80°。采用 X 射线光电子能谱(XPS,Thermo Scientific K-Alpha)对样品的物质成分进行表征,其主要技术参数:离子枪能量范围100~4 000 eV、180°双聚集半球分析。采用HORIBA集团生产的拉曼光谱仪(LabRAM HR Evolution)对样品进行SERS分析,其主要技术参数:全波长范围200~2 000 nm、波数范围50~9 000 cm-1、光谱分辨率 1 cm-1,激发光波长为633 nm。
1.3 Co3O4 NPs的合成
采用湿化学法制备了Co3O4NPs。首先,800 μg BSA 与 1 mL CoCl2·6H2O 水溶液(5×10-3mol·L-1)在25 ℃下培养1 h。然后,将1 mL NaBH4(1×10-2mol·L-1)添加到上述混合溶液。在NaBH4还原Co2+的作用下,以BSA为稳定剂形成灰色Co,新生成的Co在空气中自发氧化为稳定的黑色Co3O4[22-23]。放置12 h后,离心,收集BSA模板化的Co3O4NPs,用水洗净,4℃保存。取一定量Co3O4NPs固体颗粒配成浓度为20 mg·L-1的水溶液备用。
1.4 类过氧化物酶活性的测定
Co3O4NPs的类过氧化物酶活性按以下步骤进行:首先,取4个小试管依次加入5 μL Co3O4NPs、10 μL H2O2(30%)、10 μL TMB 和 30 μL NaAc 缓冲液(pH=4.0);10 μL TMB、10 μL H2O2和 30 μL NaAc 缓冲液;5 μL Co3O4NPs、10 μL H2O2和 30 μL NaAc缓冲液;30 μL NaAc缓冲液。上述4种混合溶液在充分反应后,离心,上清液被快速转移到毛细管中,通过SERS进行测量。其次,在含有10 μL TMB的30 μL NaAc缓冲液(pH=4.0)中,加入一系列不同浓度(1~10-9mol·L-1)的 H2O2溶液、5 μL Co3O4NPs和 10 μL TMB,转移到毛细管中后,仍然通过SERS进行测量。采用不同pH值(2.0~7.0)的缓冲溶液研究pH对Co3O4NPs催化活性的影响。在10~80℃之间研究温度对类过氧化物酶活性的影响。
1.5 “串联酶”活性的测定
在小试管中先加入30 μL NaAc缓冲液(pH=4.0),再加入 10 μL TMB、10 μL 不同浓度(10-2~10-10mol·L-1)的葡萄糖溶液和 5 μL Co3O4NPs。让上述混合物在常温(25℃)下充分反应,离心,然后将上清液快速转移到毛细管中,通过SERS进行测量。采用不同pH值(2.0~7.0)的缓冲溶液研究pH对Co3O4NPs催化活性的影响。在10~80℃之间研究温度对“串联酶”活性的影响。
1.6 葡萄糖的检测
对于葡萄糖的定量分析,在小试管中先加入30 μL NaAc缓冲液(pH=4.0),再加入10 μL TMB、10 μL不同浓度(10-2~10-10mol·L-1)的葡萄糖溶液和 5 μL Co3O4NPs。让上述混合物在常温(25℃)下充分反应,离心,然后将上清液快速转移到毛细管中,通过SERS进行测量。然后通过线性拟合绘制校准曲线。另外验证了其他糖对葡萄糖检测的干扰:准备5个小试管,先加入30 μL NaAc缓冲液(pH=4.0),再分别加入10 μL浓度为10-2mol·L-1的葡萄糖、蔗糖、半乳糖、木糖、麦芽糖和 10 μL TMB、5 μL Co3O4NPs,通过SERS进行测量。
2 结果与讨论
2.1 Co3O4 NPs的表征
通过SEM观察Co3O4NPs的形态(图1a、1b)。如图1所示,所制备的Co3O4NPs接近块状并且高度分散。为了进一步研究Co3O4NPs的化学组成,通过EDS光谱检测Co3O4NPs。图1c显示该材料由Co、O两种元素组成。图1d为Co3O4NPs的XRD图,由图可知,除了在24°归属于基底碳布的较强峰外,各衍射峰的位置与 Co3O4立方晶系的(111)、(220)、(311)、(400)、(511)、(440)晶面相对应,与 Co3O4的标准图(PDF No.42-1467)相吻合,图中少量杂峰的出现说明合成的材料纯度较高。利用XPS表征了Co3O4纳米颗粒的表面组成,图1e的全谱图也表明Co、O元素的存在,图1f、1g分别为O1s和Co2p的高分辨XPS谱图,其中Co2p谱图中的2个主峰794.9和779.8 eV分别对应Co3O4的Co2p1/2和Co2p3/2自旋轨道峰[24]。以上结果说明Co3O4NPs被成功制备。

图1 Co3O4 NPs的SEM图 (a、b)、EDS谱图 (c)、XRD图 (d)和XPS谱图 (e~g)Fig.1 SEM images(a,b),EDS spectrum(c),XRD pattern(d)and XPS spectra(e~g)of Co3O4 NPs
2.2 Co3O4 NPs的类过氧化物酶活性
为了验证Co3O4NPs的类过氧化物酶活性,我们构建了一个NPs-H2O2-TMB反应体系,该体系以H2O2、NaAc缓冲液和TMB为底物进行催化反应。在H2O2存在的条件下,Co3O4NPs能够催化TMB氧化生成蓝色产物氧化TMB(oxTMB)。如图2a所示,仅NPs-H2O2-TMB反应体系的溶液颜色变成蓝色,而对照组未发生颜色反应,说明仅在NPs-H2O2-TMB反应体系中才能产生大量的oxTMB,使得溶液变色。图2b中在1 188、1 330和1 610 cm-1处均检测到明显的SERS信号,这是由oxTMB引起的。其中,SERS信号中1 188 cm-1处拉曼峰对应于CH3的弯曲振动峰,1 330 cm-1处拉曼峰对应于苯环内的C—C伸缩振动峰,1 610 cm-1处拉曼峰对应于苯环的伸缩缝和C—H伸缩振动峰[25]。因此,这3个拉曼峰均可用于NPs-H2O2-TMB反应体系的分析。通过4种不同反应体系的SERS光谱可知,曲线Ⅰ和Ⅱ上有较强的拉曼峰,曲线Ⅲ和Ⅳ上有微弱的峰或无峰,说明真正参与反应的是TMB和H2O2;曲线Ⅰ上oxTMB的拉曼峰比曲线Ⅱ的强,说明是Co3O4NPs起催化作用;曲线Ⅲ上有微弱的拉曼峰,说明TMB在空气中有一部分发生自然氧化;曲线Ⅳ上无拉曼峰,说明NaAc起的是缓冲液的作用。因此在反应体系中的催化反应是由TMB、H2O2和Co3O4NPs的共催化作用引起。综上证明了Co3O4NPs具有类过氧化物酶活性。
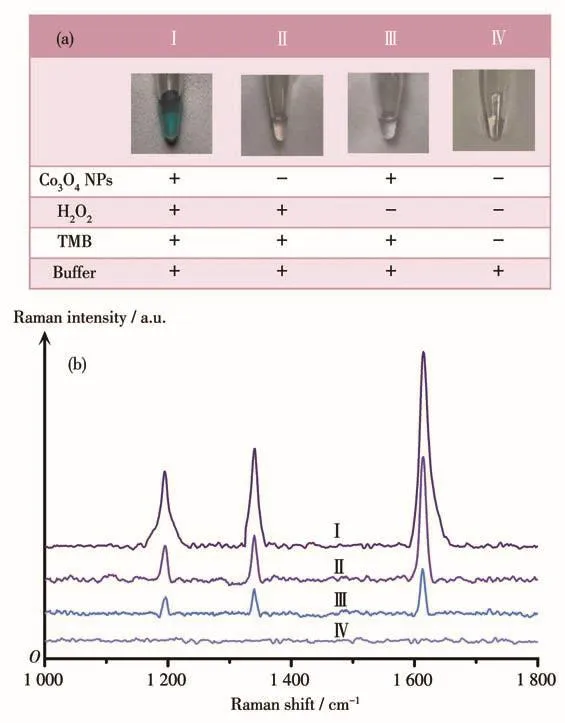
图2 (a)不同反应体系的颜色照片和(b)不同反应体系的SERS光谱Fig.2 (a)Visual photograph and(b)SERS spectra of different reaction systems
在NPs-H2O2-TMB反应体系引入一系列浓度梯度(1~10-9mol·L-1)的H2O2溶液。如图3所示,H2O2的浓度越高,oxTMB的3个特征峰的SERS信号越强。当H2O2浓度低至10-9mol·L-1时仍然有明显的SERS信号,这表明了Co3O4NPs具有良好的类过氧化物酶活性。目前,基于这一反应体系的检测方法有很多,例如紫外分光光度法[26],但待检测物在较低浓度(1×10-6mol·L-1)下没有明显的吸收峰,而拉曼光谱法具有更高的灵敏度以及检测限低的优点。
2.3 Co3O4 NPs的“串联酶”活性
为了验证Co3O4NPs的“串联酶”活性,我们构建了一个NPs-葡萄糖-TMB的反应体系,该体系是由Co3O4NPs、葡萄糖、NaAc缓冲液和TMB组成。整个反应过程包括2个步骤:
首先,Co3O4NPs催化葡萄糖与空气中的O2生成葡萄糖酸和H2O2,如式(1)所示:

其次,Co3O4NPs催化H2O2和TMB生成H2O和oxTMB,如式(2)所示。

我们研究发现Co3O4NPs在第一步中表现出类葡萄糖氧化酶的活性,在第二步中表现出类过氧化物酶的活性,且在第一步中产生的H2O2可以引发第二步的类过氧化物酶活性的催化反应。与以往的葡萄糖分析方法相比,这个反应体系不添加H2O2就可以促进检测过程。如图4所示,在不存在H2O2的反应体系中,仍然可以在1 188、1 330和1 610 cm-1处检测到oxTMB的SERS信号。在Co3O4NPs催化作用下,由于葡萄糖浓度的增加,可以生成大量的H2O2进而促进TMB的氧化,所以oxTMB的3个特征峰的强度逐渐增大,由此可以证明Co3O4NPs具有“串联酶”活性,而且当葡萄糖浓度低至10-10mol·L-1时也存在明显的SERS信号,这表明了Co3O4NPs具有良好的“串联酶”活性[21]。

图4 在NPs-葡萄糖-TMB体系中不同浓度的葡萄糖对oxTMB的SERS光谱的影响Fig.4 Effect of different concentrations of glucose on the SERS spectra of oxTMB in NPs-glucose-TMB system
2.4 纳米酶活性的优化
众所周知,纳米酶已经逐渐成为替代天然酶的热门材料。但纳米酶的活性仍然受pH和温度的影响。因此,为了进一步优化Co3O4NPs的类过氧化物酶和“串联酶”活性,我们分别研究了实验条件变化对Co3O4NPs“串联酶”活性的影响。首先,优化实验中的pH。图5a是不同pH值(2.0~7.0)下NPs-H2O2-TMB体系的SERS信号强度,图中最高点对应最佳pH值时的拉曼强度,其对应样品的相对活性为100%。通过对比发现,随着pH值的增加,SERS强度在pH=2.0~4.0的范围内增加,然后在pH=4.0~7.0的范围内降低。值得注意的是,对于类过氧化物酶活性,基于NPs-H2O2-TMB体系的Co3O4NPs在pH=4.0的条件下显示出最高的类过氧化物酶活性(图5b),但在pH=3.8~4.5时仍保持90%的活性。而对于“串联酶”活性,在pH=4.0的NaAc缓冲液中,基于NPs-葡萄糖-TMB体系,pH=4.0时Co3O4NPs显示出最高的“串联酶”活性。综上可知,Co3O4NPs的类过氧化物酶和“串联酶”活性的最佳pH值一致。

图5 纳米酶活性的pH优化:NPs-H2O2-TMB体系中(a)不同pH值下类过氧化物酶活性的SERS光谱和(b)Co3O4 NPs在不同pH值下类过氧化物酶活性的相对强度;NPs-葡萄糖-TMB体系中(c)不同pH值下“串联酶”活性的SERS光谱和(d)Co3O4 NPs在不同pH值下“串联酶”活性的相对强度Fig.5 pH optimization of nano-enzyme activity:(a)SERS spectra of peroxidase-like activity at different pH values and(b)relative strength of peroxidase-like activity of Co3O4 NPs at different pH values in NPs-H2O2-TMB system;(c)SERS spectra of“tandem enzyme”activity at different pH values and(d)relative strength of“tandem enzyme”activity at different pH values in the NPs-glucose-TMB system
其次,研究了不同温度(10~80℃)下Co3O4NPs的活性。对于类过氧化物酶活性,基于NPs-H2O2-TMB体系,当温度为60℃时显示出最高的类过氧化物酶活性(图6a、6b)。对于“串联酶”活性,基于NPs-葡萄糖-TMB体系,在pH=4.0的NaAc缓冲液中,当温度为60℃时显示出最高的“串联酶”活性(图6c、6d)。类过氧化物酶和“串联酶”活性在10~60℃的温度范围内升高,而在60℃以上时降低。与类过氧化物酶活性不同的是,“串联酶”在50~65℃范围内可以保持80%的活性。根据以上结果可知,Co3O4NPs的类过氧化物酶和“串联酶”活性的最佳温度一致。

图6 纳米酶活性的温度优化:NPs-H2O2-TMB体系中(a)在不同温度下类过氧化物酶活性的SERS光谱和(b)不同温度下Co3O4 NPs类过氧化物酶活性的相对强度;NPs-葡萄糖-TMB体系中(c)在不同温度下“串联酶”活性的SERS光谱和(d)不同温度下Co3O4 NPs“串联酶”活性的相对强度Fig.6 Temperature optimization of nano-enzyme activity:(a)SERS spectra of peroxidase-like activity at different temperatures and(b)relative strength of peroxidase-like activity of Co3O4 NPs at different temperatures in NPs-H2O2-TMB system;(c)SERS spectra of“tandem enzyme”activity at different temperatures and(d)relative intensity of“tandem enzyme”activity at different temperatures in the NPs-glucose-TMB system
2.5 葡萄糖的检测
基于Co3O4NPs的“串联酶”活性,我们提出了一种新的应用于葡萄糖检测的SERS策略。在NPs-葡萄糖-TMB的体系中进行Co3O4NPs与不同浓度葡萄糖的催化反应。插图为NPs-葡萄糖-TMB的体系中含有不同浓度(10-2~10-10mol·L-1)葡萄糖的溶液,可以明显地观察到反应溶液的颜色呈现从深到浅的规则变化。将图7a中的3条线进行线性拟合得到图7b~7d,对比发现图7b中1 610 cm-1的SERS强度与葡萄糖浓度具有最佳的线性关系,其回归方程为y=398.28x+3 969(R2=0.990 4),线性范围为 10-10~10-2mol·L-1,检测限(LOD)为 10-10mol·L-1。由此,证明了该方法的可行性。此外,基于Co3O4纳米颗粒“串联酶”活性检测葡萄糖的SERS策略所用的响应时间为30 s,而已报道的基于金纳米颗粒的无酶分析方法[25]的响应时间要在7 h以上,显然,我们的检测方法所用的响应时间更短,这表明Co3O4NPs有成为一种新的葡萄糖传感器的巨大潜力。

图7 (a)oxTMB的SERS强度随葡萄糖浓度变化折线图,插图显示了葡萄糖浓度从高到低时的反应产物oxTMB的视觉效果图;(b)1 610 cm-1的特征峰处葡萄糖检测的校正曲线;(c)1 330 cm-1的特征峰处葡萄糖检测的校正曲线;(d)1 188 cm-1的特征峰处葡萄糖检测的校正曲线Fig.7 (a)Broken line graph of SERS intensity of oxTMB changing with glucose concentrations,the inset shows a visual rendering of the reaction product oxTMB changing with glucose concentrations from high to low;(b)Calibration curve for glucose detection at 1 610 cm-1;(c)Calibration curve for glucose detection at 1 330 cm-1;(d)Calibration curve for glucose detection at 1 188 cm-1
另外,我们验证了其他糖对葡萄糖的干扰。如图8所示,与存在葡萄糖的反应体系中的SERS信号强度相比,存在蔗糖、半乳糖、木糖或麦芽糖的反应体系中的SERS信号强度较小,说明此方法具有良好的选择性。

图8 相同浓度葡萄糖、蔗糖、半乳糖、木糖、麦芽糖在不同反应体系中oxTMB的SERS光谱Fig.8 SERS spectra of oxTMB in the different reaction systems with the same concentration of glucose,sucrose,galactose,xylose and maltose
3 结 论
综上所述,我们利用BSA作为生物模板,采用湿化学法合成了Co3O4NPs。制备的Co3O4NPs既具有类过氧化物酶活性,又具有“串联酶”活性(类过氧化物酶和类葡萄糖氧化酶活性)。而且在相同的pH和温度范围内,Co3O4NPs显示出最佳的串联酶活性。在此基础上,利用Co3O4NPs的“串联酶”活性,结合SERS光谱,提出了一种检测葡萄糖的新策略。这一方法具有灵敏度高、检测极限低、准确度高和对真实样品分析的可靠性好等特点,不仅为BSA定向合成金属纳米材料(Co3O4NPs)提供了新的途径,更拓宽了纳米酶的种类,而且还可以促进纳米酶与抗原、抗体、荧光探针等分子的功能化,在免疫检测、生物传感器、医疗等领域具有广阔的应用前景。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Synthesis and Characterization of Metal-Organic Framework Based on 2,6-Bis(4-carboxybenzylidene)cyclohexanone
- Two Metal-Organic Frameworks Built from 2,2′-Dimethyl-4,4′-biphenyldicarboxylic Acid
- Three Photochromic Co-crystals Based on Viologen Moiety
- Effect of Mass Ratio of Ni and Co in Initial Solution on Oxygen Evolution Reaction Performance of Ni-Co-S-O/NF Catalyst in Alkaline Water Electrolysis
- Structure and Fluorescence Properties of Three 1D/2D/3D Zn/Cocomplexes Based on Flexible Tetracarboxylic Acid
- Two Nitronyl Nitroxide Biradical-Bridged Lanthanide One-Dimensional Chains:Crystal Structure,Magnetic Properties and Luminescent Behavior
