循经取穴电针对心肌缺血大鼠血管紧张素原基因表达的影响
2021-05-15萨喆燕朱小香潘晓华兰彩莲许金森
萨喆燕,朱小香,万 隆,潘晓华,兰彩莲,许金森
(福建省中医药科学院,福建省经络感传重点实验室,福建福州350003)
《中国心血管病报告2018》数据显示,目前我国冠心病的防治形势相当严峻,约有冠心病患者1 100万,且患病率不断上升[1]。冠心病是一种复杂的“广谱性”疾病,症状可表现为无症状性冠状动脉粥样硬化病变到心脏性猝死不等[2],发病机制主要为冠状动脉粥样硬化引起血管腔痉挛或狭窄,导致心肌缺血缺氧坏死。中医针灸治疗冠心病具有悠久的历史,现代临床实践也证明针刺能明显改善冠心病患者血脂、血压、心率等指标,减少冠状动脉斑块的形成[3];循经取穴针刺还可显著减少病患心绞痛发作次数,减轻心绞痛发作程度,改善冠心病患者的生活质量[4]。虽然针刺治疗冠心病改善心肌缺血的疗效明确,但其机制仍有待进一步明晰。
研究发现肾素-血管紧张素系统(renin-angioten‐sin system,RAS)在冠心病发生发展过程中扮演了重要角色[5]。RAS 成员主要包括血管紧张素原(angio‐tensinogen,AGT)、肾素(renin,Ren)、血管紧张素转换酶(angiotensin converting enzyme,Ace)、血管紧张素(angiotensin,Ang)及血管紧张素受体等[6]。AGT作为RAS 的唯一前体物质,不仅与冠心病发病风险密切相关,也是影响冠心病进程的重要因子[7]。目前,有关针刺治疗心肌缺血过程中心肌组织AGT 的变化鲜有报道。本研究以心肌缺血大鼠为模型,观察循经取穴电针对大鼠心肌缺血的改善程度及对AGT 基因表达的影响,探讨针刺改善心肌缺血的可能机制。
1 材料与方法
1.1 实验动物
8周龄SD 雄性大鼠28只,清洁级,体质量(250±20)g,由福建省中医药科学院提供,实验动物许可证号:SCXK(闽)2012-0001。实验操作均严格按照国家科学技术委员会颁布的《实验动物管理条例》规定进行。
1.2 主要试剂与仪器
异丙肾上腺素(isoproterenol,ISO)、Trizol Re‐agent(美国Sigma 公司),荧光定量PCR 试剂盒(日本TakaRa 公司),引物设计与合成(上海康成生物工程有限公司);小动物呼吸麻醉机(深圳瑞沃德公司,型号:R407),多导生理记录仪(澳大利亚埃德公司,型号:Powerlab 8/30),-80 ℃超低温冰箱(海尔公司,型号:DW-86L626),高速冷冻离心机(美国贝克曼公司,型号:Allegra 64R),实时荧光定量PCR 仪(美国ABI公司,型号:7500)。
1.3 实验方法与分组
28只SD 大鼠随机分成4组,即生理盐水对照组、模型组、电针内关穴组、电针非经非穴组,每组各7只。连接小动物呼吸麻醉机,大鼠通过呼吸面罩持续吸入异氟烷麻醉,用多导生理记录仪采集动态大鼠心电图。模型组、电针内关穴组和电针非经非穴组大鼠注射ISO 造成心肌缺血,具体方法:大鼠仰卧位固定,分别在四肢内侧根部及背部皮下注射ISO(85 mg/kg),共注射2 次,前后间隔24 h。当心电图出现ST 段抬高,T 波由正向变为负向或出现M 波时确认造模成功。对照组大鼠在四肢内侧根部及背部皮下注射生理盐水(85 mg/kg),共注射2次,前后间隔24 h。
1.4 针刺与选穴
参考李忠仁的《实验针灸学》,内关穴定位于大鼠左前肢内侧,离腕关节约3 mm 尺桡骨缝间[8]。非经非穴选取大鼠左侧臀大肌外上象限内无穴位和经络处[9]。针刺方法:选用0.25 mm×13 mm 无菌毫针,直刺0.1 cm,并连至SDZ-Ⅱ华佗牌电针仪。电针参数:疏密波,频率2/10 Hz,强度以针体轻微抖动为度,连续电针20 min。于第二次注射ISO 后24 h 开始电针,每天1 次,连续5 d。模型组和对照组均不予电针,仅每天同等条件抓取1次。
1.5 观察指标及检测方法
1.5.1 心指数检测 最后一次电针前称取大鼠体质量。最后一次电针后处死大鼠,迅速取出心脏,4 ℃预冷生理盐水洗净残血,吸干水分,电子天平称取全心质量,心指数(%)=全心质量/大鼠体质量×100%。
1.5.2 病理学切片检测 切取大鼠左心室,常规固定、脱水、透明、石蜡包埋、切片,行HE 染色,光镜下观察心肌细胞病理改变。
1.5.3 基因芯片检测心肌RAS 相关基因 大鼠处死后立即采集新鲜左心室组织,保存于-80 ℃超低温冰箱。模型组和电针内关穴组各随机选取3 个样品,由上海康成生物工程有限公司进行基因芯片检测。芯片为大鼠LncRNA v2.0 芯片,可同时检测LncRNAs 和mRNA。步骤:Trizol 法提取心肌组织总RNA,分光光度计测定RNA 浓度和纯度;1% 变性琼脂糖凝胶电泳,紫外透射光下检测RNA 完整性;从总RNA 中得到mRNA,转录成含荧光标记的cRNA;将标记好的cRNAs 进行芯片杂交、洗涤、固定;扫描芯片,通过软件得到探针信号值,进行数据分析。经过归一化处理和分析,得到模型组和电针内关穴组标记RAS 相关基因的差异倍数,经过t 检验,按照倍数≥1.5,P<0.05 的标准进行筛选。对差异表达的mRNA 进行基因本体GO 分析,寻找AGT 参与的表达异常的mRNA 相关的生物学过程。
1.5.4 实时荧光定量PCR(RT-PCR)检测心肌组织AGT mRNA 表达 干预结束后处死大鼠,分别取生理盐水对照组、模型组、电针内关穴组、电针非经非穴组等4 组大鼠左心室组织,-80 ℃保存。主要步骤:Trizol 法提取心肌组织总RNA,经逆转录酶将RNA 反转录成cDNA,RT-PCR 技术检测各组心肌组织AGT mRNA 的相对表达水平,引物见表1。AGT mRNA 相对表达水平的计算通过标准曲线法获得,GAPDH 为内参,生理盐水对照组为1。

表1 RT-PCR 引物序列Tab 1 RT-PCR primer sequences
1.6 统计学处理
2 结果
2.1 各组大鼠心指数变化
与生理盐水对照组比较,模型组大鼠体质量显著减轻,心指数显著增加,差异有统计学意义(P 均<0.01);与模型组比较,电针内关穴组大鼠体质量明显增加,心指数明显降低,差异有统计学意义(P<0.01,P<0.05);电针非经非穴组大鼠体质量、心指数与模型组比较无明显变化,而较电针内关穴组差异显著,差异有统计学意义(P均<0.01)。见表2。
2.2 各组大鼠HE 染色比较
光镜下可见生理盐水对照组大鼠心肌细胞结构完整,排列整齐,无明显炎性细胞浸润;模型组和电针非经非穴组大鼠心肌组织中均可见心肌纤维大量坏死溶解,被增生的结缔组织替代(图1黑色箭头),伴有淋巴细胞浸润;电针内关穴组大鼠心肌细胞间隙增宽,也可见少量结缔组织增生,但其病灶范围明显小于模型组和电针非经非穴组。见图1。
表2 各组大鼠体质量和心指数比较(±s)Tab 2 Comparison of weight and heart index(±s)

表2 各组大鼠体质量和心指数比较(±s)Tab 2 Comparison of weight and heart index(±s)
心指数(%)0.28±0.01 0.37±0.01**0.32±0.02#0.40±0.02△△15.921<0.001组别生理盐水对照组模型组电针内关穴组电针非经非穴组n 7 7 7 7 FP体质量(mg)294.86±3.45 274.64±2.36**286.36±2.52##268.36±2.50△△18.644<0.001
2.3 基因芯片检测RAS 相关基因的变化
芯片信号经过归一化处理,并根据不同样品间RAS相关基因mRNA 表达水平的不同进行分层聚类分析,表达程度越相似的样品更容易聚类在一起,且颜色越接近红色代表表达水平越高,颜色越接近绿色代表表达水平越低。见图2。结果显示心肌AGT 基因在组间表达趋势最为一致,差异也最为显著,即在模型组各大鼠心肌组织中均高表达,在电针内关穴组各大鼠心肌组织中表达均下调,下调倍数为2.16,且P<0.05;其余各基因表达变化不一致,差异不显著,变化倍数小于1.5。见表3。
2.4 GO 分析
GO 分析显示差异表达的mRNA 参与的生物过程,图3、表4 列出AGT 参与的富集分数最高的前10条生物过程。
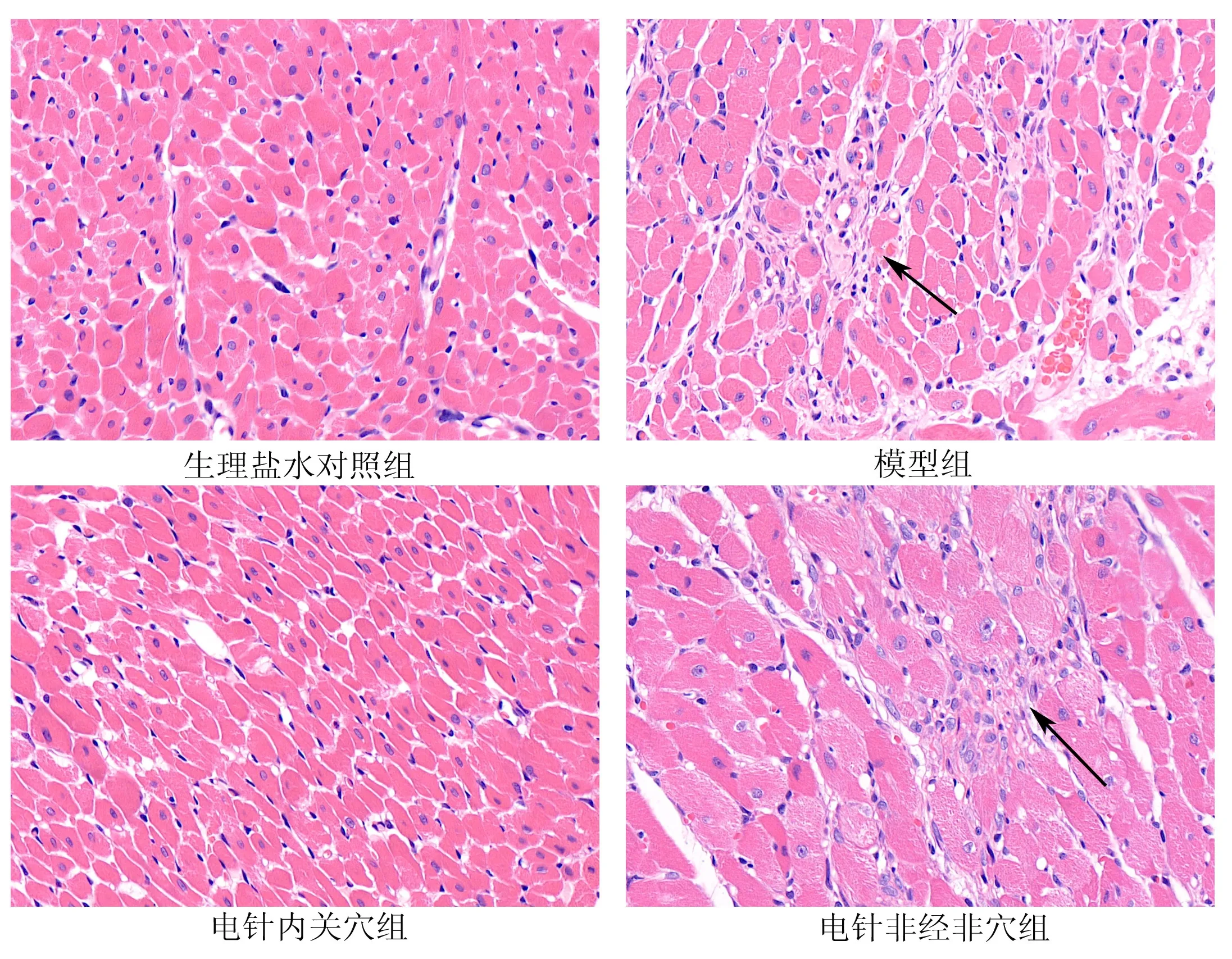
图1 各组大鼠心肌组织形态学变化(×400)Fig 1 Morphological changes of myocardial tissue(×400)
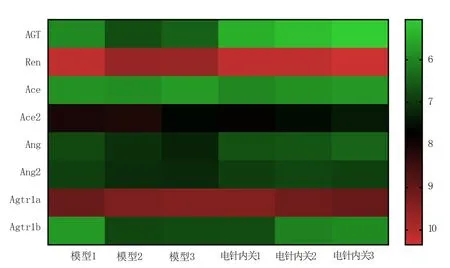
图2 电针内关组和模型组RAS 相关基因表达的聚类热图Fig 2 Clustering heat map of RAS-related gene expression between the EA group and the model group
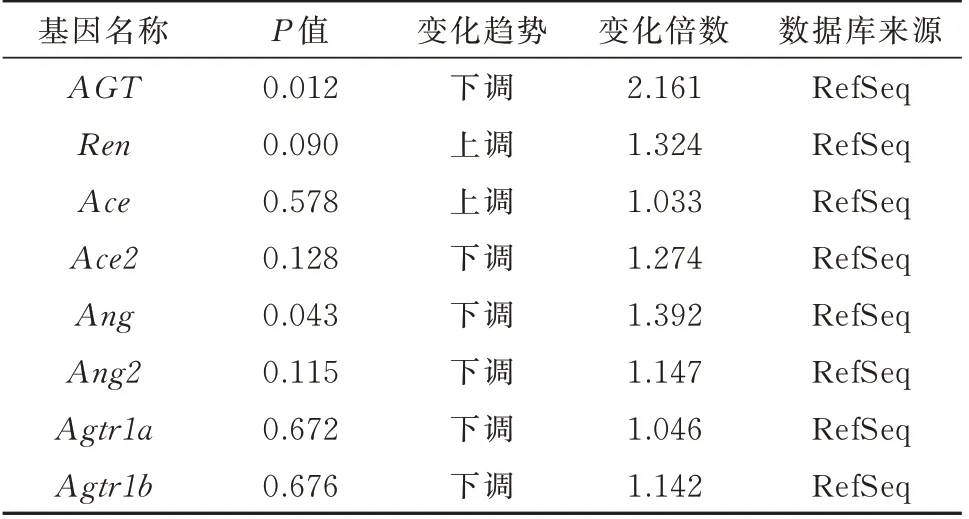
表3 基因芯片检测RAS 相关基因的变化倍数(电针内关穴组vs 模型组)Tab 3 Change of RAS-related genes detected by gene chip(the EA group vs the model group)
2.5 心肌组织AGT mRNA 表达比较
与生理盐水对照组相比,模型组大鼠心肌组织AGT mRNA 相对表达量显著增加,差异有统计学意义(P<0.01);与模型组相较,电针内关穴组大鼠心肌组织AGT mRNA 表达量显著降低,差异有统计学意义(P<0.01);电针非经非穴组大鼠心肌组织AGT mRNA 表达量与模型组相较无差异,而与电针内关穴组相较,则显著升高,差异有统计学意义(P<0.01)。结果见表5。
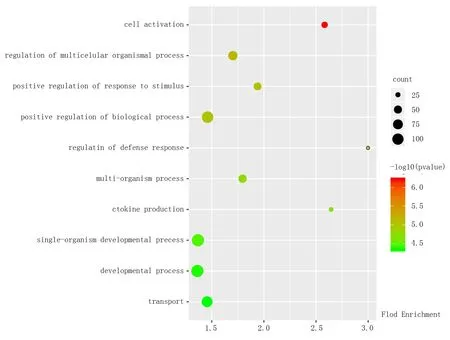
图3 AGT 参与的通路富集分析Fig 3 Enrichment analysis of pathway

表4 AGT 参与相关生物过程GO 条目Tab 4 GO analysis result of biological process
表5 各组大鼠心肌组织AGT mRNA 相对表达量比较(±s)Tab 5 Comparison of relative expression levels of AGT mRNA in myocardial tissue(±s)
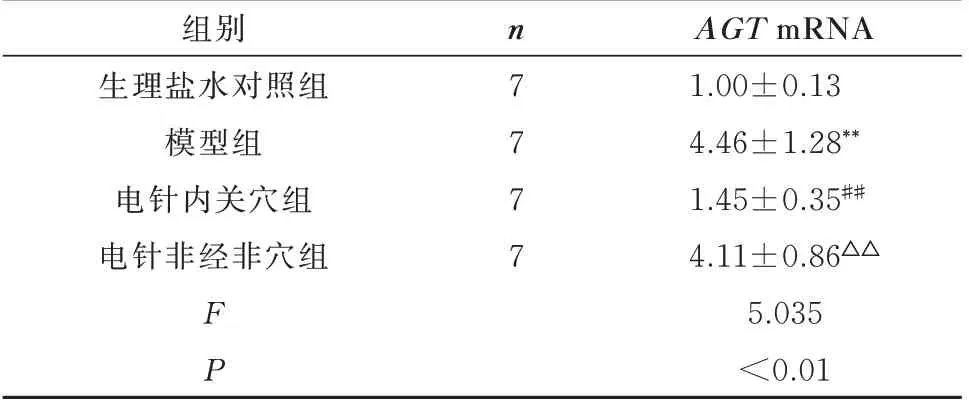
表5 各组大鼠心肌组织AGT mRNA 相对表达量比较(±s)Tab 5 Comparison of relative expression levels of AGT mRNA in myocardial tissue(±s)
AGT mRNA 1.00±0.13 4.46±1.28**1.45±0.35##4.11±0.86△△5.035<0.01组别生理盐水对照组模型组电针内关穴组电针非经非穴组n 7 7 7 7 FP
3 讨论
本实验使用皮下注射ISO 制备心肌缺血大鼠模型。ISO 是一种强β 肾上腺素能受体激动剂,可通过增快心率、增强心肌收缩力,从而加大心肌耗氧量、增大心脏负荷,最终导致心肌缺血缺氧坏死[10]。由于ISO 导致的心脏负荷增加以及血液供应和组织需氧量之间的失衡是心肌缺血坏死进程中的重要因素,且从组织结构角度很难将其与冠状动脉狭窄引起的局部缺血区分开来,因此ISO 诱导的心肌缺血模型常作为心肌缺血动物模型[11]。本实验结果显示,ISO 注射后模型大鼠体重明显减轻,心指数显著增加;病理组织可见心肌纤维大量坏死溶解,坏死组织被大量增生的结缔组织代替,这提示ISO 注射成功诱导了心肌缺血,心肌缺血大鼠模型建立成功。
ISO 诱导的心肌缺血损伤与其激活RAS有关[11]。RAS作为机体关键的内分泌系统,不仅存在于循环系统之中,还存在于心、肾、脑等多个组织器官中,主要通过调节血压和电解质平衡发挥重要生理、病理功能[12-14]。在经典RAS 中,肾素催化AGT 形成血管紧张素Ⅰ,随后通过血管紧张素转化酶将其转化为血管紧张素Ⅱ。本实验结果发现,在缺血心肌组织中AGT、肾素、血管紧张素转化酶、血管紧张素等RAS相关基因均有表达,且电针内关穴组与模型组间表达有差异。变化趋势、差异倍数和显著性分析结果均表明AGT 基因差异表达最为显著。
AGT 作为RAS 的唯一前体物质,通常被认为是被动的RAS 底物,但随着研究的深入,更多证据表明AGT 具有调节肾脏功能、影响血管生成、脂肪扩张等生物学特性[15,16]。本实验通过GO 分析也发现,差异表达AGT 参与了多个生物过程,主要包括细胞活化、多细胞生物过程的调控、应激的调控、防御反应的调控、细胞因子的生成等信号通路,由此可见AGT 的调控与功能的复杂性。
针灸疗效产生的关键在于其作用于特定经络、特定腧穴产生的特定效应[17]。本实验遵循“经脉所过,主治所及”,循经选择心包经内关穴治疗心肌缺血。结果发现,模型组与电针非经非穴组比较,大鼠心指数、病理结构无明显区别,而电针内关穴组大鼠心指数较模型组、电针非经非穴组均明显降低,其缺血坏死病灶范围也明显缩小,提示循经取穴电针改善了大鼠心肌缺血程度。同时,心肌缺血大鼠心肌AGT mRNA 表达量显著增加;电针内关穴可降低心肌缺血大鼠心肌AGT mRNA 表达水平;而电针非经非穴对心肌AGT mRNA 表达水平无显著影响。
有研究表明AGT 是影响冠心病进程的重要因子[7]。AGT 基因多态性可增加冠心病的患病率,影响急性心肌梗死患者的死亡率和生存预后[18-20]。AGT还与心肌组织纤维化相关。心肌AGT 表达增强,可活化RAS,促进成纤维细胞生长因子在心肌细胞和成纤维细胞表达,导致心肌纤维化[21];血管活性肠肽物质可通过影响RAS 中AGT 和血管紧张素受体AT1a的表达,改善心肌纤维化的程度[22]。结合本实验结果,循经取穴电针可能通过抑制心肌AGT mRNA 的表达,减轻心肌纤维化,进而改善心肌缺血状态。当然,由于针刺干预机制复杂多样,非单一因素决定,因此电针改善心肌缺血的机制仍有待进一步深入。
