哮喘中miR-29b、B7-H3 调控巨噬细胞极化影响CD4+T 细胞分化的作用及机制研究
2021-05-15王月月陈正荣顾文婧
王月月,季 伟,陈正荣,顾文婧
(苏州大学附属儿童医院,江苏苏州 215003)
支气管哮喘是一种复杂的慢性炎症性疾病,以气道炎症、可逆性气流受限和气道高反应性为主要特征,是儿童中最常见的非传染性疾病。2018 年世界卫生组织(WHO)的概况介绍显示,在世界人口中,约有2.35 亿人患有哮喘,作为一个全球公共卫生问题,因其诊断及治疗不足,给个人和家庭带来了沉重负担[1]。从发病机制水平阐明哮喘的发病原因,外部干预从而改善哮喘症状,甚至根治哮喘是当今医学的一大重任。
至今报道的文献中涉及哮喘发病机制众多,与免疫、神经、精神、内分泌等密切相关,但发病机制仍无确切定论,目前比较认可的为免疫方面学说。经典免疫学说认为Th1 细胞与Th2 细胞的比例失衡是哮喘发病的原因[2]。因此,纠正哮喘患者体内的Th 细胞比例失衡可能是哮喘免疫治疗的关键。
T 细胞的活化需要双信号[3]。第一信号为抗原提呈细胞(APC)处理后的MHC-抗原肽复合物,第二信号为抗原提呈细胞表面的共刺激分子。巨噬细胞是先天性的免疫细胞,通过识别,响应和破坏入侵的微生物,抗原呈递,清除细胞碎片来维持组织和免疫稳态,以及产生炎症调节产物,在T 细胞分化中发挥作用[4,5]。巨噬细胞自身的极化同样影响T 细 胞 的 分 化[6]。B7‐H3 作 为 共 刺 激 分 子 的 一员,可以通过调节Th 细胞型炎症因子影响T 细胞的分化[7,8]。近年来有研究报道称,微小RNA 可以在转录后调控基因的表达,在调节气道炎症方面发挥重要作用[9,10]。有文献报道哮喘的产生与某些miRNA 的异常表达相关,在OVA 诱导的过敏性哮喘的小鼠模型中发现,多种miRNA 在肺组织中存在明显的改变[10],提示miRNA 参与气道炎症调节。
T 细胞的分化主要由APC 的种类及APC 表面的共刺激分子决定。笔者猜想可以通过调节巨噬细胞表达的共刺激分子B7‐H3 及相关微小RNA 观察巨噬细胞对T 细胞分化的影响。因此从B7‐H3入手,寻找调节巨噬细胞属性的miRNA。由于巨噬细胞来源于单核细胞,笔者采集了哮喘患儿及外科手术正常儿童外周血,分离外周血单个核细胞,采用基因芯片技术筛选相关的miRNAs,由于在哮喘患者中miR-29b 个体差异较小,哮喘组与对照组的差异倍数大,所以选择了这个miR-29b 作为研究基因。通过调节巨噬细胞B7‐H3、miR-29b 的表达观察其对CD4+T 细胞分化的影响。
1 资料与方法
1.1 一般资料
选取2018 年5 月~2019 年4 月在苏州大学附属儿童医院门诊就诊并符合哮喘诊断的患儿48 例,其中有25 例的患儿处于哮喘的急性发作期;23 例患儿处于哮喘非急性发作期,门诊就诊时抽取外周血。选取与哮喘患者就诊时间相当的外科患儿(住院目的主要为择期手术:包括疝气修补手术、包皮切除手术)15 例作为对照组,术前抽取外周血。对照组患儿及家族成员无过敏性疾病史,近1 个月无感染史无用药史。上述研究得到苏州大学附属儿童医院伦理委员会批准同意(伦理号:2020CS039),患儿家属同意抽血检查。
1.2 纳入标准与排除标准
哮喘的诊断标准参照儿童支气管哮喘诊断与防治指南(2016 年版)[11]。
1.3 实验方法
人外周血单个核细胞及CD4+T 细胞的分离参照说明书操作。
THP-1 细胞用PMA 试剂诱导分化为单核巨噬细胞:THP-1 细胞培养液中加入浓度50 ng/mL 的PMA 培养6 h,换无PMA 完全培养基继续培养24 h。
miR-29b 上、下调对巨噬细胞功能的影响:接种THP-1 细胞,加终浓度为50 ng/mL 的PMA 培养6 h后,换无PMA 完全培养基继续培养24 h,然后用LV526、LV527 和NC 病毒侵染诱导成功的巨噬细胞,24 h 收集样品进行Q-PCR 检测,分析miR-29b上、下调对巨噬细胞功能的影响。
细胞共培养:6 孔板中准备贴壁单核巨噬细胞5×105个/孔,按巨噬细胞与CD4+T 细胞1︰10 比例,准备0.4 µm 孔径的6 孔板transwell 小室,上室加入含5×106个CD4+T 细胞的培养液1 mL;贴壁培养巨噬细胞的6 孔板为下室,换液加培养液2 mL;共培养3 d。然后收集CD4+T 细胞检测转录因子的表达。
细胞共培养分组:组1:启动活化的CD4+T 细胞,(用PMA(20 ng/mL)+Ionomycin(1 µg/mL)在37℃下处理细胞1 h;组2:KD-miR-29b 的巨噬细胞(下调miR-29b 的巨噬细胞)与启动活化的CD4+T细胞共培养;组3:NC-巨噬细胞(空载病毒的巨噬细胞)与启动活化的CD4+T 细胞共培养。
验证STAT3 为miR-29b 的靶基因:接种THP-1 细胞,加终浓度为50 ng/mL 的PMA 培养6 h 后,换无PMA 完全培养基继续培养24 h,然后用LV528、LV529 和NC 病毒侵染诱导成功的巨噬细胞形成miR-29b 干扰、miR-29b 过表达以及正常对照组,48 h 进行荧光素酶分析来验证STAT3 为miR-29b 的靶基因。构建STAT3-3′-UTR 荧光素酶报告基因质粒,并分为3 组“miR-29b+STAT3-3′-UTR”、“miR-29b + STAT3-mut-3′-UTR”、“miR-29b+ 荧光素酶空载”。
逆转录及定量Q-PCR 参照说明书操作,引物序列见表1。
1.3.1 Western blot 步骤 取样品采用BCA 法测浓度,上样40 µg,聚丙烯酰胺凝胶先90 V 跑完积层胶,再将电压升至200 V 直到电泳结束。取下凝胶进行转膜,恒压100 V转膜,约为1.5 h,恒流250 mA. 电转结束后,取下膜后先用PBST 洗涤4 次,每次5 min。将膜置于5%脱脂奶粉封闭液中封闭37℃1 h。用封闭液稀释一抗,膜在一抗稀释液中4℃过夜。次日将膜取出后用PBST 洗膜4 次,每次5 min,用含5%牛奶的封闭液稀释二抗。膜在二抗中37℃反应1 h。反应完毕后,把膜取出后置于干净的盒子中洗膜4次,每次5 min。ECL 显影,曝光。
1.3.2 主要试剂及设备 材料:THP-1 细胞(诺百生物)、人外周血淋巴细胞(苏州市血站健康捐献者)。
细胞培养及分离所需试剂:FBS(美国Hyclone公司)、1640 培养基(Gibco 公司)、PMA(碧云天)、Ficoll 人血淋巴细胞分离液(GE Healthcare 美国)、磁珠(Miltenyi CD4+T Cell Isolation Kit)、Transwell小室(Corning 公司)。
PCR 实验所需试剂:引物合成(苏州金唯智)、Trizol(Sigma 德国)、异丙醇、氯仿、DEPC 水(上海生工)、75%乙醇(30 mL 无水乙醇+10 mLDEPC水配置)、逆转录试剂盒(Promega 美国)、SYBR Green(Roche 瑞士)。

表1 Q-PCR 引物序列Tab 1 Primer sequence of Q-PCR
Western blot 所 需 试 剂:1×PBS(NaCl:8 g、KCl:0.2 g、Na2HPO4:1.44 g、KH2PO4:0.27 g,双蒸水定容至1 L)、三羟基甲基氨基甲烷(Trizmabase)、甘氨酸(Glycine)、十二烷基硫酸钠(SDS)、氯化钠、过硫酸铵(AP)、30%丙烯酰胺溶液(生工)、TEMED(四甲基乙二胺)(BIO-RAD 公司)、Tris-HCl(Sigma 公 司),甲 醇、Tween-20、5×SDSPAGE 蛋白上样缓冲液(碧云天)、预染蛋白marker 10~180 kD(ThermoFisher)、封闭专用脱脂奶粉(普利莱)、BSA(牛血清白蛋白)(Biotopped)、Western blot 超敏发光液(普利莱)、PVDF 膜(Millipore)。
一抗:PI3K、P-PI3K(Bioss 公司);二抗:羊抗兔-HRP(biovol 公司);Protein Marker(TransGen公司)。
设备:超净工作台(AIRTECH)、CO2培养箱(Thermo)、超低温冰箱(−70℃)(海尔公司)、台式低温高速离心机(Thermo)、培养瓶、培养板(Costar公司)、倒置显微镜(Olympus)、荧光定量PCR 仪(Roche LightCycler480Ⅱ)、梯度PCR 仪(ABI veri‐ti96-well)、微量分光光度计BioMate3S(Thermo)、凝胶成像系统(GE Imager 600)、蛋白电泳及转膜装置(Bio-Rad)。
1.4 统计学处理
运用Graphpad8.0 及SPSS21.0 进行统计分析及作图,计数资料以百分比(%)表示,组间比较采用卡方检验;正态分布计量资料以均数±标准差(±s)表示,组间均数比较采用方差分析,非正态分布资料以中位数及四分位数间距表示,组间比较采用秩和检验,相关性分析采用Spearman 直线相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组一般情况比较
各组年龄及性别构成比较无统计学意义(P>0.05);哮喘急性发作期组患儿其他变应性疾病史发生率高于其他两组,差别有统计学意义(P=0.032);对照组无哮喘家族史,与其他两组比较有统计学差异(P=0.001)。见表2。
2.2 各组外周血单个核细胞中B7H3、miR‐29b 的相对表达量
哮喘急性发作期组PBMC 中B7H3 表达量高于哮喘非急性发作期组与对照组。对照组PBMC 中miR⁃29b 表达量明显高于哮喘患儿非急性发作期组与急性发作期组,任意两组间比较差异均有统计学意义(P<0.001)。见表3。
2.3 miR‐29b 上、下调对巨噬细胞功能的影响
沉默表达miR-29b 后IL-4Rα、IL-4、IL-5、IL-13、CD206 明显升高,而IFN-γ 下降,提示下调miR-29b 可以促进巨噬细胞向M2 极化。见表4。
2.4 不同分组中荧光素酶的表达量
miR-29b+STAT3 的3UTR 野生型荧光素酶表 达 量 为0.11±0.01,miR-29b+STAT3 的3UTR突变型为0.35±0.01,miR-29b+荧光素酶空载为0.33±0.02。与其他组比较,仅miR-29b+STAT3-3′-UTR(野生型)组荧光素酶表达量下降(P<0.05),证 实miR-29b 可 以 直 接 结 合 于STAT3-3′-UTR。
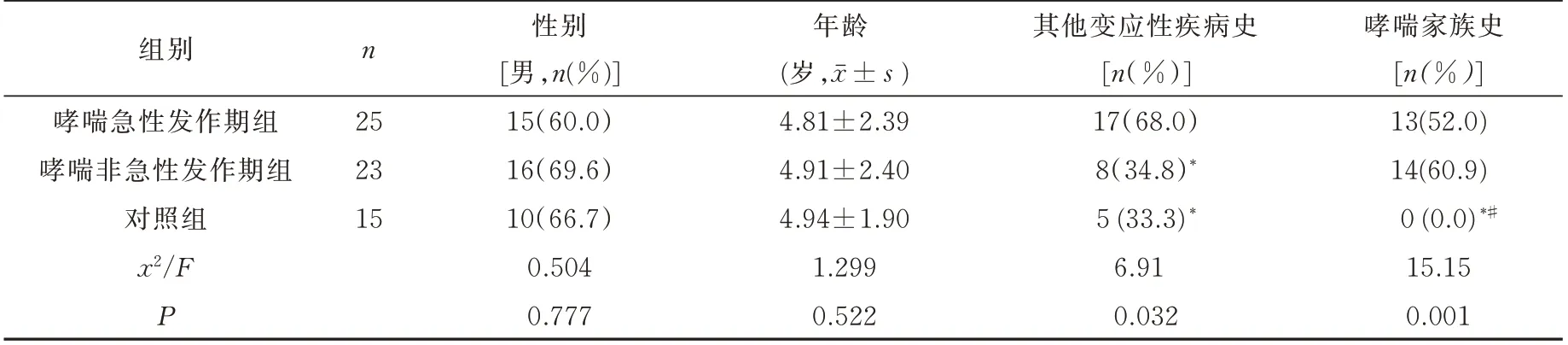
表2 入组患儿一般情况比较Tab 2 General information of patients

表3 不同分组患儿外周血单个核细胞中B7⁃H3、miR⁃29b 的相对表达量Tab 3 Relative expression of B7⁃H3 and miR⁃29b in mono⁃cytes
2.5 巨噬细胞过表达
miR-29b,STAT3、B7-H3 基因水平及蛋白水平表达下降;抑制miR-29b,STAT3、B7-H3 基因水平及蛋白水平表达上升。见图1~2,表5。
2.6 巨噬细胞B7-H3 与STAT3 mRNA 相对表达量相关性分析
巨噬细胞STAT3 与B7-H3 mRNA 的表达成显著正相关(r=0.973 7,P<0.000 1),见图3。
2.7 不同分组中T 细胞转录因子的表达量
巨噬细胞与活化的CD4+T 细胞共培养,可促进初始T 细胞即Th0 细胞向Th2 方向分化,其中下调miR-29b 的巨噬细胞促进作用更明显。见表6。
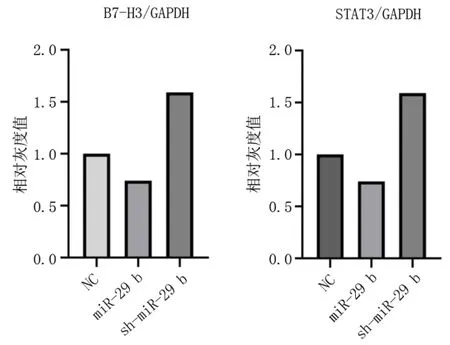
图1 蛋白免疫印迹法检测巨噬细胞中STAT3、B7⁃H3 的蛋白表达水平Fig 1 Protein expression of STAT3 and B7-H3 in macro⁃phages by Western blotting
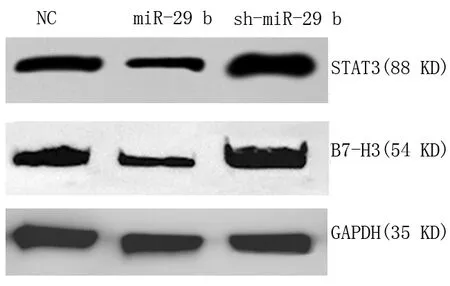
图2 蛋白免疫印迹法检测巨噬细胞中STAT3、B7⁃H3 mRNA 的蛋白表达水平(相对灰度值)Fig 2 Gene expression of STAT3 and B7-H3 in macro⁃phages by Western blotting
表4 巨噬细胞上、下调miR-29b 后相关基因的表达(±s)Tab 4 Expression of relative genes after regulating miR‐29b in macrophages(±s)

表4 巨噬细胞上、下调miR-29b 后相关基因的表达(±s)Tab 4 Expression of relative genes after regulating miR‐29b in macrophages(±s)
组别NC 对照组miR‐29b 干扰组miR‐29b 过表达组IFN‐γ 0.96±0.04 0.22±0.06*0.87±0.15 52.87<0.001 FP IL‐4Rα 1.01±0.04 3.61±0.45*1.17±0.20 78.45<0.001 CD206/MRC1 0.93±0.13 5.91±0.35*1.29±0.04 481.02<0.001 IL‐4 0.88±0.13 3.84±0.54*0.81±0.11 83.33<0.001 IL‐5 0.86±0.16 3.99±0.32*0.68±0.02 246.05<0.001 IL‐13 1.06±0.12 3.55±0.44*0.75±0.23 82.17<0.001
表5 不同处理方式的巨噬细胞中STAT3 及B7-H3 mRNA 的相对表达量(±s)Tab 5 mRNA expression of STAT3 and B7-H3 in macro⁃phages(±s)
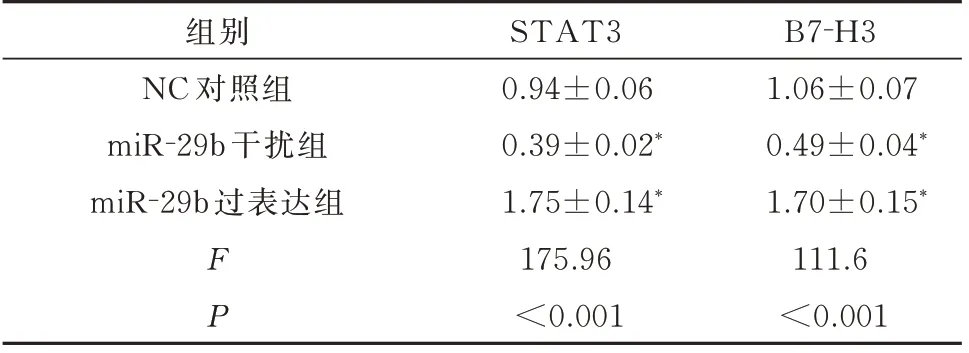
表5 不同处理方式的巨噬细胞中STAT3 及B7-H3 mRNA 的相对表达量(±s)Tab 5 mRNA expression of STAT3 and B7-H3 in macro⁃phages(±s)
注:与NC 对照组相比,*P<0.05。
B7‐H3 1.06±0.07 0.49±0.04*1.70±0.15*111.6<0.001组别NC 对照组miR‐29b 干扰组miR‐29b 过表达组FP STAT3 0.94±0.06 0.39±0.02*1.75±0.14*175.96<0.001

图3 巨噬细胞B7⁃H3 与STAT3 mRNA 相对表达量相关性分析Fig 3 Correlation between mRAN expression of STAT3 and B7-H3 in macrophages
表6 不同分组中T 细胞转录因子的表达量(±s)Tab 6 Expression of transcription factors of T cel(l±s)

表6 不同分组中T 细胞转录因子的表达量(±s)Tab 6 Expression of transcription factors of T cel(l±s)
注:K D 为下调miR‐29b 的巨噬细胞;NC 为空载病毒巨噬细胞组;与CD4+T 细胞组相比,*P<0.05。
ROR‐γt 1.04±0.04 0.38±0.04*0.75±0.02*261.3<0.001组别CD4+T KD/CD4+T NC/CD4+T FP T‐bet 0.95±0.06 0.25±0.01*0.67±0.04*186.42<0.001 GATA3 0.99±0.02 1.86±0.14*1.48±0.05*73.38<0.001
3 讨论
我国第三次城市儿童哮喘流行病学调查显示我国城市0~14 岁儿童哮喘两年现患率为0.42%~5.73%,平均为2.32%,累计患病率为0.48%~7.57%,平均为3.02%,患病率较10 年前有所增加[12]。具有哮喘家族史的儿童较无哮喘家族史的儿童更易罹患哮喘,相对危险度为6.20[13,14],遗传因素在哮喘的发病中起着重要的作用。有研究表明,具有变应性疾病的患儿更易患哮喘,而且患有变应性疾病的患儿哮喘易持续至青春期。本研究中哮喘急性发作期与非急性发作期哮喘家族史的比例及其他变应性疾病的比例远高于对照组,与他人的研究结果相似。
根据不同的微环境,巨噬细胞可以分化成不同的亚型,主要分为两个类型:经典的M1 型巨噬细胞以 及 旁 路M2 型 巨 噬 细 胞[17,18]。其 中M2 型 巨 噬 细胞在抑制Th1 型炎症反应和适应性免疫反应中发挥作用,增强Th2 型炎症反应[19,20]。参与巨噬细胞极化的信号分子及通路众多,如JNK、PI3K/Akt、Notch、JAK/STAT、TGF- β/SMAD 以 及TLR/NF-κB 等信号途径。文献报道称LPS 处理后巨噬细胞IL-6/STAT3 信号通路受到抑制,但IL-4 诱导后巨噬细胞激活。IL-6/STAT3 信号通路参与了M1/M2 巨噬细胞极化[21]。本研究得出在巨噬细胞中下调miR-29b,巨噬细胞向M2 方向极化,且巨噬细胞中miR-29bDE 靶基因STAT3 表达增多,证实STAT3 参与巨噬细胞的极化,且下调miR-29b 的巨噬细胞与CD4+T 细胞共培养,CD4+T 细胞向Th2细胞分化;在哮喘患儿外周血单个核细胞中存在miR-29b 的低表达,因此哮喘患儿体内的巨噬细胞向M2 方向极化,表现为高Th2 型炎症反应。
B7-H3 作为抗原提呈细胞细胞表面的共刺激分子,对CD4+T 细胞的分化具有重要的作用,既往研究提示,哮喘患者体内存在高表达的sB7-H3,其与哮喘患者体内低水平的IFN-γ 成正相关,在动物实验中也证明B7-H3 可以加重哮喘小鼠气道炎症表现,以Th2 细胞型免疫反应为主[8]。本研究得出B7-H3 与STAT3 存在协同作用,两者可协同增强Th2型炎症反应。
所述哮喘患者体内存在低表达的miR-29b,巨噬细胞中STAT3 表达增加,影响巨噬细胞向M2 极化,协同共刺激分子B7-H3 促进CD4+T 细胞向Th2方向极化,加重哮喘症状。
