贮藏过程中阿根廷鱿鱼生物胺的变化及产胺菌的分离鉴定
2021-05-15李颖畅曹娜娜高小溪励建荣
李颖畅,曹娜娜,韩 笑,高小溪,沈 琳,励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013 2 大连东霖食品股份有限公司 辽宁大连116101)
生物胺(Biogenic amine,BA)是一类具有生物活性并含有氨基的低分子质量有机化合物的总称[1],广泛存在于食品中,包括海鲜、肉类、乳制品、水果、蔬菜、巧克力、坚果和发酵产品[2]。生物胺的前体物质一般是氨基酸,主要是由游离的氨基酸经微生物的脱羧作用或经氨基酸脱羧酶脱羧产生[3]。陈踊南等[4]以冰鲜金线鱼为原料分离鉴定产组胺关键菌,探究金线鱼腌制过程中组胺含量的变化规律,经16S rDNA 基因序列法鉴定,马胃葡萄球菌和蜂房芽孢杆菌是主要产组胺的细菌。Lakshmanan 等[5]通过分离鉴定鱼和虾在冰藏过程中主要的产胺菌,发现大部分的产胺菌为革兰氏阴性菌,如希瓦氏菌属、假单胞菌属、黄质菌属、不动细菌属等,仅有少数微球菌属,属于革兰氏阳性菌。生物胺的产生受品种、pH 值、温度、氧气、水分和外界环境等多方面的影响,在不同条件下产生的生物胺不同。
阿根廷鱿鱼(Illexargentinus)肉质鲜嫩,蛋白质含量高,并且富含多种人体必需氨基酸,满足人体营养需求,深受消费者喜爱[6],是我国近几年水产品加工的主要原材料之一,每年可达到40 万t[7]。阿根廷鱿鱼含有丰富的氨基酸和蛋白质,极易在贮藏和运输过程中受微生物的影响而产生大量的生物胺,从而导致生物胺中毒现象发生。目前,国内外有关阿根廷鱿鱼的研究主要是针对其内源性甲醛的问题,对其加工过程中产生生物胺的研究较少,关于鱿鱼中不同贮藏温度下的鲜度变化及产胺菌的研究还未见报道。
本文测定25 ℃和4 ℃温度条件下阿根廷鱿鱼中主要生物胺含量的变化,分离鉴定阿根廷鱿鱼中的产胺菌的种类,测定其产生生物胺的能力,为鱿鱼在贮藏加工中水产品安全质量的监控提供理论依据。
1 材料与方法
1.1 材料与试剂
阿根廷鱿鱼,锦州市林西路水产市场;生物胺标准品:色胺(Tryptamine,Trp,≥98%)、2-苯乙胺(2-Phenethylamine,2-Phe,≥99.5%)、组胺(Histamine,His,≥97%)、酪胺 (Tyramine,Tyr,≥99%)、亚精胺 (Spermidine,Spm,≥98%)、精胺(Spermine,Spm,≥97%)、丹磺酰氯(99%)、腐胺(Putrescine,Put,≥99%)、尸胺(Cadaverine,Cad,≥97%),美国Sigma 公司;L-苯丙氨酸(≥97.3%),天津市光复精细化工研究所;L-赖氨酸(≥98%)、L-酪氨酸 (98.8%),加拿大BBI Life Sciences 公司;鸟氨酸盐酸盐(≥99%)、溴甲酚紫(≥98%),上海麦克林生化科技有限公司;三氯乙酸,上海阿拉丁生化科技股份有限公司;硫代巴比妥酸,国药集团化学试剂有限公司,以上试剂均为生物试剂或分析纯级。乙腈、甲醇均为色谱纯级,美国Fisher Chomical 公司;琼脂粉、酵母浸粉、蛋白胨,北京奥博星生物技术有限公司;LB 营养肉汤、平板计数琼脂,青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
LC-2030 高效液相色谱、UV-2550 紫外-可见分光光度计,日本岛津公司;PHSJ-3F 实验室pH计,上海仪电科学仪器股份有限公司;Multifuge X1R 冷冻高速离心机,美国Thermo 公司;Milli-Q超纯水系统,美国Millipore 公司;LRH-150 生化培养箱,上海一恒科学仪器有限公司;FSH-2A 均质机,常州越新仪器制造有限公司;LDZX-50FBS立式压力蒸汽灭菌器,上海申安医疗器械厂;Eppendorf PCR 扩增仪,Eppendorf 中国有限公司;SW-CJ-2FD 洁净工作台,苏净集团苏州安泰空气技术有限公司。
1.3 试验方法
1.3.1 样品处理 阿根廷鱿鱼 (0.9±0.15)kg,装入蒸煮袋中置于25 ℃和4 ℃下贮藏。将贮藏在25 ℃下的样品每隔12 h 取1 次样,在4 ℃下贮藏的样品每隔3 d 取1 次样,各取样7 次。取样时除去头、皮和内脏,只取胴体肌肉用于各保鲜指标和生物胺含量的测定。所有指标测定均取3 个平行样品。
1.3.2 生物胺标准曲线的绘制 配制不同质量浓度的混合标准溶液按样品的方法进行衍生。以超纯水和乙腈为流动相于C18柱 (Agilent ZORBAX Eclipse XDB-C184.6 nm×250 nm,5 μm)上按表1进行梯度洗脱,流速1.0 mL/min,柱温30℃,DAD 检测波长254 nm,进样量10 μL。

表1 梯度洗脱程序Table 1 Gradient elution procedures
1.3.3 样品的测定 取10 g 鱼肉,加入20 mL 5%三氯乙酸,经均质机均质后超声提取30 min,4℃离心(8 000 r/min)15 min,移出上清液后残渣用20 mL 5%三氯乙酸再提取1 次,合并上清液,定容至50 mL,过滤。取0.3 mL 滤液,加入100 μL饱和碳酸氢钠溶液和50 μL 2 mol/L 氢氧化钠,加入10 mg/mL 丹磺酰氯(Dns-Cl)衍生剂0.3 mL,振荡混匀,并置于60 ℃水浴30 min,冷却后加100 μL 25%氨水,25 ℃下于暗处静置30 min。冷却后用乙腈定容至1.5 mL,用0.45 μm 有机滤膜过滤,待测。
生物胺含量按式(1)计算。

式中,X——样品中单组分生物胺含量(mg/kg);C——由HPLC 法计算的进样液生物胺质量浓度(mg/L);V——5%TCA 定容体积(mL),在本研究中为50 mL;M——取样量(g)。
1.3.4 菌落总数的测定 参考《食品安全国家标准食品微生物学检验菌落总数测定》(GB 4789.2-2016)[8]方法测定。
1.3.5 TBA 的测定 参考丁婷等[9]的方法。
1.3.6 pH 值的测定 参考《食品安全国家标准食品pH 值的测定》(GB 5009.237-2016)[10]方法测定。
1.3.7 产胺菌的分离纯化 参考钱茜茜等[11]的方法。从25 ℃阿根廷鱿鱼样品中分离得到11 株,按照分离获得的时间标记为A1~A11,4 ℃分离得到的产胺菌12 株,记为B1~B12,共23 株生物胺产胺菌。在生物胺初筛培养基上纯化2 次以上得到纯种菌株。
1.3.8 产胺菌产胺能力鉴定 将纯化后的细菌接种于LB 肉汤培养基中培养12 h,取0.2 mL 菌悬液接种于10 mL 氨基酸LB 营养肉汤培养基中,30℃,160 r/min 摇床振荡培养2 d 后,取培养液1 mL,加入1 mL 5%的三氯乙酸,用冷冻离心机于4℃,12 000 r/min 离心10 min,取1 mL 上清液如1.3.3 节中样品处理方法测定生物胺含量。
1.3.9 基因序列的测定 将分离筛选的纯菌株分别接种到LB 肉汤中,在30 ℃,160 r/min 的摇床中培养至对数生长期,然后吸取1 mL 细菌培养液,4 ℃,12 000 r/min 离心10 min,弃上清,将细菌用100 μL 无菌水冲洗至200 μL,于PCR 扩增仪上进行细胞破碎,提取细菌DNA。PCR 扩增条件参照PCR Mix 试剂盒说明书中提供的方法,以产胺菌的菌悬液为模板,选用细菌16S rDNA 通用引物27F:5'-AGAGTTTGATCCTG G CTCAG-3' 和1492R:5'-GGTTACCTTGTTACG ACTT-3'。扩增得到产胺菌的全长,送至上海生工生物科技有限公司对扩增得到的产胺菌株进行测序。获得的基因序列由NCBI 数据库进行BLAST 相似序列检索和序列比对。
1.3.10 数据统计分析 试验数据处理及统计分析采用Origin 9.1 和SPSS 19.0,处理结果均以“平均值±标准偏差”表示。
2 结果与分析
2.1 生物胺标准样品的回归方程
由图1可以看出,8 种生物胺标准品在22 min 内得到完全分离,经过测定色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、精胺、亚精胺的出峰时间分别为 7.151,8.811,9.441,10.152,10.656,13.055,13.593,15.62 min,生物胺标准品回归方程和相关系数见表2。
2.2 生物胺的变化

图1 生物胺混合标准品HPLC 图Fig.1 Chromatogram of biogenic amine mixed standard by HPLC

表2 生物胺标准品线性回归方程及相关系数Table 2 Linear regression equations and correlation coefficients of biogenic amine standards
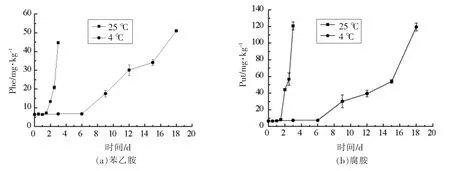
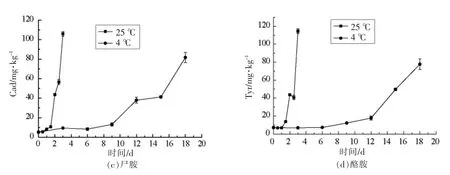
图2 不同贮藏温度下阿根廷鱿鱼生物胺含量的变化Fig.2 Changes of BA in Illexargentinus at different storage temperature
生物胺的产生与水产品的种类、结构、化学成分有关,也与水产品的贮藏环境和贮藏温度有关。由图2可以看出,在贮藏初期,阿根廷鱿鱼中的苯乙胺、腐胺、尸胺和酪胺都处于较低水平,随着贮藏时间的延长,4 种生物胺含量具有明显增加的趋势。在25 ℃贮藏期终点,除苯乙胺外,腐胺、尸胺、酪胺含量均较4 ℃贮藏终点高,苯乙胺、腐胺、尸胺、酪胺终点含量分别达到44.703,120.683,105.988,114.553 mg/kg,此时酪胺超过了欧盟的限量标准[12]。在4 ℃贮藏条件下,生物胺变化规律与25 ℃条件下阿根廷鱿鱼生物胺的变化规律相似,在第9 天,阿根廷鱿鱼中的生物胺含量快速增加,在贮藏第18 天,阿根廷鱿鱼中苯乙胺、腐胺、尸胺、酪胺分别达到51.034,119.426,81.708,77.773 mg/kg。
由图3可以看出,在贮藏初期,阿根廷鱿鱼中的组胺、精胺和亚精胺都处于较低水平,随着贮藏时间的延长,25 ℃和4 ℃贮藏鱿鱼中组胺、亚精胺、精胺含量缓慢增加。阿根廷鱿鱼在贮藏末期,组胺分别达到13.726 mg/kg 和15.7433 mg/kg,在整个贮藏期间,精胺和亚精胺含量虽然都有升高,但是变化不明显,且未超过美国水产品中组胺的含量不得超过50 mg/kg 的限量[13],表明阿根廷鱿鱼中游离组氨酸或精氨酸的总体含量较低,或缺乏相应的氨基酸脱羧酶,无法产生相应的生物胺。在不同贮藏温度条件下,精胺和亚精胺虽略有波动,但是无明显规律可循。Kanki 等[14]研究了其它种类水产品中精胺含量的变化,然而变化也无明显规律,这可能是由原材料、加工过程以及微生物等多方面因素综合导致。
2.3 菌落总数的变化
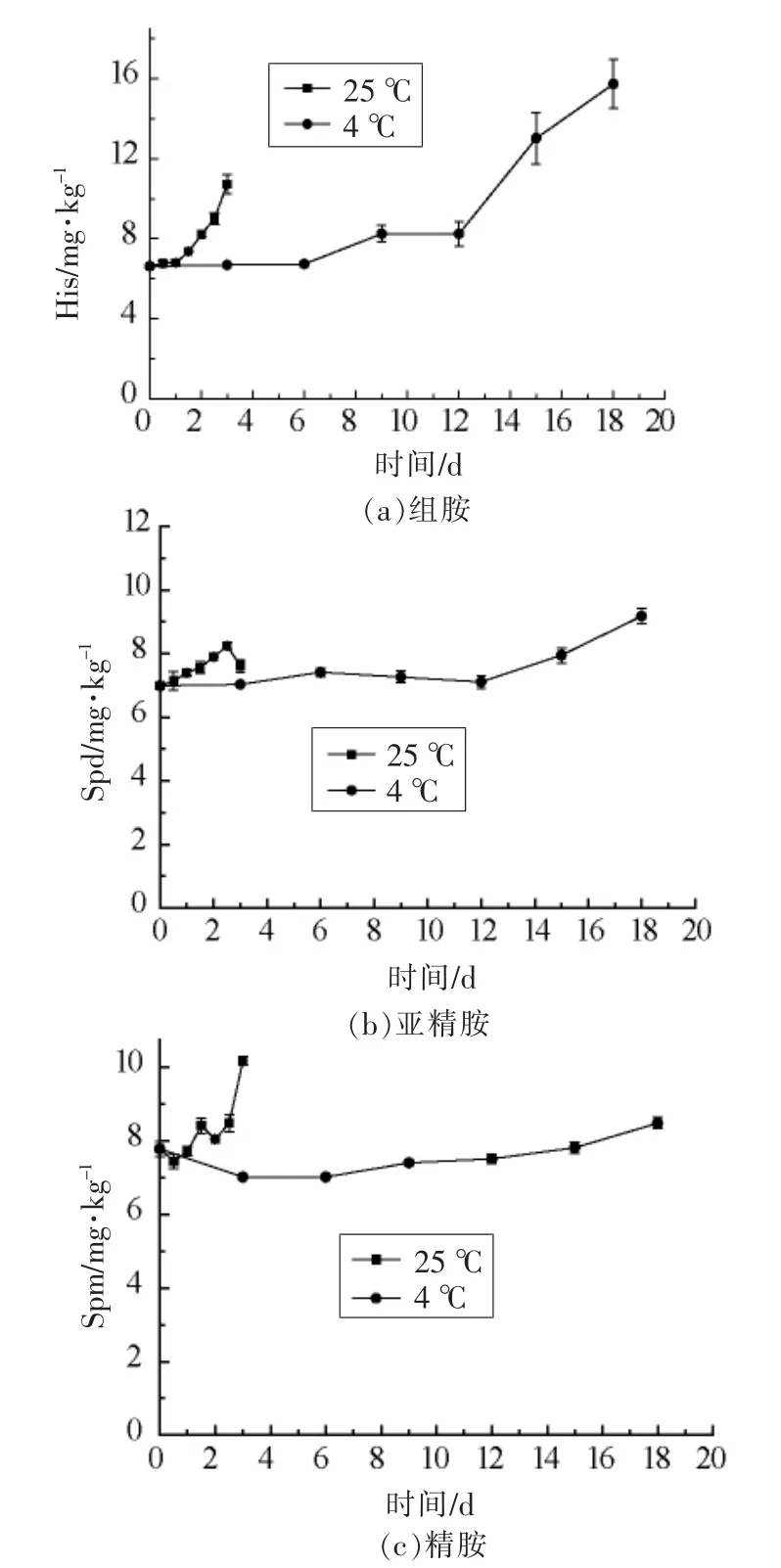
图3 不同贮藏温度下阿根廷鱿生物胺含量的变化Fig.3 Changes of BA in Illexargentinus at different temperature
菌落总数(TVC)是衡量水产品品质的重要指标,微生物的生长代谢是鱼腐败变质的主要原因之一,微生物的生长代谢会产生硫化类、醛类、醇类,甚至在氨基酸脱羧酶的作用下产生生物胺[15]。
阿根廷鱿鱼在不同温度贮藏期间的菌落总数变化如图4所示。在贮藏初期阿根廷鱿鱼的初始菌落总数为3.48 lg(CFU/g),新鲜水产品在通常情况下的TVC 在2~4 lg(CFU/g),表明阿根廷鱿鱼新鲜度良好。随着贮藏时间的延长,25 ℃和4℃贮藏温度下的鱿鱼TVC 值均呈显著增加趋势,并且25 ℃下菌落总数增加速率高于4 ℃。在25℃条件下,阿根廷鱿鱼中的微生物生长迅速,在第36 小时TVC 达到了5.99 lg(CFU/g),在36 h 后菌落总数生长变缓,在第3 天达到7.59 1g(CFU/g)。在4 ℃贮藏条件下,前期TVC 增长缓慢,在12~18 d 内,微生物迅速上升,第12 天时TVC 达到5.15 1g(CFU/g),第18 天达到了7.24 1g(CFU/g),这可能是由于随着贮藏时间的延长,鱿鱼体自身发生一定的自溶反应,鱼体内的氨基酸和蛋白质进一步溶出,从而被微生物所利用。
2.4 TBA 值的变化
硫代巴比妥酸值(TBA)是反应脂类氧化的指标[16],水产品的不饱和酸发生氧化,产生丙二醛等小分子物质,发生酸败。TBA 值与肉类脂肪氧化程度有很强的相关性,TBA 值越大,脂肪的氧化程度越高,酸败就越严重,因此可以用TBA 值代表鱼体脂肪氧化程度,以此来作为判断水产品新鲜度的重要指标[17]。
由图5可以看出,在不同贮藏温度下,TBA 含量有明显的上升趋势,在25 ℃贮藏的阿根廷鱿鱼的TBA 值在初期急速上升,中后期增长缓慢,在第1 天TBA 值就达到0.717 mg MDA/kg,在第3天TBA 值才达到0.967 mg MDA/kg;在4 ℃贮藏条件下,阿根廷鱿鱼中TBA 值在0~6 d 内上升较快,后期变化趋于平缓,在第18 天达到了1.03 mg MDA/kg。一般情况下,鱼肌肉中的TBA 值达1~2 mg MDA/kg 时便产生难以接受的气味[18],而阿根廷鱿鱼本身属于低脂水产品,因此TBA 值较其它鱼类含量始终保持偏低状态。在阿根廷鱿鱼贮藏末期,25 ℃和4 ℃样品的TBA 值分别是初始值的4.36 倍和4.02 倍,因此仍可以说明,阿根廷鱿鱼中油脂氧化,已经达到腐败程度。
2.5 pH 值的变化
pH 值是通过表示水产品的酸碱程度,反映鱼体新鲜程度的一种方法。在鱼体死亡之后,在ATP酶的以及产酸微生物的作用下,鱼体内产生乳酸,从而导致pH 值降低,鱼体产生乳酸的能力与鱼体本身有关,不同的鱼体产生的乳酸会有差别。

图4 不同贮藏温度下阿根廷鱿鱼菌落总数的变化Fig.4 Changes of TVC in Illexargentinus at different temperature

图5 不同贮藏温度下阿根廷鱿鱼TBA 的变化Fig.5 Changes of TBA in Illexargentinus at different temperature
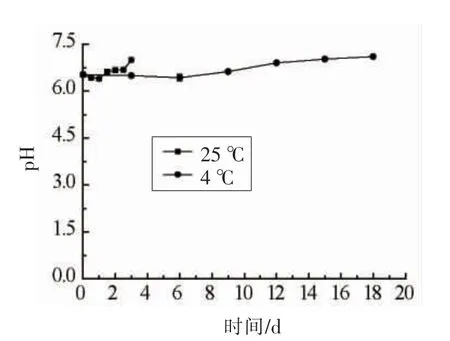
图6 不同贮藏温度下阿根廷鱿鱼pH 值的变化Fig.6 Changes of pH value in Illexargentinus at different temperature
由图6可以看出,在贮藏初期,不同温度贮藏下的阿根廷鱿鱼的pH 值都略有降低,25 ℃贮藏温度下,阿根廷鱿鱼在24 h 达到最低,随后pH 值迅速上升,在第3 天pH 值为7.00。4 ℃温度下阿根廷鱿鱼的pH 值在第6 天降到最低点,而后继续上升,有可能是由于微生物生长活跃,并产生一些酸性代谢产物,之后由于继续分解鱼体内蛋白质,产生部分氨类化合物,以及三甲胺等碱性物质,而使pH 值继续升高[9]。pH 值的测定受待测样品种类以及测定部位不同所影响,pH 值的变化程度也不同,所以在实际应用中很难得到一个可以判定腐败临界值的pH 值,因此,应该结合其它鲜度指标综合判断才更有效。
2.6 产胺菌产胺能力鉴定
25 ℃贮藏条件下各菌株产胺能力见表3,由表3可以看出,在25 ℃条件下分离得到11 株产胺菌,产生物胺的能力均比较强,以生物胺产量50 mg/mL 为限量,其中产腐胺的有11 株,产生尸胺的有10 株,产生组胺的有9 株。其中菌A1的产胺能力最强,能够产生251.08 mg/mL 腐胺、109.64 mg/mL 尸胺和87.98 mg/mL 组胺,其次为产胺菌A4,腐胺、尸胺、组胺的产胺能力分别为231.71,62.34,111.66 mg/mL,产胺菌A6产生腐胺、尸胺、组胺分别为243.30,57.12,105.21 mg/mL,其它8株菌也有较高的产胺能力。
同样,4 ℃贮藏条件下各菌株产胺能力见表4,由表4可以看出,4 ℃分离得到的产胺菌共12株,均具有一定的产胺能力,其中产腐胺的有5株,产尸胺的菌有6 株,产组胺的菌有6 株,产酪胺的菌有2 株。菌株B1的产胺能力最强,能够产生509.78 mg/mL 腐胺、196.49 mg/mL 尸胺、165.92 mg/mL 组胺。其次是菌B8,能够产生219.88 mg/mL腐胺、110.21 mg/mL 尸胺和115.77 mg/mL 酪胺。钱茜茜等[11]分离出腌干鱼中的假单胞菌、气单胞菌、不动杆菌、沙门菌属、弧菌、巴斯德菌等20 株细菌,并检测到这些菌株的产生物胺能力各不相同,其中沙门菌群具有较强的产腐胺、尸胺、组胺和酪胺的能力。Landeta-Cortés 等[19]从黑斑小鲷和大菱坪中分离出莓实假单胞菌和丁香假单胞菌2 类产组胺菌,在30 ℃下培养24 h 分别能产生组胺(212.5±53.9) mg/mL 和(135.16±35.16) mg/mL,这可能与微生物的繁殖能力以及本身含有的氨基酸有关。可见鱿鱼中产胺菌的产胺能力受多种因素影响。
2.7 产胺菌的鉴定
阿根廷鱿鱼在25 ℃和4 ℃条件下贮藏至腐败时筛选出的产胺菌共23 株。由表5可以看出,25 ℃条件下,共筛选得到6 个菌属的菌株:柠檬酸杆菌属(Citrobacter freundii,Citrobacter murliniae,Citrobacter braakii)5 株,蜂房哈夫尼亚菌(Hafnia alvei)2 株,成团泛菌(Pantoea agglomerans)1 株,变形杆菌(Obesumbacterium proteus)1 株,克吕沃尔氏菌(Kluyvera cryocrescens)1 株,克雷伯氏菌(Klebsiella aerogenes)1 株,同种菌属的菌株产胺能力也略有不同,其中A4、A11产生相同种类的生物胺,且产胺量相似,属同一菌属;A1、A3、A5、A8、A9属同一菌种,也能够产生相同种类的生物胺,均能产生一定量的腐胺、尸胺、组胺,而产胺量略有不同。
同样,由表6可以看出,4 ℃贮藏条件下,共筛选得到肠杆菌属 (Enterobacteriaceae bacterium)1株,柠檬酸杆菌属(Citrobacter braakii)1 株,克雷伯氏菌(Klebsiella aerogenes)属1 株,变形杆菌(Obesumbacterium proteus)3 株,哈夫尼菌属(Hafnia alvei,Hafnia alvei sensu,Hafnia paralvei)6 株共5 个菌属的菌株,与25 ℃条件下产生的菌属类似,而略有差异,其中B5、B6、B8与在25 ℃条件下分离得到的A4和A11属同种菌株,产胺能力最强,且25 ℃条件下分离得到的菌株的总体产胺能力较4 ℃条件下分离得到的菌株强,这可是由于不同的阿根廷鱿鱼体以及温度对氨基酸脱羧酶活性的差异造成。生物胺产生菌有嗜冷菌和嗜温菌两大类,鱼体在不同温度时的菌相不同,不仅高温时产生生物胺,低温时也能产生生物胺,只不过低温时菌体代谢缓慢,生物胺的产量很少[20]。Torido 等[21]选择30 ℃和15 ℃下检测竹筴鱼、秋刀鱼等的产组胺菌,发现30 下可分离出发光杆菌属、摩氏摩根菌、副溶血性弧菌,而15 ℃下则分离得到发光杆菌属、溶藻弧菌、希瓦氏菌、肠膜明串珠菌。此外,相同种属的菌株也存在产胺能力间的差异,有研究发现金枪鱼中筛选出的3 株产组胺菌在TSBH 培养基中的产组胺能力不同[22],推测是由于微生物的脱羧酶活性受到温度、pH 值等多种因素影响,因此鱼肉中的微生物在氨基酸培养基初筛时呈现不同的产胺能力,导致不同温度下的筛选结果存在差异。
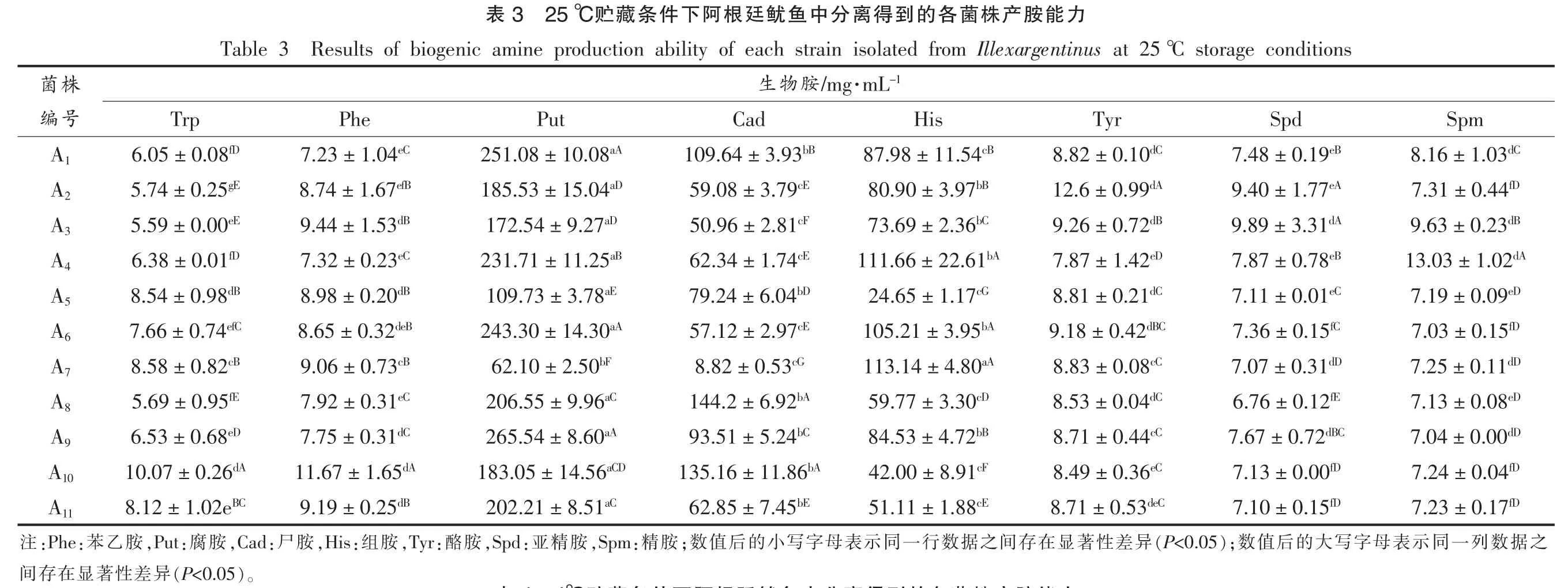
力能胺产株菌各的到得离分中鱼鱿廷根阿下件条藏贮25 ℃3表storage conditions Results of biogenic amine production ability of each strain isolated from Illexargentinus at 25 ℃Table 3 -1·mL/mg胺物生株菌Spm Spd Tyr His Cad Put Phe Trp号编dC 8.16±1.03 eB 7.48±0.19 dC 8.82±0.10 cB 87.98±11.54 bB 109.64±3.93 aA 251.08±10.08 eC 7.23±1.04 fD 6.05±0.08 A1 fD 7.31±0.44 eA 9.40±1.77 dA 12.6±0.99 bB 80.90±3.97 cE 59.08±3.79 aD 185.53±15.04 efB 8.74±1.67 gE 5.74±0.25 A2 dB 9.63±0.23 dA 9.89±3.31 dB 9.26±0.72 bC 73.69±2.36 cF 50.96±2.81 aD 172.54±9.27 dB 9.44±1.53 eE 5.59±0.00 A3 dA 13.03±1.02 eB 7.87±0.78 eD 7.87±1.42 bA 111.66±22.61 cE 62.34±1.74 aB 231.71±11.25 eC 7.32±0.23 fD 6.38±0.01 A4 eD 7.19±0.09 eC 7.11±0.01 dC 8.81±0.21 cG 24.65±1.17 bD 79.24±6.04 aE 109.73±3.78 dB 8.98±0.20 dB 8.54±0.98 A5 fD 7.03±0.15 fC 7.36±0.15 dBC 9.18±0.42 bA 105.21±3.95 cE 57.12±2.97 aA 243.30±14.30 deB 8.65±0.32 efC 7.66±0.74 A6 dD 7.25±0.11 dD 7.07±0.31 cC 8.83±0.08 aA 113.14±4.80 cG 8.82±0.53 bF 62.10±2.50 cB 9.06±0.73 cB 8.58±0.82 A7 eD 7.13±0.08 fE 6.76±0.12 dC 8.53±0.04 cD 59.77±3.30 bA 144.2±6.92 aC 206.55±9.96 eC 7.92±0.31 fE 5.69±0.95 A8 dD 7.04±0.00 dBC 7.67±0.72 cC 8.71±0.44 bB 84.53±4.72 bC 93.51±5.24 aA 265.54±8.60 dC 7.75±0.31 eD 6.53±0.68 A9 fD 7.24±0.04 fD 7.13±0.00 eC 8.49±0.36 cF 42.00±8.91 bA 135.16±11.86 aCD 183.05±14.56 dA 11.67±1.65 dA 10.07±0.26 A10 fD 7.23±0.17 fD 7.10±0.15 deC 8.71±0.53 cE 51.11±1.88 bE 62.85±7.45 aC 202.21±8.51 dB 9.19±0.25 BC 8.12±1.02e A11之据数列一同示表母字写大的后值);数(P<0.05异差性著显在存间之据数行一同示表母字写小的后值;数胺:精,Spm胺精:亚,Spd胺:酪,Tyr胺:组,His胺:尸,Cad胺:腐,Put胺乙:苯:Phe注)。(P<0.05异差性著显在存间

力能胺产株菌各的到得离分中鱼鱿廷根阿下件条藏贮4℃4表storage conditions Results of biogenic amine production ability of each strain isolated from Illexargentinus at 4 ℃Table 4 -1·mL/mg胺物生株菌Spm Spd Tyr His Cad Put Phe Trp号编eD 7.07±0.04 eC 7.02±0.07 dD 8.50±0.28 cC 165.92±9.57 bA 196.49±8.17 aA 509.78±4.24 eE 6.89±0.23 fE 5.68±0.19 B1 dC 7.51±0.06 eC 6.83±0.10 dE 7.46±0.03 aB 225.07±13.87 cG 8.47±1.02 bF 45.87±1.66 cC 9.45±0.26 eCD 6.10±0.76 B2 cC 7.98±0.05 cB 7.62±0.03 dF 6.93±0.07 aB 235.91±6.96 cH 7.76±0.61 bF 41.42±2.4 cDE 7.70±0.68 dC 6.57±0.21 B3 dD 6.98±0.00 dC 6.88±0.18 dF 6.58±0.08 aD 87.77±2.08 dH 6.89±0.80 bH 21.05±2.30 cD 7.89±0.22 eD 6.00±0.11 B4 cB 8.44±0.42 dBC 7.36±0.44 eF 6.72±0.26 aA 251.59±8.59 cG 8.58±0.39 bFG 36.76±0.84 cD 8.11±0.16 eC 6.69±0.13 B5 cD 7.17±0.02 cC 6.82±0.09 cF 6.82±0.40 aB 217.99±15.79 cH 7.26±0.64 bH 21.21±0.47 cE 7.21±0.10 dE 5.47±0.09 B6 dB 8.92±0.52 eB 7.49±0.39 bC 33.46±1.7 fE 6.74±0.08 aE 61.16±1.72 bG 34.47±2.45 cB 10.95±0.33-B7 cC 7.98±0.31 dBC 7.31±0.66 bA 115.77±3.39 eE 6.90±0.01 bD 110.21±3.07 aB 219.88±7.15 cdE 7.47±0.21 deB 7.05±0.39 B8 cA 12.15±0.28 dA 8.95±0.15 eE 7.60±0.24 fE 6.60±0.08 aA 192.43±7.28 bE 58.03±1.02 dBC 9.96±0.80 beB 7.98±0.93 B9 dC 7.58±0.48 edB 7.73±0.8 eF 6.62±0.11-aC 125.40±2.67 bC 88.32±1.12 dD 7.93±0.50 cA 9.44±0.61 B10 dBC 8.11±0.48 eB 7.19±0.55 dD 8.39±0.67-aB 151.12±10.52 bD 76.84±2.73 eE 6.91±0.16 cA 9.98±0.39 B11间之据数列一同示表母字写大的后值);数(P<0.05异差性著显在存间之据数行一同示表母字写小的后值;数胺:精,Spm胺精:亚,Spd胺:酪,Tyr胺:组,His胺:尸,Cad胺:腐,Put胺乙:苯:Phe注)。(P<0.05异差性著显在存

表5 25 ℃下阿根廷鱿鱼产胺菌的鉴定结果Table 5 Results of biogenic amine-producing bacteria isolated from Illexargentinus stored at 25 ℃

表6 4 ℃下阿根廷鱿鱼产胺菌的鉴定结果Table 6 Results of biogenic amine-producing bacteria isolated from Illexargentinus stored at 4 ℃
3 结论
阿根廷鱿鱼中的优势生物胺为苯乙胺、腐胺、尸胺和酪胺,4 种生物胺含量随着贮藏时间的延长而增加,且贮藏温度越高,生物胺增长速率越快,生物胺含量就越高。组胺、精胺和亚精胺在贮藏期间变化不明显,色胺在贮藏期间无线性规律变化。这可能与阿根廷鱿鱼自身氨基酸组成,以及阿根廷鱿鱼腐败微生物的种类有关。在贮藏期间微生物、TBA 值有明显的上升变化趋势,pH 值则是先降低后升高。
通过对25 ℃和4 ℃贮藏末期的阿根廷鱿鱼产胺菌进行分离,发现产胺菌生长情况各不相同,分离得到的产胺菌产胺能力也有所不同。在25 ℃条件下,筛选得到柠檬酸杆菌属(Citrobacter freundii,Citrobacter murliniae,Citrobacter braakii)5株,蜂房哈夫尼亚菌(Hafnia alvei)2 株,成团泛菌(Pantoea agglomerans)1 株,变形杆菌(Obesumbacterium proteus)1 株,克吕沃尔氏菌(Kluyvera cryocrescens)1 株,克雷伯氏菌 (Klebsiella aerogenes)1 株。在4 ℃贮藏条件下,共筛选得到肠杆菌属(Enterobacteriaceae bacterium)1 株,柠檬酸杆菌属 (Citrobacter braakii)1 株,克雷伯氏菌属(Klebsiella aerogenes)1 株,变形杆菌(Obesumbacterium proteus)3 株,哈夫尼菌属(Hafnia alvei,Hafnia alvei sensu,Hafnia paralvei)6 株,与25 ℃条件下产生的菌属类似,而略有差异,25 ℃条件下分离得到的菌株产胺能力较4 ℃条件下分离得到的菌株强,这是由于温度较高导致氨基酸脱羧酶脱羧能力增加,微生物生理活性增强,从而能够产生更多的生物胺。
