2种抗氧化剂对α-葡萄糖苷酶的抑制作用
2021-05-15蔡思学户晶晶孙乐常王瑞芳
蔡思学,户晶晶,孙乐常,王瑞芳,王 力
(集美大学食品与生物工程学院 福建厦门361021)
抗氧化剂在日常生活中是必不可少的一部分[1],在食品工业中保护食品免受氧化,改善食品质量,延长货架期。在生物医学中,抗氧化剂生物学研究具有较好的成效,作为抗癌剂、保肝剂[2],以及治疗类风湿、心血管疾病、细菌感染等[3]中发挥特定的作用。另外,氧化应激参与糖尿病及并发症的发病机制,使用抗氧化剂可减少氧化应激,并减轻糖尿病并发症[4-5]。抗氧化剂在化妆品,治疗行业中的也有广泛应用[6]。
植酸是一种重要的有机磷天然抗氧化剂,广泛存在于谷类和植物种子中。植酸作为抗氧化剂的应用型研究报道越来越多[7]。Muñoz 等[8]研究报道天然的磷化合物植酸,可作为尿石症的潜在抑制剂。Lv 等[9]研究发现植酸在帕金森病治疗中起到一定的作用,显著抑制MPTP 诱导的黑质(SN)多巴胺能细胞损失,抑制小胶质细胞激活和诱导型一氧化氮合酶(iNOS)。Thompson 等[10]研究证实了添加内源植酸对减缓淀粉消化率和对豆科植物的血糖反应能力有影响。抗坏血酸棕榈酸酯是一种通过化合物合成的被国家标准限定的抗氧化剂,已被药品管理局(FDA)提议作为美国安全食品和天然二级食品抗氧化剂。抗坏血酸棕榈酸酯具有抗氧化活性,在食品工业中应用广泛[11-12],其表现出生物活性,可用于治疗肿瘤等多种疾病[13]。Fathi 等[14]利用表面等离子共振技术研究牛血清白蛋白与抗坏血酸棕榈酸酯之间的相互作用,发现它们之间的结合会影响蛋白的构象,从而可能干扰生物活性分子在体内的运输和分布。Zhou 等[15]研究发现抗坏血酸棕榈酸酯可用于协同抗肿瘤治疗。
糖尿病是一种伴随代谢和内分泌紊乱的重大疾病。大多数糖尿病患者受到胰岛素抵抗和胰岛素分泌缺陷的2 型糖尿病(T2DM)的影响,并出现各种并发症,包括大血管和微血管功能障碍等[16-17]。通常治疗T2DM 的策略是饮食控制,适度运动,使用降血糖和降脂剂等[18]。抑制α-葡萄糖苷酶是治疗糖尿病的手段之一,有效抑制α-葡萄糖苷酶的活性可减缓餐后血糖水平的提高。Kunyanga 等[19]研究表明植酸含量高的植物可有效抑制食品样品中α-葡萄糖苷酶的活性,其抑制程度与植酸含量直接相关,而植酸含量可能对餐后血糖水平的潜在治疗有协同作用。然而,植酸和L-抗坏血酸棕榈酸酯2 种抗氧化剂对α-葡萄糖苷酶的抑制机理未见报道。本研究通过酶动力学与分子对接技术研究植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶的抑制作用,为这2 种抗氧化剂功能性研究提供新思路,同时为开发新型酶抑制剂用于治疗糖尿病提供理论基础。
1 材料与设备
酿酒酵母的α-葡糖苷酶(EC 3.2.1.20),美国Singma-Aidrich 公司;阿卡波糖,上海麦克莱恩生化科技有限公司;对硝基苯基-α-D-吡喃葡萄糖苷(pNPG)、对硝基苯(pNP),北京百灵威科技有限公司;无水碳酸钠(Na2CO3),国药集团化学试剂有限公司;植酸、L-抗坏血酸棕榈酸酯,上海陆广生物科技有限公司;试验用水为超纯水。
Synergy H1 全功能酶标记仪器,美国BioTek仪器有限公司;HWS-24 电热恒温水浴,上海恒世仪器有限公司。
2 试验方法
2.1 植酸和L-抗坏血酸棕榈酸酯对α-葡糖苷酶的抑制效果
α-葡萄糖苷酶能使pNPG 水解生成pNP,生成物在紫外吸收波长405 nm 处具有最大吸收值。化合物对α-葡萄糖苷酶的抑制效果测定方法根据参考文献[20]进一步修改。α-葡萄糖苷酶的测活总体系为340 μL,首先加入133 μL 0.1 mol/L 磷酸盐缓冲液(磷酸二氢钠和磷酸氢二钠混合配制而成,pH 6.8),加入10 μL 5 U/mL α-葡萄糖苷酶稀释液,随后加入7 μL 不同浓度梯度的效应物溶液,混合均匀后在37 ℃下孵育10 min。加入20 μL 5 mmol/L 底物pNPG 溶液,混合均匀后在37℃下孵育20 min。170 μL 0.1 mol/L Na2CO3终止反应。取200 μL 混合液于96 孔板中,采用Synergy H1 全功能酶标记仪器在405 nm 波长处测得吸收值。
待测效应物为植酸和L-抗坏血酸棕榈酸酯,植酸浓度依次为0.15,0.16,0.17,0.18,0.19,0.20,0.205,0.21,0.215,0.220,0.230 mol/L,L-抗坏血酸棕榈酸酯浓度依次为0,0.05,0.1,0.15,0.2,0.25,0.3,0.35,0.4,0.45,0.5,0.55,0.6 mmol/L,每个梯度下平行测定5 次,得到不同效应物浓度下最后反应体系的吸收值。以α-葡萄糖苷酶剩余酶活的抑制率降低至50%时效应物的浓度为即为IC50值。将没有效应物的反应作为空白对照组。
2.2 植酸和L-抗坏血酸棕榈酸酯对α-葡糖苷酶的抑制机理
待测效应物为植酸和L-抗坏血酸棕榈酸酯,效应物对α-葡萄糖苷酶抑制机理的研究是基于抑制效果的测定方法。α-葡萄糖苷酶的浓度梯度为5,4,3,2,1 U/mL,底物pNPG 浓度为5 mmol/L,测定效应物在不同浓度下反应体系的紫外吸收波长。以酶的浓度梯度为横坐标,体系的反应速度为纵坐标绘制机理图,通过图中曲线是否过原点来判定效应物对α-葡萄糖苷酶的抑制机理。
2.3 植酸和L-抗坏血酸棕榈酸酯对α-葡糖苷酶的抑制类型
待测效应物为植酸和L-抗坏血酸棕榈酸酯,效应物对α-葡萄糖苷酶抑制类型的研究是基于抑制效果的测定方法。α-葡萄糖苷酶的浓度为5 U/mL,底物pNPG 的浓度梯度为5,3.9,2.8,1.7,1.1 mmol/L,测定效应物在不同浓度下反应体系的紫外吸收波长。以pNPG 浓度梯度的倒数为横坐标,体系的反应速度的倒数为纵坐标绘制Lineweaver-Burk 类型图,图中曲线的交点位置判定效应物对α-葡萄糖苷酶的抑制类型。通过二次作Dixon 图,计算抑制常数。
2.4 分子对接技术
分子对接技术可以进一步探索效应物与α-葡萄糖苷酶的结合模式。PubChem 中下载植酸和L-抗坏血酸棕榈棕榈酸酯的2D 结构保存为SDF格式。通过Chem3D Pro 软件进行转化为3D 结构保存为mol2 格式。UniProt 蛋白质资源数据(http://www.uniprot.org/)检索酿酒酵母α-葡糖苷酶的一级序列,访问代码为P53341。选择与靶标具有72.4%序列同一性的酿酒酵母异麦芽糖酶(PDB编码3AJ7,1.38Å 分辨率)的晶体结构作为建模模板[21]。使用Molecular Operating Environment(MOE)同源构建模型工具构建酿酒酵母α-葡糖苷酶的3D 结构。将酶蛋白和效应物能量最小化至0.05 RMS 梯度便于两者对接。构建的配体化合物和酶蛋白导入MOE 软件中同一窗口,通过Simulationdock 将酶和配体进行半柔性对接。对于每个配体,配体分子通过姿势的扭转形成多种构象,尽可能稳定的构象与酶活性口袋结合。筛选出最好配体构象与酶蛋白活性位点氨基酸残基的结合模式和相互作用,并使用可视化工具PyMol 程序显示两者结合的三维图像[22]。
2.5 数据处理
使用SPSS Statistics 17.0 软件进行数据统计,使用Origin Pro 8.5 软件绘制图形与分析。使用Chem3D Pro 软件转化3D 结构,使用Molecular Operating Environment(MOE)软件进行分子对接,使用PyMol 软件观察对接结果的结合模式。所有数据值均表示为“平均值±标准误差”。
3 结果与分析
3.1 效应物对α-葡萄糖苷酶的抑制作用
植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶均有抑制效果。效应物对酶的相对剩余酶活的抑制率随着效应物浓度的增加而降低,当植酸浓度达到0.195 mol/L 时,抑制率降低为71%,当抑制率降低到50%时,植酸的浓度(IC50)为(0.207±3.137)mol/L。L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶抑制酶活达到50%时,浓度为(0.39±0.00838)mmol/L。就IC50而言,L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶的抑制效果优于植酸。可能是由于L-抗坏血酸棕榈酸酯头部带有酚羟基的苯基更容易与α-葡萄糖苷酶结合。阿卡波糖对α-葡萄糖苷酶半数抑制率IC50为658 mmol/L,植酸的抑制效果没有阿卡波糖的效果好,然而L-抗坏血酸棕榈酸酯的抑制效果是阿卡波糖的上千倍。
3.2 效应物对α-葡萄糖苷酶的抑制机理
植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶抑制机理如图1所示。图中的曲线均交于原点,直线斜率分别随效应物浓度升高而降低。因此,2种效应物对α-葡萄糖苷酶均为可逆性抑制,效应物与酶以非共价键结合成可解离的复合物[23]。在该酶活体系的测定中虽然酶催化反应速率降低,但是没有减少有效酶量。
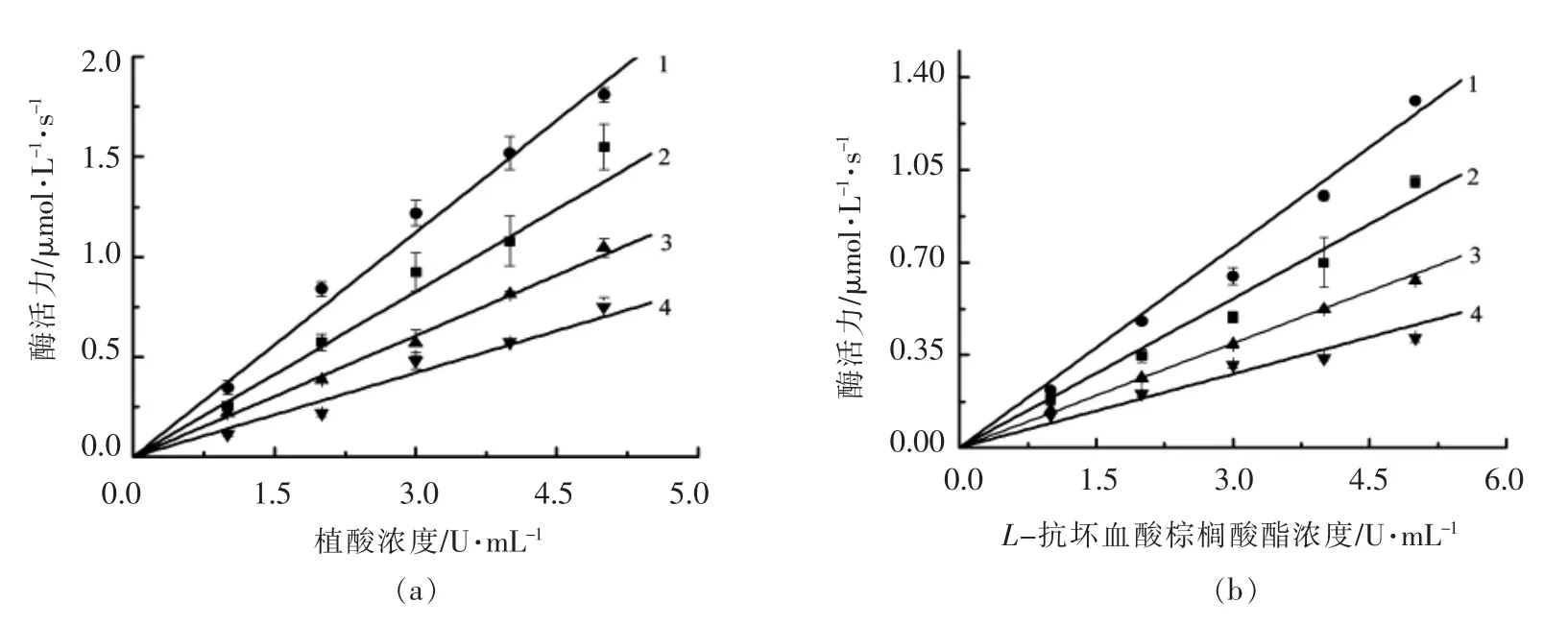
图1 植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶的抑制机理Fig.1 Determination of the inhibitory mechanism of phytic acid and L-ascorbyl palmitate on α-glucosidase
3.3 效应物对α-葡萄糖苷酶的抑制类型
植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶抑制类型如图2所示。图2a 所示,植酸的Lineweaver-Burk 图中直线1~4 相交于第Ⅱ象限,随着植酸浓度升高,米氏常数(Km)变大,最大反应速率(Vmax)降低,表明效应物植酸对α-葡萄糖苷酶是混合型抑制,具有竞争性抑制和非竞争性抑制2 种途径[24]。植酸既能与游离的酶结合,也能与酶-底物复合物结合。通过绘制Dixon 图计算抑制常数KI和KIS分别为KI=0.117 mol/L 和KIS=0.163 mol/L。由KI值小于KIS值,表明化合物与α-葡萄糖苷酶结合之外,主要形成ESI (效应物-酶-底物)复合物。
L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶抑制类型如图2b 所示,直线1~4 相交于第Ⅰ象限,非常接近Y 轴,随着L-抗坏血酸棕榈酸酯浓度升高,米氏常数(Km)变大,最大反应速率(Vmax)不变(变化轻微)[25],表明L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶是竞争型抑制,主要是与α-葡萄糖苷酶结合,抑制常数KI=0.202 mmol/L。
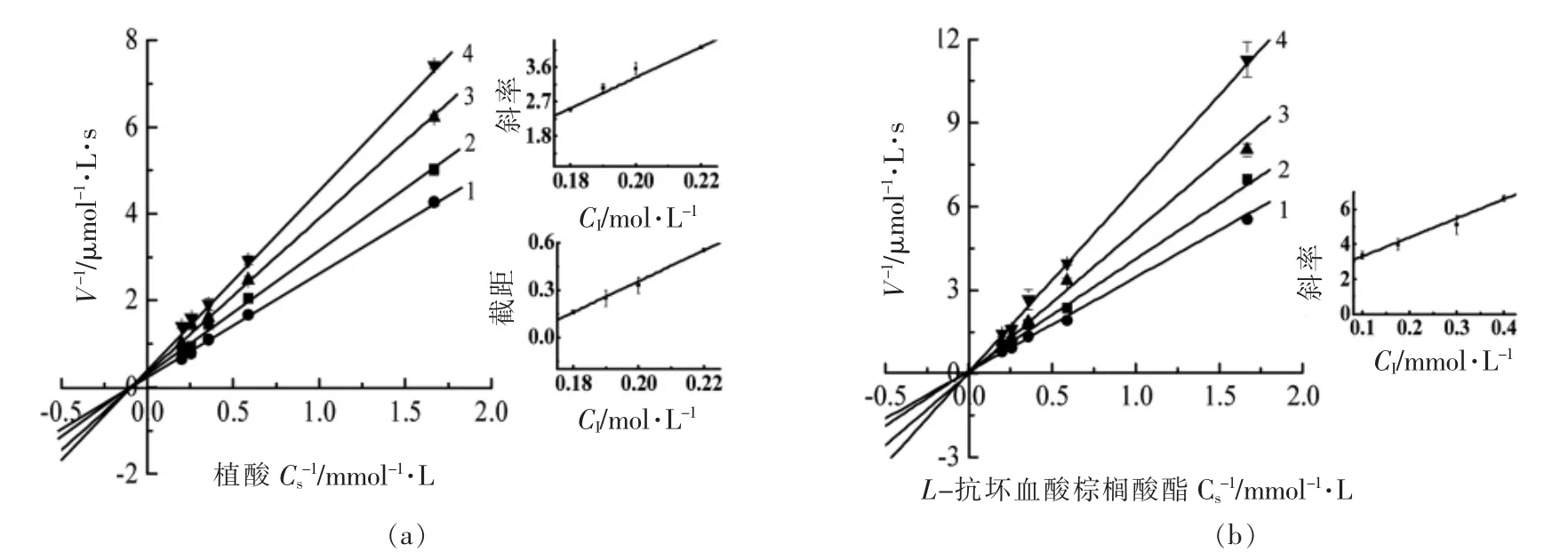
图2 植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶抑制类型及抑制常数Fig.2 Determination of the inhibitory type and inhibition constant of phytic acid and L-ascorbyl palmitate on α-glucosidase
3.4 分子对接结果
植酸与α-葡萄糖苷酶活性口袋的氨基酸残基相互作用如图3所示。如图3a 所示,植酸进入葡萄糖苷酶的活性口袋中,活性口袋周围重要的氨基酸 Phe303,Phe159,Val216,Leu219,Phe178是疏水性氨基酸,与活性口袋的形成有关,这与植酸进入活性口袋也有一定的影响。如图3b,3c 所示,植酸分子带有6 个磷酸根离子,所带的阴离子有利于与活性口袋周围带正电荷的氨基酸残基相互作用。配体分子植酸与α-葡萄糖苷酶活性口袋氨基酸残基Arg315,Arg442,Gln279 形成氢键。氢键是植酸与α-葡萄糖苷酶结合的关键作用[26]。此外,植酸与氨基酸残基Glu411,Gln353,Asp307,Glu277,Asp352,His351,Thr306,His280,Asn350,Tyr72,Tyr158 形成范德华力,形成的非共价键作用力(氢键和范德华力),在稳定植酸与α-葡萄糖苷酶复合物中起主要作用[27]。

图3 植酸与α-葡萄糖苷酶活性口袋的氨基酸残基相互作用Fig.3 Interaction of phytic acid with amino acid residues in the activity pocket of α-glucosidase
L-抗坏血酸棕榈酸酯与α-葡萄糖苷酶活性口袋的氨基酸残基相互作用如图4所示。由图4b,4c 可以看出,L-抗坏血酸棕榈酸酯的分子结构,一端为带有酚羟基的苯环,随后相连接的是较长碳链结构[28]。带有酚羟基苯环一端进入酶的活性口袋朝向氨基酸残基His315,Arg442,Arg446,Asp69,并与4 个氨基酸残基形成氢键。氢键形成的越多,配体分子与酶结合越稳定。整个配体分子进入酶的活性口袋中,由于碳链较长,进入活性口袋需要扭转和转变姿势及克服空间阻碍而消耗更多的能量。此外,配体分子L-抗坏血酸棕榈酸酯的尾部朝向Phe303,Phe159,Val216,Phe178 疏水性氨基酸,形成疏水相互作用。配体分子L-抗坏血酸棕榈酸酯与周围的氨基酸残基Tyr72,Gln279,Tyr158,Asp352,Asn350,Tyr347,Thr306,Glu277,Arg315,Glu411 形成范德华力。L-抗坏血酸棕榈酸酯与α-葡萄糖苷酶的活性口袋周围的氨基酸非常稳定的结合。
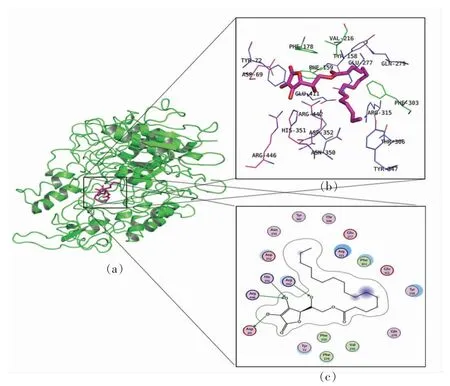
图4 L-抗坏血酸棕榈酸酯与α-葡萄糖苷酶活性口袋的氨基酸残基相互作用Fig.4 Interaction of L-ascorbyl palmitate with amino acid residues in the activity pocket of α-glucosidase
4 结论
抗氧化剂植酸和L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶均有抑制效果。植酸对α-葡萄糖苷酶半数抑制浓度为(0.207±3.137)mol/L,抑制类型表现为可逆混合型抑制。L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶的IC50值为 (0.39±0.00838)mmol/L,抑制类型为可逆竞争型抑制。植酸和L-抗坏血酸棕榈酸酯分别与α-葡萄糖苷酶活性口袋的氨基酸残基相互作用,形成氢键,疏水相互作用,范德华力等非共价相互作用。此结果与酶动力学的抑制机理的研究结果具有一致性。此外,针对2 种抗氧化剂对酶的抑制效果,与限定的添加量进行比较,L-抗坏血酸棕榈酸酯对α-葡萄糖苷酶表现出高效性,在作为α-葡萄糖苷酶抑制剂提供理论依据的同时,也为L-抗坏血酸棕榈酸酯的功能性应用提供了理论支撑。
