Nisin Z复配剂对常见食源性致病菌的协同抑菌作用
2021-05-15李津津徐春霞陶乐仁
李津津,匡 珍,徐春霞,迟 海*,陶乐仁
(1 中国水产科学研究院东海水产研究所 上海200090 2 福建省闽东水产研究所 福建宁德352100 3 上海理工大学医疗器械与食品学院 上海200093)
食品致病菌的污染和繁殖是食品安全的主要问题之一[1-2]。传统的食品抑菌方式主要通过超高压杀菌、辐射杀菌、热杀菌和添加其它生物抑菌剂等。然而,超高压杀菌、辐射杀菌、热杀菌等杀菌方式会对食品品质造成一定影响[3]。同时,生物抑菌剂和食品添加剂的过量添加与潜在残留也使消费者对食品安全产生担忧[4]。因此,急需寻求新型抑菌物质代替传统方法来确保食品安全。
乳酸菌细菌素是乳酸菌核糖体合成产生的一类对同种或亲缘关系较近的乳酸菌有抑制作用的抗菌肽[5]。它具有易酶解,无残留,抑菌高效等优点,成为近年来食品生物抑菌剂研发的热点。目前,乳酸链球菌素(Nisin)是唯一被FDA/WHO 认证并作为天然食品添加剂应用到食品贮藏和保鲜行业中的乳酸菌细菌素[6]。Nisin 在食品工业中的广泛应用主要是因其抑菌作用。相关研究显示,Nisin 主要是通过识别革兰氏阳性菌细胞膜上的脂膜II(Lipid II),从而传导其抑菌作用[7-8]。然而,由于革兰氏阴性菌与阳性菌细胞壁结构的差别,使得Nisin 对革兰氏阴性菌的抑制作用不明显。目前发现的Nisin 变体分为Nisin A/F/Q/Z/U/U2 等6种,其中应用到食品中的主要为Nisin A 和Nisin Z。Nisin A 和Nisin Z 的主要区别在于第27 位上的氨基酸不同,其中Nisin A 第27 位氨基酸序列为组氨酸,Nisin Z 为天冬氨酸[9],它们理化和抑菌性质基本上相似,都具有广泛的应用价值。
本研究基于前期对Nisin Z 的提取和优化结果(试验结果另刊发表),针对食源性致病菌残存和Nisin 对革兰氏阴性菌抑制作用不明显的问题,选取从贻贝中筛选的乳酸乳球菌K6 所产Nisin Z和其它抑菌物质为研究对象,探讨对常见食源致病菌的抑菌作用,如蜡样芽胞杆菌(Bacillus cereus)、单增李斯特菌(Listeria monocytogenes)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌 (Escherichia coli)、肠道沙门氏菌(Salmonella enterica)、副溶血性弧菌(Vibrio parahemolyticus),旨在达到可以使用最低的浓度抑制食源性致病菌生长的目的。同时,Nisin Z 与某些抑菌物质(食品添加剂)联用于食品中,可延长食品货架期。本试验中结果有望为食品生物抑菌剂的联合抑菌作用提供基础数据。
1 材料与方法
1.1 试验菌株
产Nisin Z 的乳酸乳球菌 (Lactococcus lacits K6)和其它常见的食源性致病菌,如蜡样芽胞杆菌(B.cereus DH2805)、单增李斯特菌(L.monocytogenes DH2813)、金黄色葡萄球菌 (S.aureus DH3022)、大肠杆菌(E.coli DH3704)、肠道沙门氏菌 (Sal.enterica DH8004)、副溶血性弧菌(V.parahemolyticus DH8005)由中国水产科学研究院东海水产研究所保存。
1.2 培养基与试剂
脑心浸出液培养基 (Brain heart infusion broth,BHI 培养基)、M17 乳酸培养基,青岛海博;胰蛋白胨、酵母膏,英国OXOID 公司;琼脂粉,上海蓝季科技发展有限公司;葡萄糖、EDTA 二钠、双乙酸钠、山梨酸钾、柠檬酸钠、硫酸铵、壳聚糖,国药(上海)化学试剂有限公司;茶多酚,浙江一诺生物科技有限公司;多粘菌素B、乳酸钠溶液,生工生物工程(上海)股份有限公司。
1.3 仪器与设备
Nano drop2000c 分光光度计,美国thermo 公司;TG16-WS 离心机,长沙湘智离心机仪器有限公司;酶标仪Power Wave XS,美国伯腾仪器有限公司;MIR-153 低温恒温培养箱,日本三洋(SANYO)电机公司;超净工作台SEX-TJ,上海整新电子设备;YXQ-LS-50 SII 立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;恒温振荡器CHA-S,国华电器有限公司;低温离心机CF 16RXII,日立(Hitachi)有限公司。
1.4 方法
1.4.1 Nisin Z 粗提物的制备 将乳酸乳球菌K6接种在1 L 的GM17 (M17 乳酸培养基肉汤中加0.5%的葡萄糖)中,置于30 ℃条件下过夜培养,将过夜培养后的菌液在10 000 r/min 条件下离心30 min。将离心后的上清液加入饱和浓度为45%(体积分数)的硫酸铵,振荡混匀后,置于4 ℃条件下静置不少于4 h。将静置后的混合液在10 000 r/min 条件下离心30 min,将离心后的沉淀加入20 mL 的无菌水溶解,并置于沸水浴条件下加热15 min,后冷却至室温,即得Nisin Z 的粗提物。
1.4.2 最小抑菌活性的测定 由乳酸乳球菌K6产的Nisin Z 和几种抑菌物质的单一最低抑菌浓度参考Wiegand 等[10]方法,利用96 孔板微量稀释法测定最小抑菌浓度。对照组的OD600nm值为0.4~0.5 时,开始记录,确定Nisin Z 及几种抑菌物质的单一抑菌浓度(Minimum inhibition concentration,MIC50)。Nisin Z 的抑菌浓度以细菌素单位BU(Bacteriocin union)表示。BU 定义为Nisin Z 粗提物在一定时间内(对照组OD600nm达到0.4~0.5 时)抑制200 μL 蜡样芽胞杆菌的最低用量。其它食品添加剂(茶多酚、柠檬酸钠等)的最大添加量遵照国标限定进行添加(表1)。
1.4.3 Nisin Z 复配剂联合最低抑菌浓度的测定根据1.4.2 节中Nisin Z 与几种抑菌物质的单一最低抑菌浓度,按照Semis 等[11]的方法,利用96 孔板微量稀释法测定Nisin Z 与几种抑菌物质两两联用时的抑菌效果(表2)。当对照组的OD600nm值为0.4~0.5 时,用酶标仪测定波长600 nm 下的OD值,确定Nisin Z 与几种抑菌物质两两联用的最低抑菌浓度。

表1 本试验中添加剂的最大添加剂量Table 1 Maximum additive amount of common additives
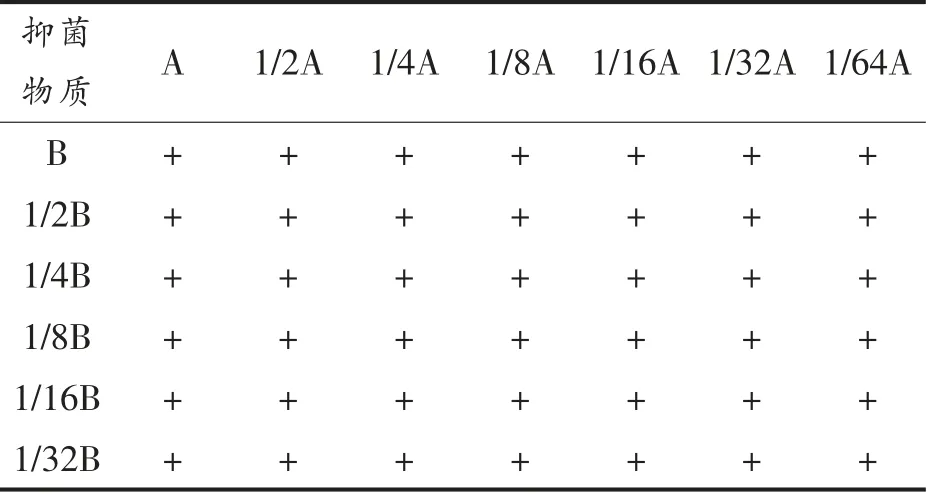
表2 Nisin Z 与抑菌物质的添加剂量Table 2 Maximum addition of nisin Z and inhibitory substance
1.4.4 协同效应的判定 根据1.4.3 节中获得的Nisin Z 与几种抑菌物质两两联用的最低抑菌浓度,参照Chi 等[4]的方法,来判定是否有协同抑菌效应。部分抑制浓度 (Fractional inhibition concentration,FIC)按式(1)计算。

式中,FIC——Nisin Z 与各种抑菌物质联用时的部分抑菌浓度指数;FICa——Nisin Z 与各种抑菌物质联用时,Nisin Z 的部分抑菌浓度指数;FICb——抑菌物质与Nisin Z 联用时,抑菌物质的部分抑菌浓度指数;MICa联用、MICb联用——Nisin Z与抑菌物质联用时的最低抑制浓度;MICa单独、MICb单独——Nisin Z 单独抑制指示菌时的最低抑制浓度;其中Nisin Z 的单位为BU/mL,多粘菌素B 的质量浓度用μg/mL 表示,其它抑菌物质的单位为mg/mL。
Nisin Z 与其它抑菌物质两两联用时,协同效果的判定按照Neu 等[12]提出的方法,通过FIC 值的计算,判定Nisin Z 与一种抑菌物质是否具有协同作用(0<FIC<0.5)、部分协同作用(0.5<FIC<1)、无协同作用(1<FIC<2)或拮抗作用(FIC>2)。
1.4.5 时间-杀菌试验 为进一步确定Nisin Z 与几种抑菌物质联用在不同时间内的协同抑菌效果。在4 只5 mL 的BHI 肉汤试管(编号为1,2,3,4)中,分别加入100 μL 过夜培养的指示菌,分别在2~3 号试管内加入MIC50的Nisin Z 和一种抑菌物质,4 号试管中加入最低抑菌浓度的抑菌物质与Nisin Z 的复配剂,不添加任何抑菌物质的1号试管作为空白对照组。将4 只试管放入恒温培养箱中,于30 ℃条件下培养,在不同时间段(0,2,4,6,9,12 h)分别从4 只试管中取出100 μL 菌悬液,梯度稀释后在相应的培养基上涂布,将涂布后的3 组平行样本在30 ℃条件下过夜培养,采用平板计数法测定活菌数。最后以时间为横坐标,细菌总数(Total viable count,TVC)的对数为纵坐标绘制时间-杀菌曲线。根据Pournaras 等[13]的研究,当Nisin Z 与抑菌物质混合时比单独使用抑菌物质/nisin Z 的抑菌效果更优,总活菌数的减少量≥2-lg 时,则说明Nisin Z 与该抑菌物质有协同抑菌作用。
2 结果与分析
2.1 最小抑制浓度
本试验分别测定了9 种抑菌物质与乳酸乳球菌K6 产生的细菌素Nisin Z 对6 种食源性致病菌的单一最低抑制浓度。结果表明,Nisin Z 对革兰氏阳性菌的最低抑菌浓度为5 BU/mL (蜡样芽胞杆菌)和10 BU/mL(金黄色葡萄球菌和单增李斯特菌),对革兰氏阴性菌(大肠杆菌和副溶血性弧菌)没有明显的抑菌效果(表3)。溶菌酶对检测的食源性致病菌的抑制效果不明显。相关研究显示,溶菌酶对革兰氏阳性菌的抑制作用优于革兰氏阴性菌[14],然而溶菌酶抑菌能力依靠浓度作用,这也可能是本试验中未发现明显抑制作用的原因。本试验中壳聚糖只对副溶血性弧菌有抑制作用(抑菌质量浓度为1.9 mg/mL),茶多酚只对金黄色葡萄球菌、副溶血性弧菌和大肠杆菌有抑菌作用,多粘菌素B 只对革兰氏阴性菌有抑菌作用,且抑菌浓度均较低(0.4~0.9 μg/mL),其它4 种食品添加剂对检测的食源性致病菌均有抑制作用。为拓宽Nisin Z 的抑菌谱,使其不仅能抑制革兰氏阳性菌,还能较好地抑制革兰氏阴性菌,因此选择其它几种抑菌物质与Nisin Z 进行联用。
2.2 Nisin Z 与抑菌物质联用的抑菌结果
利用棋盘法探讨Nisin Z 和几种抑菌物质联合使用对6 种食源性致病菌的抑制效果 (表4)。试验结果表明Nisin Z 与EDTA 二钠联用,对试验中被测的所有食源性致病菌都有协同抑菌作用,同时Nisin Z 的添加量降为单独抑制时的1/64倍,EDTA 的添加量为原来单独使用时的1/25 倍。这可能是由于EDTA 二钠作为螯合剂对细菌外壁的作用,使其结构松散,造成Nisin Z 可以专一性识别受体,从而传导抑菌作用,这一结果也与目前的研究结果一致[15-16]。Nisin Z 与双乙酸钠联用对副溶血性弧菌没有明显抑制效果,对其它革兰氏阳性细菌(蜡样芽孢杆菌、单增李斯特菌、金黄色葡萄球菌)的FIC 值分别为0.22,0.43,0.32,这说明Nisin Z 与双乙酸钠联用时,具有明显的协同抑菌效果,同样的协同效果也在大肠杆菌和肠道沙门氏菌中发现(FIC 值分别为0.40,0.37)。Nisin Z与柠檬酸钠联用对革兰氏阳性菌(蜡样芽孢杆菌、单增李斯特菌、金黄色葡萄球菌)有明显的协同抑菌效果,FIC 值分别为0.23,0.31,0.41。然而,Nisin Z 与柠檬酸联用对革兰氏阴性菌没有明显协同抑菌效果。Nisin Z 与山梨酸钾联用,只对单增李斯特菌和大肠杆菌有协同抑菌作用。Nisin Z与多粘菌素B 联用对革兰氏阴性菌(大肠杆菌、肠道沙门氏菌、副溶血性弧菌) 分别有协同抑菌效果,对革兰氏阳性菌(蜡样芽胞杆菌、单增李斯特菌、金黄色葡萄球菌)没有协同抑制作用。
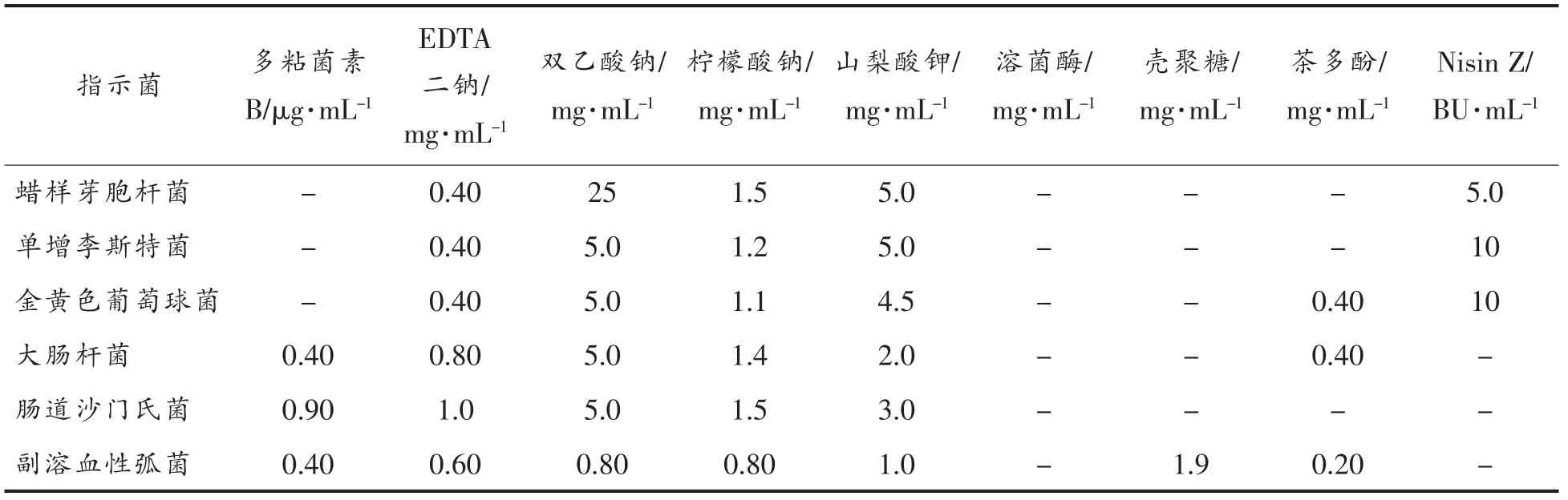
表3 抑菌物质与Nisin Z 单独最低抑菌浓度Table 3 MICs of inhibitory substances and nisin Z work alone
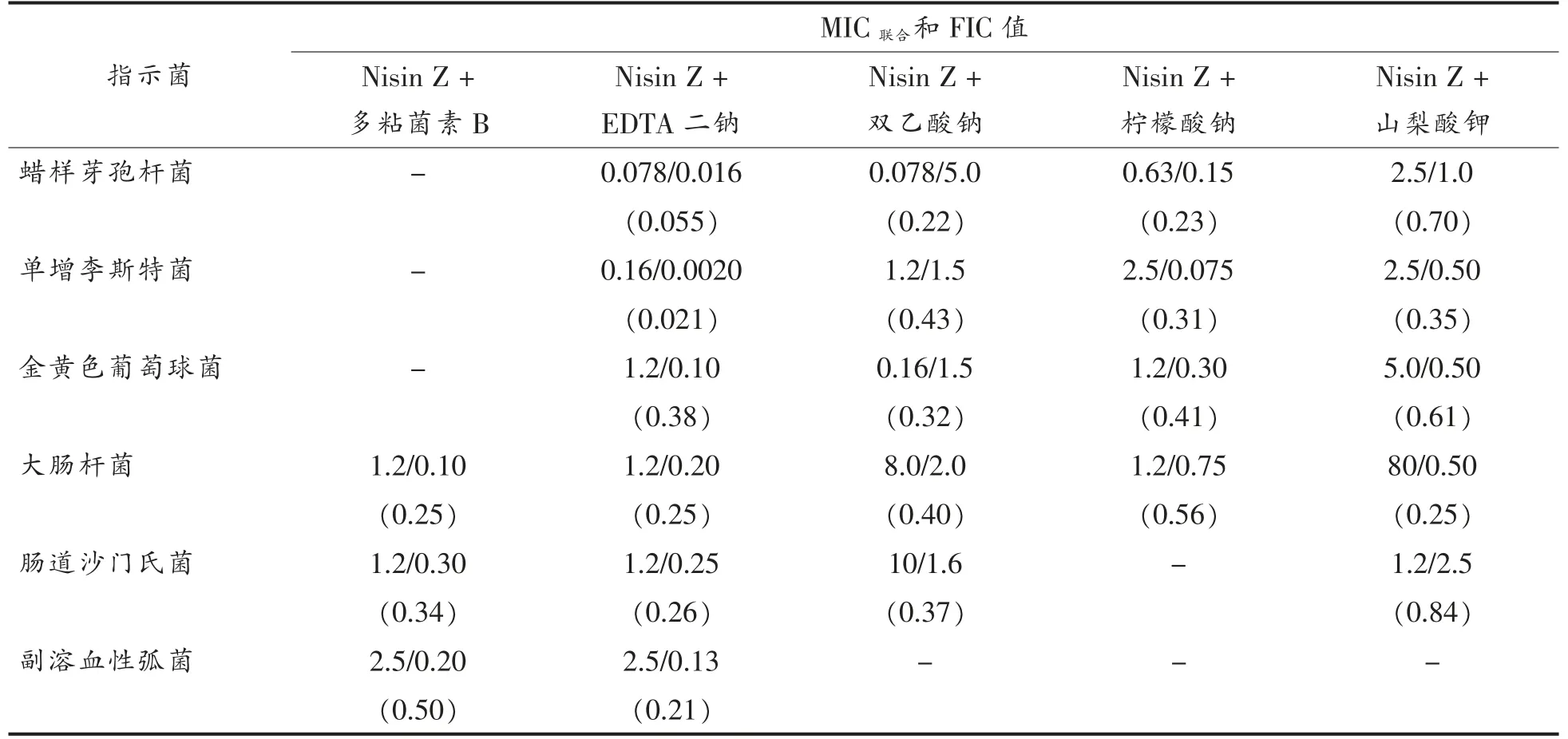
表4 Nisin Z 与几种抑菌物质联用的最低抑菌浓度和FIC 值Table 4 MIC combination and FICs of nisin Z and other antimicrobial substances
2.3 时间-杀菌试验
图1和图2分别为Nisin Z 与双乙酸钠对蜡样芽胞杆菌和金黄色葡萄球菌的时间-杀菌曲线。结果显示,Nisin Z 单独抑制蜡样芽胞杆菌2805的抑菌浓度为5 BU/mL 时,与对照组相比(只加了蜡样芽胞杆菌2805) 活菌数在4~6 h,9 h 和12 h分别减少了2.2 左右个对数值、0.9 个对数值和2.7 个对数值;单独使用25 mg/mL 双乙酸钠时,总活菌数在2 h 和4 h 分别减少了4.5 个对数值和4.62 个对数值;在6~12 h,双乙酸钠能完全抑制蜡样芽胞杆菌的生长;Nisin Z(0.078 BU/mL)与双乙酸钠(0.016 mg/mL)联用,分别在4 h 和6~12 h 总活菌数分别减少<2-lg,结果表明Nisin Z 与双乙酸钠抑制蜡样芽胞杆菌不具有协同抑菌作用。
由图2可知,Nisin Z(10 BU/mL)单独抑制金黄色葡萄球菌3022,在检测时间内细菌总数与空白组相比分别减少了1.14,1.14,0.57,0.41,1.68个对数值;双乙酸钠(5 mg/mL)单独抑制金黄色葡萄球菌,在检测时间内细菌总数与空白组相比分别减少了1.14,1.65,1.83,2.34,2.40 个 对数值;Nisin Z(0.16 BU/mL)与双乙酸钠(15 mg/mL)联合使用,细菌总数与空白组相比减少量小于2 个对数值,这说明Nisin Z 与双乙酸钠联合抑制金黄色葡萄球菌时协同作用不太明显,而单独使用双乙酸钠时,抑菌效果优于二者联合使用的效果。
本试验中Nisin Z 与双乙酸钠对蜡样芽孢杆菌和金黄色葡萄球菌出现的拮抗作用可能由于双乙酸钠呈碱性,Nisin Z 与双乙酸钠联合时pH 值升高,降低了Nisin Z 的活性。江芸等[16]已经证实了在相同温度下,pH 值越高,抑菌能力降低。此外,路遥[17]研究发现,Nisin Z 的活性受侧链氨基酸极性的影响,双乙酸钠添加可能影响Nisin Z 侧链氨基酸的极性,从而造成Nisin Z 的活性降低。同样的研究结果也显示,pH 值的变化会导致Nisin Z 的抑菌活性降低[18]。
图3是Nisin Z 与山梨酸钾对单增李斯特菌的时间-杀菌曲线。结果显示Nisin Z(10 BU/mL)单独抑制单增李斯特菌时,在作用时间内总活菌数减少量均大于2 个对数值 (分别为4.06,3.99,4.09,6.69,6.75 个对数值),这说明Nisin Z 对蜡样芽胞杆菌表现出显著的抑菌效果;山梨酸钾(5 mg/mL)单独抑制单增李斯特菌的抑制效果不太明显;Nisin Z(2.5 BU/mL)与山梨酸钾(1 mg/mL)联合抑制单增李斯特菌,作用4 h 和6 h 后,细菌总数降低小于2 个对数值,作用9~12 h 后,协同抑制效果不太明显。
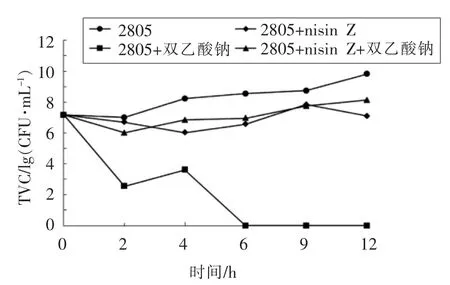
图1 Nisin Z 与双乙酸钠对蜡样芽胞杆菌的时间-杀菌曲线Fig.1 Time-killing curve of nisin Z and sodium diacetate against B.cereus
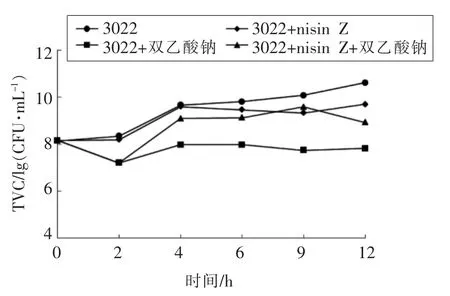
图2 nisin Z 与双乙酸钠对金黄色葡萄球菌的时间-杀菌曲线Fig.2 Time-killing curve of nisin Z and sodium diacetate against S.aureus

图3 Nisin Z 与山梨酸钾对单增李斯特菌的时间-杀菌曲线Fig.3 Time-killing curve of nisin Z and potassium sorbate against L.monocytogenes
Nisin Z 与山梨酸钾联用对单增李斯特菌没有明显的协同抑菌效果。可能由于一些钠盐或者钾盐作用于单增李斯特菌时,会导致单增李斯特菌的不同应激反应,导致其细丝的形成,或者参与糖酵解活性基因的下调,使之存活下来[19]。Nisin Z与山梨酸钾联合作用没有Nisin Z 单独抑制效果好,可能由于联合作用时,Nisin Z 的浓度较低导致。
由图4可知,Nisin Z(80 BU/mL)单独抑制大肠杆菌3704 未显示明显抑制效果;多粘菌素B(0.4 μg/mL)单独抑制大肠杆菌2 h 后,细菌总数减少3.79 个对数值,4 h 后可以完全抑制大肠杆菌的生长;Nisin Z (1.25 BU/mL) 与多粘菌素B(0.1 μg/mL)联合抑制金黄色葡萄球菌在2 h 内能完全抑制,2~6 h 内抑制效果慢慢减弱,6 h 后复合抑菌剂对大肠杆菌的抑制趋于平稳,细菌总数减少4.5 左右个对数值。说明Nisin Z 与多粘菌素B联合抑制大肠杆菌时,在3 h 内是具有协同效应的,而后协同效应不太明显,然而仍然能很好地抑制大肠杆菌。
由图5可知,Nisin Z(160 BU/mL)单独抑制肠道沙门氏菌的抑制效果不明显;EDTA 二钠(1 mg/mL)单独抑制肠道沙门氏菌,在2~9 h 内的抑制效果优于 Nisin Z(1.25 BU/mL)与EDTA 二钠(0.25 mg/mL)联用的效果,9 h 后复合抑菌剂对肠道沙门氏菌的抑制作用要高于两者单独使用的抑制效果,到12 h 时复合抑菌剂组与对照组相比,细菌总数减少了2.3 个对数值。
Nisin 对革兰氏阴性菌没有明显的抑制作用,主要是由于革兰氏阳性菌和革兰氏阴性菌的细胞壁不同,位于外膜的脂多糖是革兰氏阴性菌的主要表面分子。多粘菌素B 对革兰氏阴性菌的抑菌作用主要是通过其与脂质带负电荷的磷酸基团相互作用进入细菌的外表面,从而使细胞膜电位失衡死亡[20]。而Nisin 稳固了革兰氏阴性菌外膜的通透性屏障[21]。本试验中3 h 内Nisin Z 与多粘菌素B 有协同作用,这与Chi 等[4]研究结果一致。这可能是因为多粘菌素B 破坏了大肠杆菌的外膜结构,增强了Nisin Z 对大肠杆菌的抑菌作用,后来Nisin Z 自身接触大肠杆菌稳固了其膜结构,使多粘菌素B 对其抑制作用减弱。也有可能是多粘菌素B 与Nisin Z 联合作用时,多粘菌素B 的浓度较单独抑制时较低,并不能完全抑制大肠杆菌的生长。此外,由Nisin Z 与EDTA 二钠联合抑制肠道沙门氏菌的杀菌曲线可以看出,两者联用有协同作用,这与杨晓韬等[22]的研究结果一致。也有类似研究发现Nisin Z 单独抑制沙门氏菌时效果不明显,这是由于革兰氏阴性菌的膜结构不同,对防腐剂有一定的阻碍作用,所以对Nisin Z 不太敏感,而EDTA 二钠是金属螯合剂,可以改变阴性菌的外膜通透性,同时,Nisin Z 通过作用于细菌内膜的脂质II 分子,使细菌细胞质内小分子物质流出,从而使其对革兰氏阴性菌产生作用[23]。Nisin Z与部分抑菌物质联用降低了两者的使用量,增强了对食源性致病菌的抑菌效果,拓宽了Nisin Z 的抑菌范围,这将使Nisin 在食品行业中具有很大的应用前景。
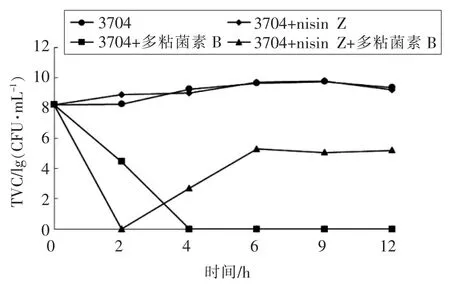
图4 Nisin Z 与多粘菌素B 对大肠杆菌的时间-杀菌曲线Fig.4 Time-killing curve of nisin Z and polymyxin B against E.coli
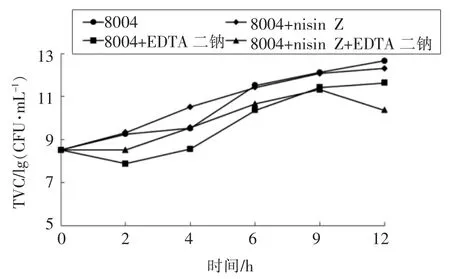
图5 Nisin Z 与EDTA 二钠对沙门氏菌的时间-杀菌曲线Fig.5 Time-killing curve of nisin Z and EDTA disodium against Salmonella enterica
3 结论
本文利用Nisin Z 及其它抑菌物质对食源性致病菌的抑菌效果进行研究。试验结果显示Nisin Z 对革兰氏阳性菌(蜡样芽孢杆菌、金黄色葡萄球菌、单增李斯特菌)有良好的抑菌效果,对革兰氏阴性菌抑菌(大肠杆菌、沙门氏菌、副溶血性弧菌)效果不明显,而多粘菌素B、EDTA 二钠、山梨酸钾、柠檬酸钠、双乙酸钠对革兰氏阴性菌有抑菌效果。
使用棋盘法,通过FIC 计算判断Nisin Z 与几种抑菌物质的协同抑菌效应。结果发现Nisin Z 与EDTA 二钠联用对蜡样芽孢杆菌的协同效果远远大于Nisin Z 与其它抑菌物质联用的协同抑菌效果,Nisin Z 的添加量降为单独抑制时的1/64 倍,EDTA 的添加量为原来单独使用时的1/25 倍。
Nisin Z (0.078 BU/mL) 与双乙酸钠(0.016 mg/mL)联用抑制蜡样芽孢杆菌,在4~6 h,与对照组相比,Nisin Z 与双乙酸钠不具有协同作用;Nisin Z(2.5 BU/mL)与山梨酸钾(1 mg/mL)联用对单增李斯特菌没有明显的抑菌增强效果,即协同作用不太明显;Nisin Z(0.16 BU/mL)与双乙酸钠(15 mg/mL)联用抑制金黄色葡萄球菌的协同作用不太明显,而单独使用双乙酸钠时,抑菌效果优于二者联合使用的效果;Nisin Z(1.25 BU/mL)与多粘菌素B(0.1 μg/mL)联合使用抑制大肠杆菌,3 h内具有协同效应,而后协同效应不太明显;Nisin Z(1.25 BU/mL)与 EDTA 二钠(0.25 mg/mL)联用,对肠道沙门氏菌有协同抑菌效果。
