两种木霉对陇南花椒根腐病病原菌的拮抗作用研究
2021-05-15田凤鸣何九军卓平清
田凤鸣,陈 强,何九军,卓平清
( 1.陇南师范高等专科学校 农林技术学院,甘肃 陇南 742500;2.陇南特色农业生物资源研究开发中心,甘肃 陇南 742500)
由腐皮镰刀菌(Fusariumsolani(Mart)Sscc.)引起[1]的花椒根腐病会导致根系的腐烂,叶片变小、枝条发育不全,最终导致全株枯死,严重影响到花椒产量和品质,给陇南的花椒经济造成了巨大的损失.
木霉菌在植物病害防治中具有非常重要的作用,是一种资源非常富有的拮抗微生物,目前研究中发现,木霉至少对18个属29种病原真菌具有很好拮抗作用[2].在抗生作用中,木霉对病原菌的拮抗是通过产生有害的化学物质进行的,例如一些酶类和抗生素[3].木霉菌可以防治多种植物的病害,如玉米纹枯病、甜瓜根腐病[4].但对防治陇南花椒根腐病的报道很少,本文为再次明确绿色木霉和哈茨木霉对花椒根腐病的拮抗作用,拟通过平板对峙培养实验、木霉发酵液的抑菌活性的检测,研究两种木霉菌对引起花椒根腐病主要病原菌茄腐镰孢菌的拮抗效果,为进一步开发复合木霉菌制剂防治花椒根腐病提供理论依据.
1 材料与方法
1.1 材料
1.1.1 供试菌株
由本实验室从陇南武都区花椒种植基地采样,从典型的花椒根腐病病株中分离获得,通过致病性实验和分子检测结果显示:陇南花椒根腐病的主要致病菌为茄腐镰孢菌(Fusariumsolani),将分离获得的病原菌保存于4℃冰箱,拮抗试验时接种于PDA培养基中活化使用.绿色木霉和哈茨木霉分别由陇南师专微生物实验室提供.
1.1.2 供试培养基
PDA培养基的制备:去皮的马铃薯200 g,马铃薯切小块沸水中煮30 min,四层纱布过滤,滤液中依次加入葡萄糖20 g,琼脂15 g~20 g,定容至1000 mL,分装后高压灭菌21 min后倒平板.
1.2 试验方法
1.2.1 平板对峙法
以本实验分离获得的陇南花椒根腐病病原菌茄腐镰孢菌为指示菌,用6 mm的打孔器将指示菌打成菌饼接种在PDA培养基的中央,将两种木霉菌和复配后的木霉菌分别等距离接种在病原菌的四周,点接处距离病原中心2 cm,培养5 d后计算木霉菌对病原菌的抑制率.
抑制率=(对照病原菌的直径-处理组病原菌直径)/对照组病原菌直径×100%.
1.2.2 木霉菌对病原菌前端菌丝的影响
将1.2.1中的试验平板放置于体视显微镜(放大倍数为7X-180X)下,观察单一木霉菌和复配木霉菌对病原菌前端菌丝的影响.
1.2.3 木霉菌的对花椒根片和根部的离体拮抗实验
木霉菌和病原菌孢子液的制备:将病原菌和木霉菌分别接种在PDA培养基中培养3 d~5 d,加入适量的无菌水冲洗提前培养好的孢子并对其进行过滤,制成1.0×106个/mL浓度的孢子液.
木霉复配孢子液的制备:将绿色木霉和哈茨木霉按照1∶1的比例混合,制成复配孢子液浓度为:1.0×106个/mL.
花椒主根根片的离体拮抗实验:取新鲜花椒主根经75%的酒精消毒后,用无菌单面刀片切成3 mm~5 mm的薄片,在无菌水中漂洗至少3次,按照品字形放置于提前铺好无菌滤纸的培养皿中,为保持湿度,提前在培养皿的滤纸中加入8 mL的无菌水,分别在根片中接入100 μL的绿色木霉孢子液、100 μL的哈茨木霉孢子液培养、100 μL的木霉复配孢子液,然后再接入100 μL的病原菌孢子液,28℃恒温培养5 d后,观察木霉菌对花椒根腐病病原菌的拮抗作用.
花椒根部侧根的离体拮抗实验:取大小相似的新鲜花椒侧根,经75%的酒精消毒后,在无菌水中漂洗至少3次,用无菌滤纸吸干侧根部位的水分,(每培养皿侧根数目为5)放置于提前铺好无菌滤纸的培养皿中,为保持湿度,提前在培养皿的滤纸中加入8 mL的无菌水,分别在根片中接入100 μL的绿色木霉孢子液、100 μL的哈茨木霉孢子液培养、100 μL的木霉复配孢子液,然后再接入100 μL的病原菌孢子液,28℃恒温培养5 d后,观察木霉菌对花椒根腐病病原菌的拮抗作用.
1.2.4 复配木霉菌无菌发酵滤液抑菌活性的稳定性
复配无菌发酵液的制备:分别将绿色木霉和哈茨木霉接种于液体PDA培养基中,在28℃ 150 rpm/min 培养7 d后,收集发酵液,发酵液用0.22 μm 无菌滤膜过滤,再将2种木霉的发酵液按照体积比1∶1混合,存于4℃冰箱备用.
复配发酵液对病原菌的抑制作用:将10 mL 复配发酵滤液与40 mL PDA 培养基(冷却至60℃)混合均匀后倒平板,将打孔器打成的6 mm的病原菌菌饼接种于平板中央,以无菌水(10 mL )与 PDA(40 mL)培养基混合均匀倒平板为对照. 在28℃恒温培养5 d后,采用十字交叉法测量菌落直径,计算复配木霉发酵液对花椒根腐病病原菌菌丝的抑制,每种条件下的试验重复3次.
(i)pH对复配木霉菌无菌发酵液抑菌活性的影响
为了检测复配发酵液对pH的稳定性,本次试验中将木霉菌的复配发酵液的pH值分别调至1、3、5、7、9、11、13七个不同的梯度,以初始pH=6.8为空白对照组,再按照1.2.4中复配发酵液对病原菌的抑制作用的方法进行最适pH的研究.
(ii)温度对复配木霉菌无菌发酵液抑菌活性的影响
为了检测复配发酵液对温度的稳定性,本次试验中将木霉菌的复配发酵液的温度分别设置至0、20、40、60、80、100℃六个不同的梯度,分别处理30 min,室温平衡10 min,再按照1.2.4中复配发酵液对病原菌的抑制作用的方法进行最适温度的研究,每个处理重复3次.
2 结果
2.1 病原菌和木霉菌的活化
将备用的花椒根腐病病原菌茄腐镰孢菌、哈茨木霉、绿色木霉接种于PDA培养基中,培养3 d~5 d后备用. 腐镰孢菌(见图1(a),哈茨木霉(见图1(b),绿色木霉(见图1(c).

图1 病原菌和木霉菌
2.2 木霉菌对病原菌的拮抗效果
按照1.2.1中的平板对峙法研究了木霉菌对病原菌菌丝抑制的影响,实验结果表明:哈茨木霉和绿色木霉单独使用均对花椒病原菌的生长有抑制作用,培养5 d后,对照病原菌菌落直径可达60 mm(见图2(a)),有绿色木霉拮抗菌的病原菌直径为22 mm(见图2(b)),抑制率可达63%;有哈茨木霉拮抗菌的病原菌直径为20 mm(见图2(c)),抑制率可达67%; 有木霉(哈茨木霉∶绿色木霉以1∶1复配)拮抗菌的病原菌直径为7 mm,抑制率可达88%.此试验结果说明:复配后的木霉菌抑菌效果显著优于单一木霉菌的抑菌效果.

图2 木霉菌对病原菌的拮抗效果
2.3木霉菌对病原菌前端菌丝生长的影响
显微镜下观察了木霉菌对病原菌前端菌丝生长的影响:对照病原菌的菌丝前端菌丝生长粗细均匀,浓密,蓬松,无扭曲变形,延伸性好,呈放射状(图3(a));接种了单一和复配木霉拮抗菌的病原菌菌丝的生长都不同程度地受到限制, 由图3(b)、3(c)、3(d)可知:木霉菌的菌丝缠绕在病原菌茄腐镰孢菌的菌丝上,使得病原菌菌丝失去很好的延伸性,扭曲变形,粗细不均匀,菌丝变的稀薄且变短,弯曲生长,后期木霉菌直接可在病原菌菌落中生长,逐渐将病原菌消除瓦解,病原菌菌丝生长的受限可能与木霉代谢产物中的有害物质有关,复配木霉菌对病原菌菌丝生长的抑制程度显著高于单一木霉菌.
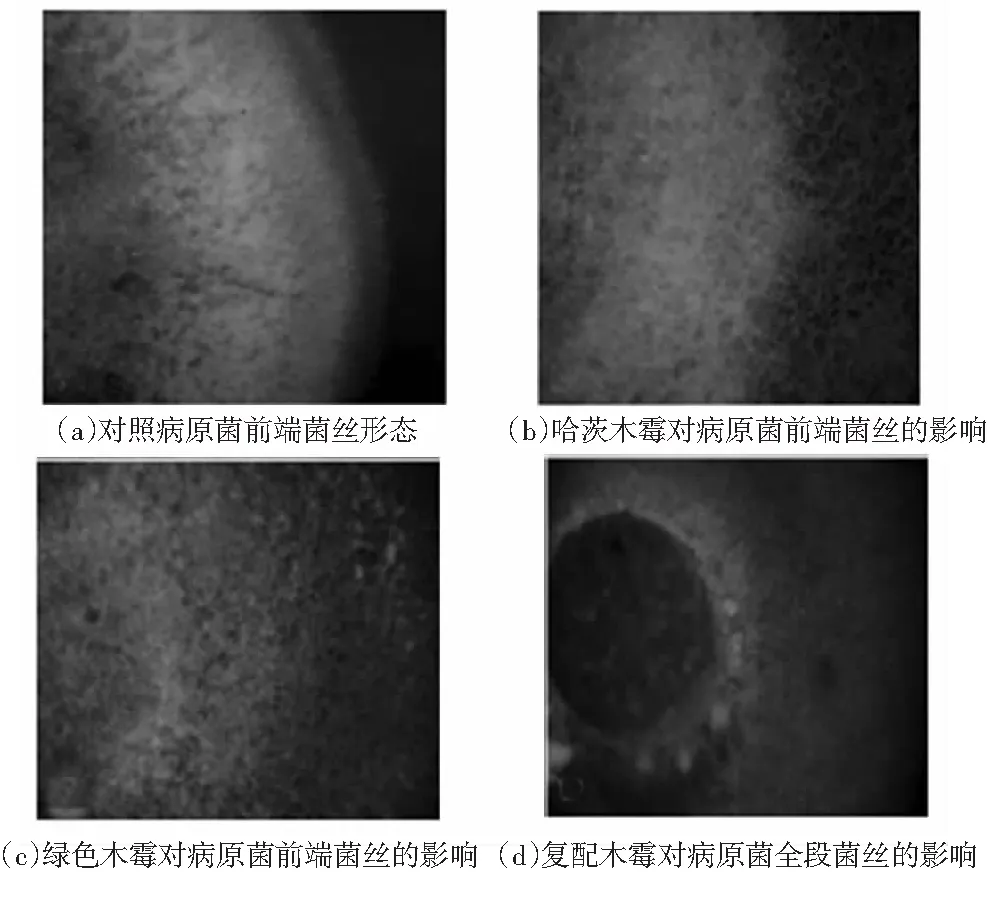
图3 木霉菌对病原菌前端菌丝的抑制效果
2.4 木霉菌对花椒主根根片的离体拮抗实验
为进一步明确复配木霉菌的拮抗效果优于单一木霉菌的拮抗效果,本试验进行了花椒主根根片的离体回接,实验结果表明:接种无菌水的主根根片保持原有的色泽,根皮与木质部未发生分离,无任何的气味,也无液体流出(图4(a)),接种了病原菌的根片颜色发黑,根皮与木质部分离,周围流出棕褐色液体,有股异臭味,木质部变软易分离(图4(a)),接种了单一木霉菌和复配木霉菌的根片也有不同程度的发病,接种了单一木霉菌的根片发病颜色呈深褐色,也伴有异臭味,根皮和木质部分离(见图4(c)、4(d)),但接种了复配木霉菌的根片颜色明显较浅,根皮和木质部未发生完全的分离,木质部依然保持坚硬不易分离.离体回接试验说明复配木霉菌的防治效果优于单一木霉菌.
2.5 木霉菌对花椒侧根的离体拮抗实验
为再次明确复配木霉菌在花椒根腐病病原菌中的防治效果,将单一木霉菌和复配木霉菌接入花椒侧根进行离体试验,结果说明(图5可知):有复配木霉菌存在的发病的花椒侧根颜色明显比有单一木霉菌存在的发病的花椒侧根颜色较浅,而接种了病原菌的花椒侧根3 d后就开始发病,根部变黑变软、接种了木霉菌的侧根会延迟发病或是不发病,本离体实验为后期复配木霉菌在花椒根腐病上的防治应用提供了可靠的基础.

图5 木霉菌对花椒侧根侵染病原菌的拮抗作用
2.6 复配木霉菌无菌发酵滤液抑菌活性的稳定性
2.6.1 pH值对复配木霉菌无菌发酵液抑菌活性的影响
由图6可知,偏酸偏碱环境对复配木霉发酵液的抑菌活性都有影响,在pH为7时抑菌活性达到最高,可达69%.
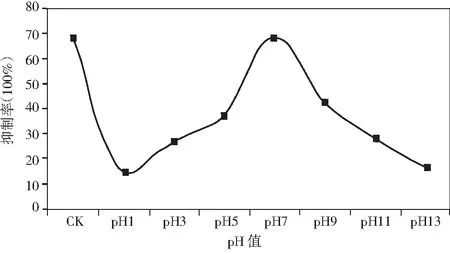
图6 pH值对复配木霉发酵液抑菌活性的影响
2.6.2 温度对复配木霉菌无菌发酵液抑菌活性的影响
由图7可知,经不同梯度的温度检测,复配木霉无菌发酵液对热稳定性较差,高于40℃的温度不利于发酵液产生较好的活性,在20 ℃~40 ℃之间此发酵液均具有良好的抑菌活性,抑菌率可达67%.

图7 温度对复配木霉发酵液抑菌活性的影响
3 结论
植物病害的真菌生防制剂中木霉生防制剂在防治中占60%以上[5],处理种子、处理土壤、喷施叶片等方面被广泛应用[6].
木霉菌在植物病虫害的防治中,病原菌的生长受木霉菌的抑制,同时木霉菌有利于植物生长,还能在化学农药方面减少使用,这样生态环境更有利于受到保护.
经研究发现,2种以上的机制同时或顺序作用才会使木霉菌产生良好的拮抗作用[7].木霉菌的协同增效能力是基于多机制性的结果.哈茨木霉菌与杀菌剂协同使用时的抑制率大于两者单独使用,能够很好地抑制番茄灰霉病[8];在张婧迪等[9]研究中,发酵代谢物(深绿木霉菌CCTCC-SWB0199)按照一定比例与芸苔素内酯复配,在番茄灰霉病中的防治效果优于二者单独使用.
本文通过平板对峙实验、菌丝前端形态的观察实验、花椒主根和侧根的离体回接实验再次明确了哈茨木霉和绿色木霉对花椒根腐病病原菌的拮抗作用,单一菌株的接种和复配菌株的接种实验说明:复配木霉菌株的拮抗效果显著高于单一菌株的拮抗效果,复配菌株接种后,抑制率可达88%.
复配木霉菌株对根腐病病原菌的前端菌丝具有很好的抑制作用,几乎完全抑制了病原菌菌丝的延伸,这与木霉有着极强的适应性相关,木霉在生长方面竞争性优于病原菌,通过竞争根际的空间和养分,从而削弱病原菌的生长,此结论与本实验结果相一致[10].在离体回接实验中复配木霉菌株也表现出了良好的拮抗作用,接种了复配菌株的主根根片和侧根的发病症状相对于接种病原菌的根片和侧根无论在色泽、气味、坚硬程度、根皮与木质部的分离状态等方面都有所缓减,此试验结果为后期花椒根腐病在大田中的防治提供了很好的理论基础.
后期又对复配木霉发酵液的稳定性作了检测,实验结果表明:发酵液在pH为7、温度在20 ℃~40 ℃的范围内表现出很好的抑菌活性,抑制率分表可达:69%和67%.尽管发酵液在一定的条件下具有很好的稳定性,但其抑菌活性不及接种复配木霉菌时的抑菌活性,此实验结果可能与发酵液的浓度有关,在后续的实验中会对如何提高发酵液的浓度做进一步的研究.本实验仅仅在实验室中进行了相关的实验,后续会将其应用于大田中,为后期花椒根腐病的有害防治奠定重要的基础.
