鸡源大肠杆菌的分离鉴定及药敏分析
2021-05-15王欣宇吕雪峰邵洪泽
王欣宇,吕雪峰,任 锐,邵洪泽
(吉林省畜牧兽医科学研究院,吉林长春130062)
鸡大肠杆菌病是由大肠埃希氏菌(Escherichia coli)引起的一种细菌性传染病,不同种类及日龄的鸡群均可感染。感染后的主要症状为精神沉郁、腹泻、关节肿胀、气囊炎、肝周炎、心包炎、败血症等[1]。鸡大肠杆菌病会造成产蛋鸡产蛋率下降、雏鸡发育不良等现象,是养鸡业的常见病和高发病,还可继发其他疫病。致病性大肠杆菌拥有众多血清型。引起鸡大肠杆菌病的血清型主要为O1、O2、O18、O78[2]。同一血清型中不同的菌株无交叉免疫保护性,难以通过疫苗进行保护。多数养殖场通过抗菌药物对大肠杆菌进行控制。抗生素一直以来是防控细菌病的首选药物,随着各种抗生素在动物养殖生产中的泛用和滥用,大肠杆菌的耐药性不断增强、耐药谱变宽及多重耐药菌株层出不穷,给大肠杆菌病的防治带来困难[3]。2020年,本研究室先后在吉林省长春市周边地区分离出数个典型病例菌株,采用微生物鉴定、PCR 分类鉴定及药敏试验对分离菌株进行敏感药物筛选,以期更好地掌握其流行病学特点及耐药情况,为养殖生产过程中的用药提供指导。
1 材料与方法
1.1 样品与试剂
1.1.1 病料
病料取自吉林省长春市,死亡鸡剖检症状疑似大肠杆菌感染,无菌采取病鸡的肝脏、心脏等器官,装于自封袋中密封,4 ℃冰箱保存备检。
1.1.2 试剂
血琼脂培养基、大肠杆菌显色培养基、革兰氏染色液、肉汤培养基均购自郑州博赛生物技术股份有限公司;药敏纸片购自杭州微生物试剂有限公司;革兰氏阴性菌鉴定板购自赛默飞世尔科技有限公司。
1.1.3 仪器
显微镜、电泳仪购自北京六一生物科技有限公司;凝胶成像系统购自Bio-Rad公司;高速离心机、PCR扩增仪、麦氏比浊仪、AIM全自动菌液接种仪均购自赛默飞世尔科技有限公司。
1.2 细菌分离鉴定
无菌条件下取病死鸡的肝脏、脾脏、心包液接种于血琼脂培养基。37 ℃恒温箱培养24 h,用接种环挑取菌落形态明显的单菌落,划线传代培养,纯化后挑取菌落形态明显的单菌落进行革兰氏染色,显微镜下观察细菌形态及生物学特性。挑取单个典型菌落划线接种于大肠杆菌鉴定培养基中37 ℃增殖培养24 h,观察其培养特性。
1.3 分离菌株生化试验
挑取分离菌株培养物加入无菌玻璃管,用麦氏比浊仪调其浊度达到0.5 麦氏比浊标准,此时菌液浓度约为1×108CFU/mL。用全自动菌液接种仪将菌液接种于革兰氏阴性菌鉴定板内,37 ℃培养18 h,然后用ARIS 2X 全自动微生物鉴定及药敏分析系统[Thermo Scientific(赛默飞世尔)]进行生化特性检测。
1.4 致病性分型鉴定
1.4.1 引物设计
根据肠致病性大肠埃希氏菌(EPEC)、肠产毒性大肠埃希氏菌(ETEC)、肠侵袭性大肠埃希氏菌(EIEC)、肠出血性大肠埃希氏菌(EHEC)和肠集聚性大肠埃希氏菌(EAEC)[4]对应毒力基因设计引物,由吉林省库美生物公司合成,引物具体信息见表1。

表1 引物序列Tab.1 Primer sequences
1.4.2 PCR扩增
粗提法提取经过生化鉴定为大肠埃希氏菌的菌液DNA,用表1 合成的引物对分型基因进行PCR 扩增,扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35 个循环;72 ℃延伸10 min。配制2.5%浓度琼脂糖凝胶,取5 μL扩增产物于加样孔中,同时加入2000 bp DNA Marker,120 V电泳40 min,凝胶成像系统观察并记录结果。
1.5 进化分群鉴定
采用Clermont 等[5]所建立的四重PCR 检测方法,依据arpA、chuA、TspE4.C2和YjaA基因设计合成4 对引物见表2,采用四重PCR的方法鉴定大肠杆菌。PCR反应体系:2×SuperFi ⅡGreen PCR Master Mix 25 μl、上下游引物各1 μL、DNA 模板2 μL、加Nuclease-Free Water 至50 μL。PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火10 s,72 ℃延伸30 s,共30 个循环;72 ℃延伸5 min。配制1%浓度琼脂糖凝胶,取5 μL扩增产物于加样孔中,同时加入2000 bp DNA Marker,120 V电泳30 min,凝胶成像系统观察并记录结果。依据Clermont 等[5]建立的分群方法:B2群:chuA+、YjaA+;D 群:chuA+、YjaA-;B1群:chuA-、TspE4+.C2+;A群:arpA对本试验的菌株进行分群分析。

表2 引物序列Tab.2 Primer sequences
1.6 分离菌株药敏试验
使用液体培养基将试验用菌株培养制备成细菌悬液,细菌浓度约为108CFU/mL。取100 μL 菌悬液,无菌操作选用一次性涂布棒均匀涂布于平板培养基中,37 ℃恒温箱中放置30 min,待菌液充分吸收,取出平板,将平板倒置,在背面用记号笔将平板划分成面积相等的5部分并标记。在无菌条件下,将小镊子置于酒精灯火焰中灼烤灭菌,夹出6个滤纸片,分别置于标记好的5部分及中心位置,等间距放置且有规律,将平板置于37 ℃恒温箱箱培养24 h,观察结果并用游标卡尺测量纸片周围抑菌圈直径,参照药敏试验标准进行结果判定。
2 结果与分析
2.1 分离菌株培养特性(见图1、图2)
由图1 可知,菌落在血琼脂培养基上形成比较大的灰白色菌落、多数不透明或边缘轻微透明、菌落表面湿润、有特殊酸臭味。由图2可知,大肠杆菌显色培养基上显现出蓝绿色菌落、边缘整齐、光滑湿润形态。
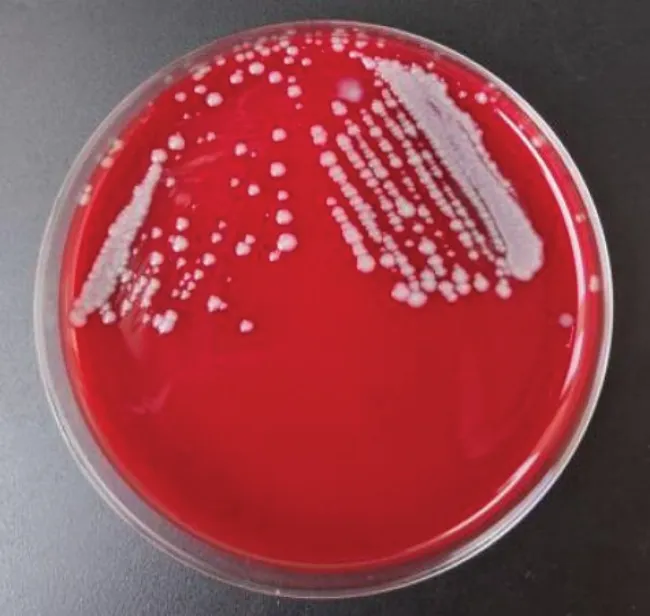
图1 血琼脂培养菌落形态Fig.1 Colony morphology of blood culture medium
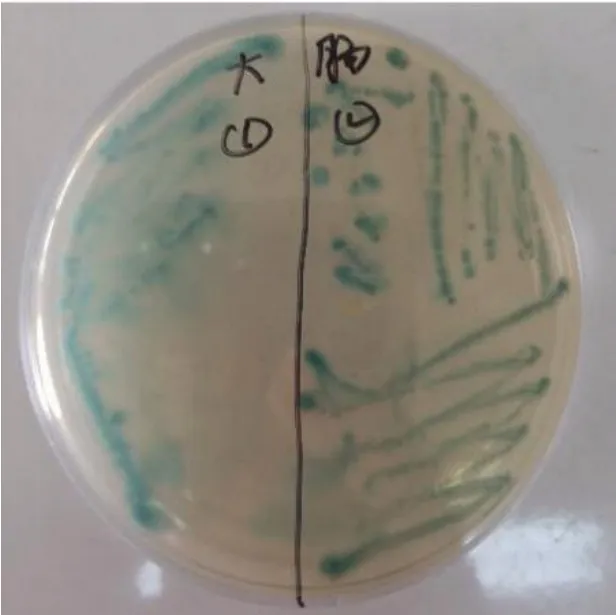
图2 大肠杆菌显色培养基菌落形态Fig.2 Colony morphology of Escherichia coli chromogenic medium
2.2 菌株染色镜检结果(见图3)
由图3 可知,分离菌株革兰氏染色镜检显示为粉红色的两端钝圆短小杆菌,符合大肠杆菌的染色特点。
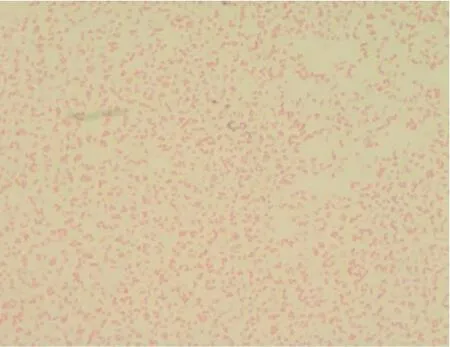
图3 菌株革兰氏染色镜检Fig.3 Gram staining microscopic examination of strains
2.3 菌株生化试验结果(见表3)
由表3可知,分离菌能发酵山梨醇、木糖、麦芽糖、阿拉伯糖、棉籽糖,符合《伯杰细菌鉴定手册》中大肠杆菌生化反应特性,由此可判定分离菌株为大肠埃希氏菌。
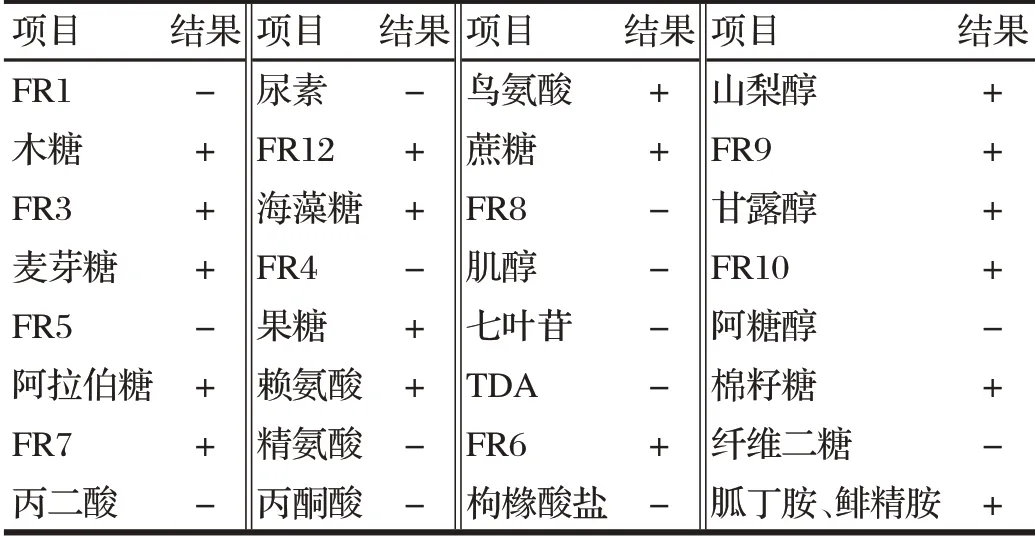
表3 菌株生化鉴定结果Tab.3 Results of biochemical test of strains
2.4 菌株致病性分型鉴定结果(见图4)
由图4可知,PCR产物经过凝胶电泳可以观察到488、322、254 bp 的stx、elt、agg R特异性电泳条带,根据毒力基因可知,分离菌株主要为肠产毒性大肠埃希氏菌(ETEC)、肠侵袭性大肠埃希氏菌(EIEC)、和肠集聚性大肠埃希氏菌(EAEC),ETEC 检出4 株,占比57%(4/7);EIEC 检出4 株;占比57%(4/7);EAEC检出1株;占比14%(1/7),未检出肠致病性大肠埃希氏菌(EPEC)和肠出血性大肠埃希氏菌(EHEC)。
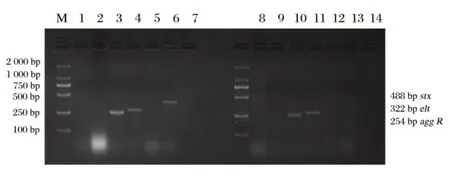
图4 致病性分型PCR鉴定结果Fig.4 PCR product of diarrheagenic Escherichia coli
2.5 菌株进化分群鉴定结果(见图5)
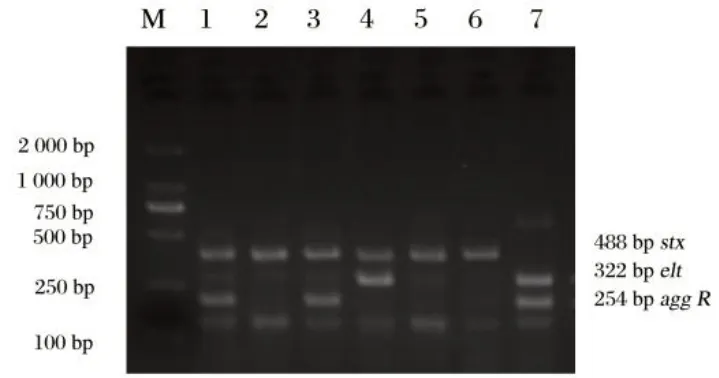
图5 大肠杆菌的多重PCR分群Fig5 Multiplex PCR clustering of Escherichia coli
由图5可知,PCR产物经过凝胶电泳可以观察到400、288、211 bp 的arpA、chuA、YjaA特异性电泳条带,进行PCR条带比对,确定致病性大肠杆菌菌株的系统进化分群结果为B2群1 株,占14.3%(1/6);其余6 株为A 群,占85.7%(6/7)。
2.6 菌株药敏试验结果(见表4)
由表4可知,对临床上经常使用的抗菌药物如青霉素、红霉素、氧氟沙星等表现出极强的耐药性;本次分离出的鸡大肠杆菌病仅对大观霉素敏感性较高,卡那霉素次之。
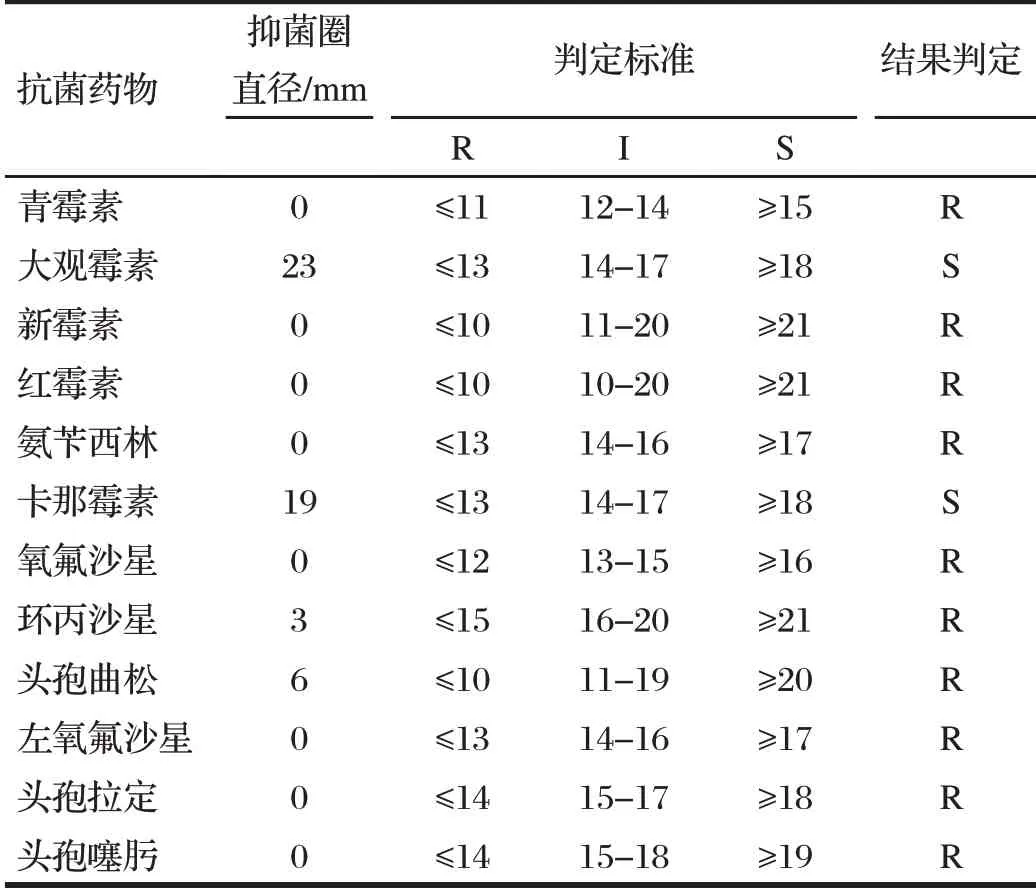
表4 药敏试验结果Tab.4 Results of antimicrobial test susceptibility test
3 讨论
通过细菌分离培养、菌落形态观察及微生物鉴定,确定分离到的菌株为大肠埃希氏菌。致病性分型结果表明,本次分离的吉林省长春市菌株主要以ETEC和EIEC为主,同时还有少量的EAEC。肠产毒性大肠杆菌是一类能侵染小肠上皮细胞的病原菌,能够在细胞上定植和增殖,并产生肠毒素。肠毒素是由质粒或染色体编码的,具有热敏感或热不稳定的特点[6]。肠侵袭性大肠杆菌是一类具有强致病毒力的病原菌,主要引起水样腹泻和痢疾。但本研究的分型鉴定结果及分离率和我国以往的大肠杆菌流行病学研究不一致,可能是由于在不同地域和其他因素的作用下,致病性大肠杆菌在动物体内的分离率也有变化。
药敏试验表明,分离菌株对青霉素、氧氟沙星、环丙沙星、氨苄西林等多种抗生素产生耐药性;只对大观霉素、卡那霉素敏感,与张青青等[7]、于静晨等[8]等报道一致,说明临床中禽源大肠杆菌的耐药情况较为严重。由于临床抗生素的泛用、乱用导致大肠杆菌多重耐药性,有必要根据药物筛选结果选择最敏感的药物,盲目滥用只会导致耐药性进一步加重。
致病性大肠杆菌在不同动物体内按不同比率分布,大肠杆菌系统进化群可以分为4个群:A、B1、B2、D,依靠出现arpA、chuA、yjaA基因和TspE4.C2非编码区区分。鸡源大肠杆菌主要出现在A群和D群。本试验85.7%的A群检出率与之前研究中结果相一致[9],一定程度上说明我省禽致病性大肠杆菌在系统进化分群上的特点。
大肠杆菌病作为养禽业的常见疫病,以预防为主,由于养殖过程中青霉素等抗生素药物的广泛使用,导致大肠杆菌对其产生较强的耐药性,饲料中添加的喹乙醇及氯霉素等也加剧耐药菌株的产生[10]。本研究中,菌株对大观霉素、卡那霉素敏感可以为吉林省鸡源大肠杆菌的防治提供参考。
4 结论
吉林省内的鸡源致病性大肠杆菌多以A型为主,且具有多重耐药性,可以尝试使用大观霉素、卡那霉素治疗鸡大肠杆菌病。
