鹅星状病毒RT-PCR 检测方法的建立
2021-05-15刘英姿李阁锦曹祁峰王家英舒秀伟周铁忠高慎阳
李 阳,刘英姿,李阁锦,曹祁峰,王家英,舒秀伟,周铁忠,高慎阳*
(1. 锦州医科大学畜牧兽医学院,辽宁锦州121000;2. 辽宁益康生物股份有限公司,辽宁辽阳111000)
星状病毒(astroviruses,AstV)为单股正链、无囊膜的RNA病毒,根据感染宿主的不同将其划分为两个不同的病毒属,即哺乳动物星状病毒和禽星状病毒[1]。禽星状病毒基因组全长6.9~7.9 Kb[2]。基因组包括5'UTR ORF1a、ORF1b 和ORF23 个开放阅读框及3'UTP、多聚腺苷酸(PolyA)尾[3]。
2016年初,我国山东、江苏、河北、江西、广东、安徽、河南等省鹅场陆续发生雏鹅高致死性痛风病,严重威胁我国养鹅业的发展。鹅痛风病主要侵害15日龄以内的雏鹅,各品种的鹅均易感,发病高峰在10日龄前后,临床上可致雏鹅生长发育受阻、精神沉郁、采食量减少、关节肿大,甚至死亡。死亡率可达30%~40%,饲养管理条件差的最高可达50%左右,尸检可见全身各脏器的严重尿酸盐沉积,尤以心、肝和肾较为严重[4-6]。研究表明,鹅星状病毒是该次疫病的主要病原体[4]。目前,该病尚无商用化特效药以及疫苗。防治该病的方法主要为降低饲料的蛋白质含量、钙磷比例及抗菌抗毒的治疗。该病的传播速度快、致死率高。因此,该病的防治在于对疾病的监测和控制,建立一种快速、准确、廉价的检测方法对该病的防控尤为重要。
RT-PCR 检测方法具有检测快速、操作简便、特异性强和敏感度高等特点。本研究根据Genbank 中GAstV 的ORF1b 保守序列,设计1 对特异性引物,建立GAstV 的RT-PCR检测方法,为GAstV的快速诊断和流行病学的研究提供参考。
1 材料与方法
1.1 样本采集
试验检测用病料来自辽宁省营口市某鹅场,为因雏鹅痛风而发病死亡的雏鹅心脏、肝脏、肾脏等组织。样品采用Chu 等[7]的方法检测为GastV 阳性后由本实验室保存。
1.2 试验试剂
病毒基因组DNA、RNA 提取试剂盒、质粒小提试剂盒、DH5α 感受态细胞、琼脂糖、DNA 胶回收试剂盒购自TIANGEN;pMD18-T 载 体、DL2000 DNAmarker 购 自TaKaRa;反转录试剂盒购自成都福际生物技术有限公司;2×ES Taq MasterMix、ddH2O购自北京康为世纪生物科技有限公司;鸡病毒性关节炎活疫苗(ZJS 株)购自广东温氏大华农生物有限公司;鹅细小病毒小鹅瘟二联活疫苗(P1株+D株)、鸭呼肠孤病毒活疫苗(CA株)、坦布苏病毒活疫苗(FX2010-180P株)购自易邦生物工程有限公司。
1.3 引物设计与合成
根据GenBank 登录的GAstV 病毒株(MN428642.1)ORF1b阅读框碱基序列,利用Oligo 7.0软件设计1对特异性引物GAstVF/R,预期扩增片段为329 bp,PCR 特异性引物见表1,由生工生物工程(上海)有限公司合成。

表1 PCR特异性引物Tab.1 The specific primers of PCR
1.4 重组质粒标准品的制备
对本实验室保存的阳性GAstV病料进行RNA提取以及反转录,以获得的cDNA为模板与特异性引物GAstVF/R进行PCR 扩增,产物经凝胶琼脂糖电泳鉴定后,按照司广斌等[8]的方法将目的片段进行回收、纯化、克隆。构建pMD18-T-GAstV 重组质粒。通过Thermo nanodrop one测定质粒浓度,按照拷贝计算公式(质粒浓度ng/L×6.02×1023)/(109×基因组长bp×660),计算重组质粒拷贝数。
1.5 RT-PCR方法的建立
PCR反应体系为30 μL,见表2。

表2 PCR反应体系Tab.2 The reaction system of PCR
PCR 反应程序:94 ℃预变性5 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸45 s,35 个循环;72 ℃延伸10 min。
1.6 特异性试验
以提取的GPV、DRV、AVAV、TMUV 的cDNA 为模板,同时设置阴性对照(ddH2O)及阳性对照(GAstV),验证该方法的特异性。
1.7 敏感型试验
将质粒原液进行10-2~10-8倍稀释后分别作为模板,确定该方法的敏感性。将质粒浓度换算成拷贝数,测得最底检出限。
1.8 重复性试验
选取3个不同批次的阳性样品,每个样品3个重复,进行3次重复测定,验证该方法的可靠性。
1.9 模拟临床样品检测
构建10 份人工模拟病料进行检测限LOD 分析,样品依次加入十倍系列(10-1~10-10)浓度稀释的阳性质粒,使用RNA、DNA 提取试剂盒进行提取,利用本试验建立的RTPCR 方法进行检测,以实验室保存的GAstV 作为阳性对照。PCR产物以1.5%琼脂凝胶电泳检测。
2 结果与分析
2.1 重组质粒标准品的鉴定(见图1)
以重组质粒pMD18-T-GAstV 为模板,进行PCR 扩增。由图1 可知,质粒与阳性对照目的片段一致,表明pMD18-T-GAstV重组质粒构建正确。

图1 重组质粒标准品鉴定结果Fig.1 The results of recombinant plasmid reference
2.2 特异性试验结果(见图2)
用本研究建立的RT-PCR 方法分别对几种临床常见禽病病原(GPV、DRV、AVAV、TMUV)进行特异性检测。由图2 可知,仅GAstV 出现特异性扩增条带,其他病原及阴性对照均未出现任何条带。表明该方法具有良好的特异性。

图2 引物特异性试验结果Fig.2 The results of specificity detection of the primers
2.3 敏感性试验结果(见图3)

图3 RT-PCR方法的敏感性试验结果Fig.3 The results of conformity test of RT-PCR
将质粒原液进行10-2~10-8倍稀释后分别作为模板,利用本研究建立的RT-PCR 方法进行检测。由图3 可知,通过Thermo nanodrop one 测定重组质粒浓度为43.7 ng/μL,根据公式换算成拷贝数1.21×1010copies/μL。测得该方法最低检测限可达1.21×103copies/μL。
2.4 重复性试验结果(见图4)
选取3 个不同批次阳性样品,每个样品进行3 次重复性检验。由图4可知,扩增产物亮度、位置无明显差异,表明该方法重复性很稳定。

图4 RT-PCR重复性试验结果Fig.4 The results of repeatability test of RT-PCR
2.5 模拟临床样品检测结果(见图5)
将10 份人工模拟样品进行DNA 提取后,用本研究建立的RT-PCR 方法进行检测。由图5 可知,最低检出限LOD为1.21×103copies/μL。
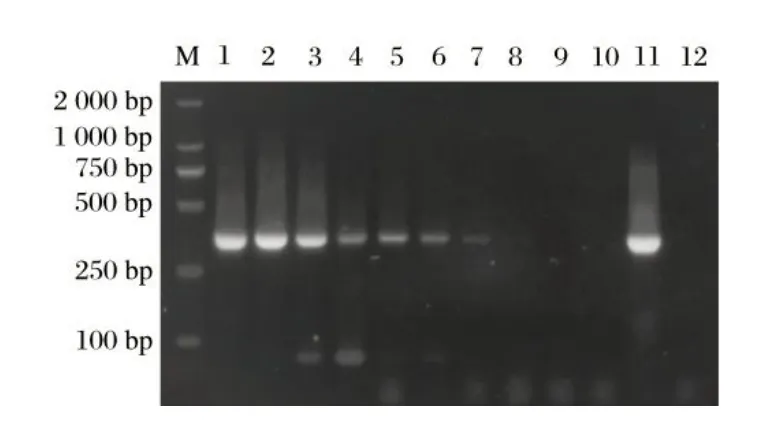
图5 模拟临床样品检测结果Fig.5 The results of artificial samples panels
3 讨论
2016年,全国爆发高致死雏鹅痛风病,给我国养鹅业带来严重的影响。禽痛风是由于尿酸产生过多或排泄障碍,引起的大量尿酸盐堆积在皮下、组织、关节的一种营养代谢性疾病[9]。研究表明,鹅痛风病主要是饲喂过量高蛋白、高钙饲料引起的[10]。有学者在患病鹅体内分离出星状病毒,确定了真正病因[11]。由于鹅痛风病的2 种致病因素症状类似,凭借临床症状和病理变化很难进行区分,给现场检疫带来困难,所以需要检测人员进行实验室诊断。基于TaqMan探针法检测GAstVd的qRT-PCR方法已经建立和应用[12],该方法特异性强,但受限于探针的合成以及qPCR仪器过于昂贵、操作复杂,不适用于基层常规实验室检测。张玉霞等[13]建立了环介导等温扩增技术(LAMP)检测方法对GAstV进行检测,该方法能在恒温条件下快速扩增核酸,但是受限于试剂盒和酶的价格,加大检测成本,不适用于大量临床样品检测。为控制GAstV 疫情的流行和减少养鹅产业的损失,需要设计一种省时、可以大量检测、廉价、操作简单,且适用于常规实验室以及基层检测部门的方法。在实验室检测中,RT-PCR 是最常用的检测方法,通过对核酸进行检测确定病毒的感染。该方法一直应用于多种动植物病毒的检测[14-16]。该方法简便、易操作、检测迅速、价格低廉,可用于大量临床样品的检测,适用于基层常规实验室进行检测。
本研究比对GAstV ORF1b 基因保守区域设计出一对特异性引物,建立一种用来检测GAstV 的RT-PCR 方法。通过对其他几种常见禽病进行特异性检测,结果显示,扩增出单一特异性条带与预期目的片段大小一致,确定该方法有良好的特异性。经敏感性试验结果显示,本研究建立的方法LOD 可达1.21×103copies/μL,确定该方法有良好的敏感性。本研究中,重复性试验的条带大小、亮度均一致,确定该方法有良好的重复性;模拟临床样品检测试验中,最低检出限为1.21×103copies/μL。
4 结论
本研究建立的RT-PCR 方法特异性强、敏感的高、重复性好、成本低廉、操作简单、可进行大量检测,适用于实验室对GAstV的病因进行快速检测,为基层检测部门对疫情进行监测提供有效手段,同时为后续建立一种恒温、快速检测方法提供参考。
