虫草素的抑菌活性及机理研究
2021-05-14高苏马婕馨刘警鞠赵国柱
高苏 马婕馨 刘警鞠 赵国柱
(北京林业大学生物科学与技术学院,北京 100083)
核苷类抗生素是由核苷和核苷酸衍生而来的一类微生物天然产物,由于核苷和核苷酸在大多数细胞代谢中起着重要的作用,因此核苷类抗生素表现出了广泛的生物活性[1-2]。目前已经从微生物来源的发酵液中发现了多种核苷化合物,其中的一些核苷化合物如脂西霉素、多毒素等能有效抑制真菌和细菌细胞壁的生物合成,是良好的核苷抑制剂[3-4]。天然产物的生物活性丰富且结构复杂多变,因此从天然产物中筛选开发新型的核苷类抗菌物质是解决菌株耐药性的一个重要思路。
虫草素又称3′-脱氧腺苷,1951年首次从蛹虫草的发酵液中分离获得[5],具有抗菌[6]、抗氧化[7]、抗炎[8]、抗肿瘤[9]、溶血栓降血脂[10]、免疫调节[11]等广泛的药理作用。同时虫草素也是从虫草中分离得到的第一个核苷类抗菌素,对梭状芽孢杆菌等细菌表现出了良好的抑菌效果,对其结构进行修饰后能有效抑制炭疽杆菌、链球菌、鼻疽杆菌等病原菌的生长[12-13]。在我国蛹虫草2009年已被批准为新资源食品(2014改为新食品原料)[14],被广泛栽培食用,其核心成分虫草素也被用于开发食品、药品、保健品等。虫草素虽被报道具有抗菌作用,但对不同细菌的抗菌谱还不完善,对G+菌及G-菌抑菌效果的差异尚未见报道,抑菌机制缺乏深入研究。本文在前期蛹虫草液体发酵提取虫草素的基础上,以枯草芽孢杆菌等3种常见的G+菌及大肠杆菌等3种常见的G-菌为对象,从抑菌圈、生长曲线、最低抑制浓度、胞内紫外吸收物质泄露和细胞损伤角度,研究虫草素对其生长影响、抗菌谱、抑菌效果及抑菌机理,旨为虫草素的深度开发应用奠定理论基础。
1 材料与方法
1.1 材料
供试菌株:蛹虫草(Cordyceps militaris YCC-W)由中国科学院真菌学国家重点实验室提供;G+:枯草芽孢杆菌(Bacillus subtilis BS-1)、金黄色葡萄球菌(Staphylococcus aureus SA-1)、苏云金芽孢杆菌(Bacillus thuringiensis BT-1),G-:大肠杆菌(Escherichia coli EC-1)、铜绿假单胞菌(Pseudomonas aeruginosa PA-1)来源于北京林业大学微生物学实验室;G-:肠沙门氏菌(Salmonella enteritidis SE-1)由中国普通微生物菌种保藏管理中心提供,保藏编号为CGMCC1.10603。
实验试剂:酵母粉、蛋白胨、氯化钠、琼脂粉购自北京易秀博谷生物科技有限公司;磷酸盐缓冲液、乙酸异戊酯、戊二醛、无水乙醇购自北京蓝弋化工产品有限责任公司。
实验仪器:HZC-250全温振荡培养箱(苏州培英实验设备有限公司);752型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);SPX-250 生化培养箱(上海龙跃仪器设备有限公司);冷冻干燥机(北京博医康实验仪器有限公司);LC-20A高效液相色谱仪(岛津企业管理(中国)有限公司);SU-8010场发射扫描电子显微镜(日本日立有限公司)。
1.2 方法
1.2.1 培养基的配制及供试菌株的活化 种子液培养基(g/L):蔗糖20,蛋白胨20,磷酸二氢钾1,七水硫酸镁0.5。
发酵培养基(g/L):葡萄糖20、鱼蛋白胨20、磷酸氢二钾0.5、七水硫酸镁0.5、硫酸锰0.5。
LB培养基(g/L):酵母粉5,胰蛋白胨10,氯化钠10;固体培养基另补加琼脂粉16。
PDA培养基(g/L):葡萄糖20,马铃薯200,琼脂粉16。
菌株的活化:将蛹虫草菌种接种在PDA培养基上,于21℃生化培养箱中避光培养10 d。用无菌接种环将供试细菌划线接种到LB斜面试管中,37℃培养24 h。
1.2.2 虫草素的制备
1.2.2.1 蛹虫草种子液的制备 从活化菌种中挑取约1 cm2的菌块接种于装有100 mL种子液培养基的250 mL三角瓶中,以26℃、130 r/min于培养箱中培养84 h。
1.2.2.2 蛹虫草发酵液的制备 将种子液以4%接种量接种于液体发酵培养基中,24℃培养25 d,先150 r/min震荡培养3 d后静置培养至25 d,过滤收集发酵液。
1.2.2.3 虫草素的分离纯化 将发酵液浓缩后冷冻干燥得冻干粉,加入适量纯甲醇充分混匀后4℃过夜,9 500 r/min离心5 min后,减压浓缩上清液至液体浑浊,加入少量蒸馏水,继续浓缩至甲醇全部蒸出,于4℃过夜。抽滤后向粗结晶中加入与浓缩后等体积的预冷蒸馏水,混匀后于4℃过夜,再次抽滤并重复操作至沉淀颜色呈白色,将沉淀冷冻干燥即得虫草素,经HPLC检测纯度为94.26% ± 0.31%。
1.2.3 最低抑菌浓度(minimal inhibitory concentration,MIC)的测定 参照Moreira等[15]的方法并稍作修改。采用二倍稀释法将高浓度虫草素溶液进行稀释,使其在培养基中的终浓度分别为10、5、2.5、1.25、0.625 mg/mL。以无菌的LB培养基作为对照组溶剂,取20 μL处于对数期(105-106CFU/mL)的上述6种供试细菌分别加入到2 mL含有系列浓度虫草素的LB培养基中,震荡混匀后37℃恒温培养24 h,观察实验组培养液浊度与对照组浊度无差别即为虫草素对该细菌的MIC。
1.2.4 抑菌圈(diameter of inhibitory zone,DIZ)的测定 参照Sharma等[16]的方法并稍作修改。取20 μL处于对数期的上述6种供试菌加入到30 mL未凝固的LB培养基中,混匀后倒入无菌培养皿(90 mm)中。待其凝固后,用打孔器在培养基等位置处打4个均匀分布直径为8 mm的圆孔,向每孔中加入等体积(200 μL)的不同浓度(2.5、5、10 mg/mL)的虫草素溶液,对照孔加入无菌水,37℃培养24 h后测量记录抑菌圈直径。
抑菌圈直径(mm)= 药品组抑菌圈直径-对照组抑菌圈直径
1.2.5 细菌生长曲线的测定 参照何学文等[17]的方法并稍做修改。将6种供试菌液浓度稀释到108CFU/mL,分别加入不同剂量的虫草素并调节其终浓度为2MIC(不受抑制的3种菌中虫草素的终浓度为10 mg/mL),以不含虫草素的菌液为对照组,37℃恒温培养24 h,培养期间每隔2 h取样,利用752型紫外分光光度计在600 nm处测量光密度值。
1.2.6 细菌胞内紫外吸收物质泄露检测 参照江琦的方法并稍作修改[18]。将6种对数期供试菌菌液与2MIC虫草素混匀(不受抑制的3种菌中虫草素的终浓度为10 mg/mL),以不含虫草素的菌液作为对照组,37℃培养8 h,期间每隔2 h取样,8 000 r/min高速离心后收集上清液,用752型紫外分光光度计在260 nm处测量光密度值。为避免虫草素这一类核苷类化合物对实验结果产生干扰,本实验使用含有对应量虫草素的空白培养基作调零组。
1.2.7 虫草素对细菌形态的影响 参照Li等[19]的方法并略做修改。将培养至对数期的6种供试菌分别加入含有0、2MIC虫草素的LB培养基中(3种G-菌中虫草素的终浓度为10 mg/mL),摇床培养(37℃,150 r/min)4 h后分别取样2 mL,8 000 r/min离心5 min收集菌体沉淀,PBS洗涤3次后留沉淀。使用2.5%的戊二醛4℃条件下固定12 h,固定结束后依次使用40%、70%、90%、100%乙醇进行梯度洗脱,最后使用乙酸异戊酯置换2次。将处理好的样品滴于锡箔纸(1× 1 cm),冷冻干燥后于场发射扫描电子显微镜下观察。
1.2.8 数据分析 检测实验均重复3次,实验结果以平均值±标准误差(Mean ± SD)表示,采用Origin 2019b软件作图;采用SPSS 21.0软件进行数据处理,两组数据间的比较采用独立样本T检验进行分析,3组及以上数据间的比较采用(One-way ANOVA)的Duncan法进行多重比较分析,显著性水平均为0.05。
2 结果
2.1 MIC测定结果
MIC可以定量的反映出虫草素抑菌能力的强弱,测定结果如表1所示:在供试浓度范围内,虫草素对供试G+细菌具有一定的抑菌效果,对供试G-细菌无明显抑菌效果。其中虫草素对B. subtilis BS-1的抑制效果最好,MIC为2.5 mg/mL;B. thuringiensis BT-1和S. aureus SA-1对虫草素的敏感度次之,MIC均为5 mg/mL。
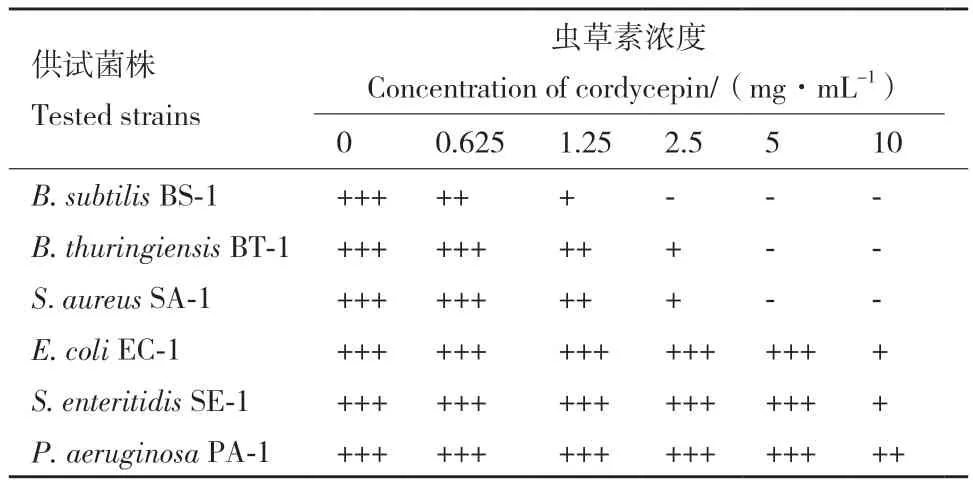
表1 虫草素MIC测定结果Table1 Determination of cordycepin MIC
2.2 DIZ测定结果
由图1和表2可知,虫草素对3种G+菌均具有一定的抑制作用,且抑制效果呈浓度依赖性(P<0.05),而对3种G-菌无明显抑制作用。其中B. subtilis BS-1对虫草素最为敏感,经不同浓度虫草素处理后测得的DIZ分别为3.6 mm、5.2 mm和8.75 mm,显著高于同浓度处理的B. thuringiensis BT-1和S. aureus SA-1(P<0.05)。B. thuringiensis BT-1 和 S.aureus SA-1经2.5 mg/mL虫草素处理后均无抑菌圈产生,进一步提高浓度后虫草素对B. thuringiensis BT-1的抑制效果显著高于S. aureus SA-1(P<0.05)。该结果与上述MIC的测定结果一致。

图1 虫草素对6种供试菌抑菌圈Fig.1 DIZ of cordycepin against six tested strains
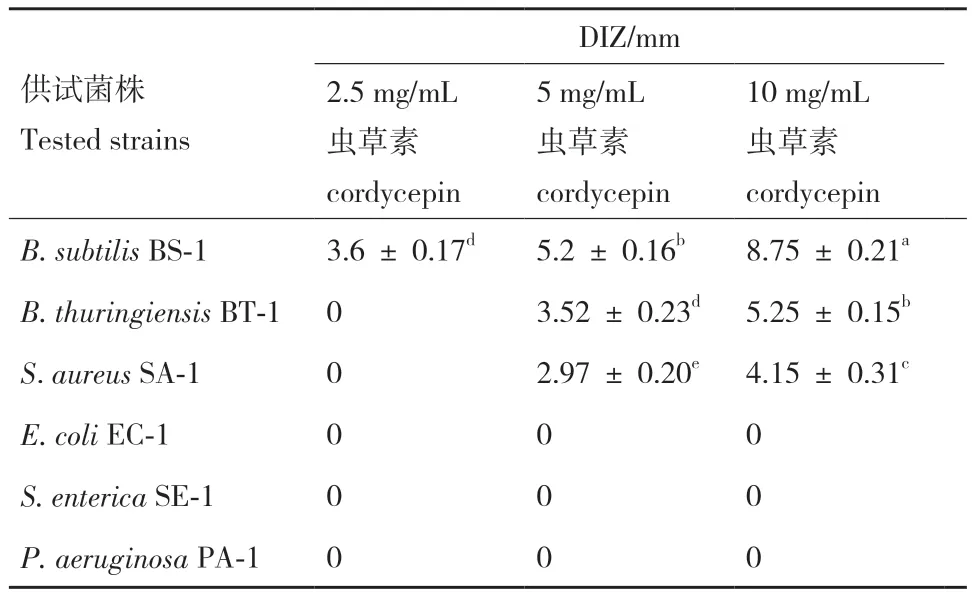
表2 虫草素DIZ测定结果Table 2 Determination of cordycepin DIZ
2.3 供试菌生长曲线测定结果
六种供试菌经虫草素处理前后生长曲线的测定结果如图2所示。可看出6种供试菌的对照组生长曲线呈典型的S型,可明显区分出迟缓期、对数期、稳定期,细菌生长状况良好。在添加2MIC的虫草素后3种G+菌的生长曲线变化明显,虽然光密度值也随着时间的延长而增加,但增加幅度较对照组明显减小,无法正常进入对数期(P<0.05)。培养6-12 h后3种G+菌实验组的光密度值趋于平缓,菌液浓度明显低于对照组(P<0.05),虫草素对3种G+菌的生长起到了明显的抑制作用。3种G-菌经10 mg/mL虫草素处理后,整体的生长趋势及最终菌群密度较对照组无明显变化(P>0.05),虫草素对供试G-菌的整体生长进程无明显影响。
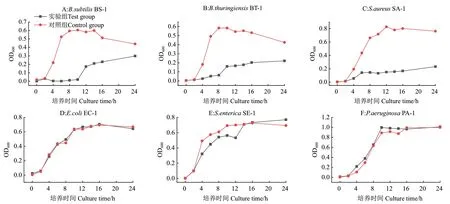
图2 虫草素对6种供试菌生长曲线的影响Fig.2 Effects of cordycepin on the growth curves of six tested strains
2.4 细菌胞内紫外吸收物质泄漏结果
六种供试菌经虫草素处理后胞内紫外吸收物质泄漏情况见图3。培养期间6种供试菌的对照组OD260无明显变化,胞内紫外吸收物质无外泄趋势,细胞生长状况良好。3种G+菌经2MIC虫草素处理后,OD260均在经历短暂的平稳期后急速增加(P<0.05),在2-8 h内造成胞内紫外吸收物质不同程度的泄露。部分G-菌如E. coli EC-1经虫草素处理后胞内紫外吸收物质有轻微泄露趋势,而S. enteritidis SE-1及P.aeruginosa PA-1在给药后OD260较对照组无显著变化(P>0.05),胞内紫外吸收物质无外泄趋势。
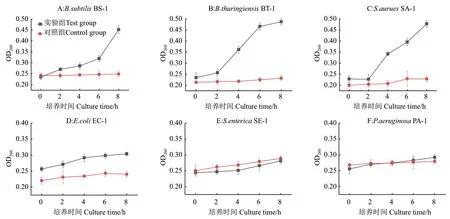
图3 虫草素对6种供试菌胞内紫外吸收物质泄露的影响Fig.3 Effects of cordycepin on the leakage of intracellular ultraviolet absorbents of six tested strains
2.5 虫草素对6种供试菌菌体形态的影响
利用扫描电镜观察6种供试菌经虫草素处理前后的超微形态结构变化,结果如图4和图5所示。当6种供试菌未经虫草素处理时,正常的菌体呈长杆型或圆球形,菌体大小均一、表面饱满光滑,细胞结构完整。3种G+菌经2MIC虫草素处理后,形态较对照组发生了明显的变化。B. subtilis BS-1经处理后菌体严重皱缩不再充盈,表面粗糙、凸起;B.thuringiensis BT-1经处理后菌体干瘪皱缩严重、部分菌体细胞壁出现断裂甚至溶解,失去原有的细胞形态。S. aureus SA-1经处理后黏联现象明显,菌体肿胀变形、少量细胞解体破碎。3种G-菌经虫草素处理后也表现出轻微损伤,如E. coli EC-1菌体肿胀变形;部分S. enterica SE-1菌体表面破损、有孔洞出现;部分P. aeruginosa PA-1菌体表面破损脱落,菌体两端有缺口。
3 讨论
核苷类抗生素包括抗细菌、抗真菌和抗病毒等主要类型[2]。虫草素作为第一个从真菌中分离得到的抗菌核苷类抗生素,其抑菌效果也有所报道。Cunningham等[5]首先探究了虫草素的抑菌作用,发现其对枯草芽孢杆菌表现出了较好的抑菌效果。相关研究表明虫草素对大肠杆菌等细菌均有抑菌活性[18,20]。但虫草素对受体菌的选择性及作用机理还不够明确,本研究将供试菌分成G+组和G-组进一步完善虫草素的抑菌谱,从宏观生长进程和微观形态结构角度对虫草素的抑菌机理进行了初步的探究,为开发虫草素的生物活性奠定理论基础。
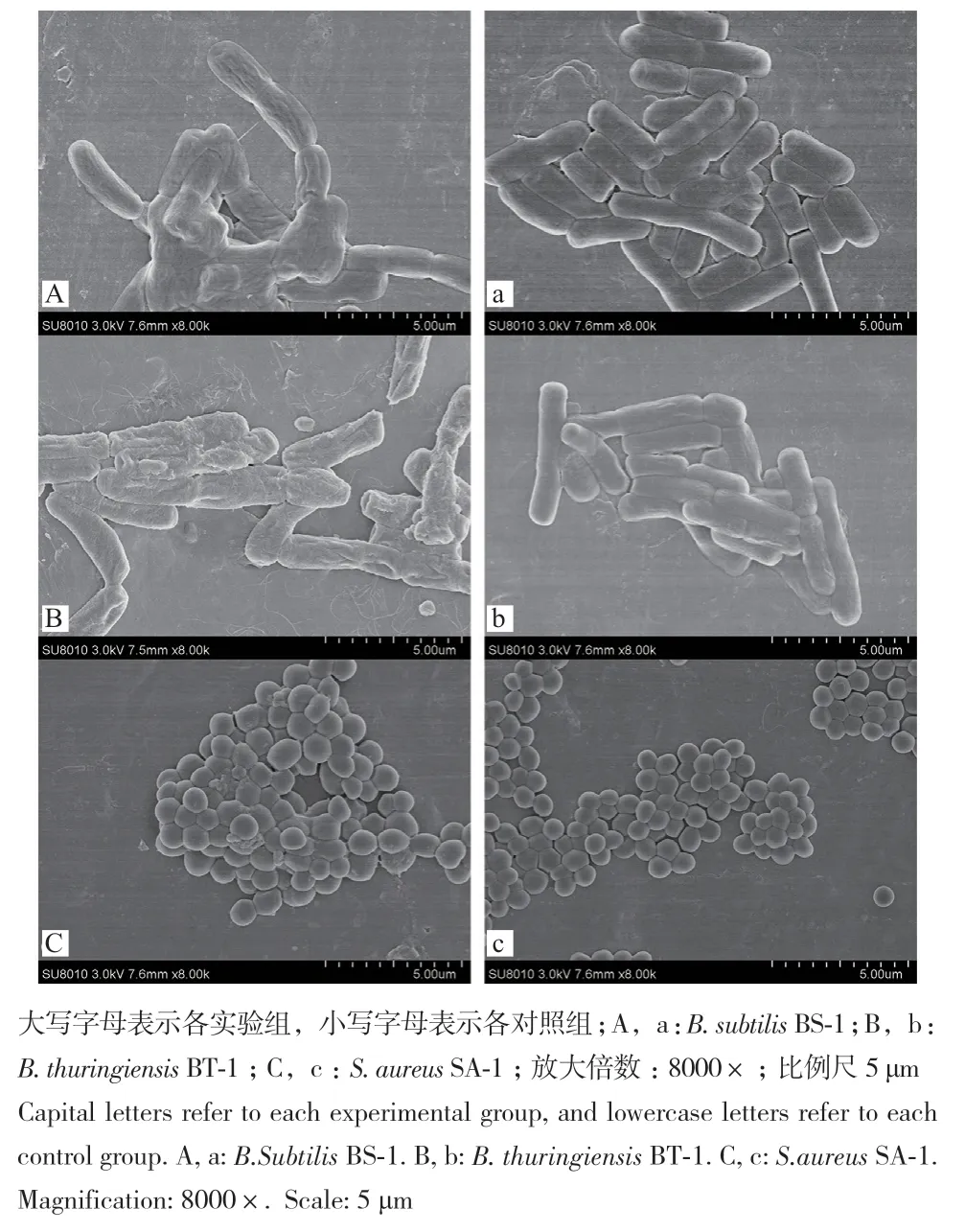
图4 场发射扫描电镜下的供试G+菌形态Fig.4 Morphology of tested G+ bacteria under field emission scanning electron microscope
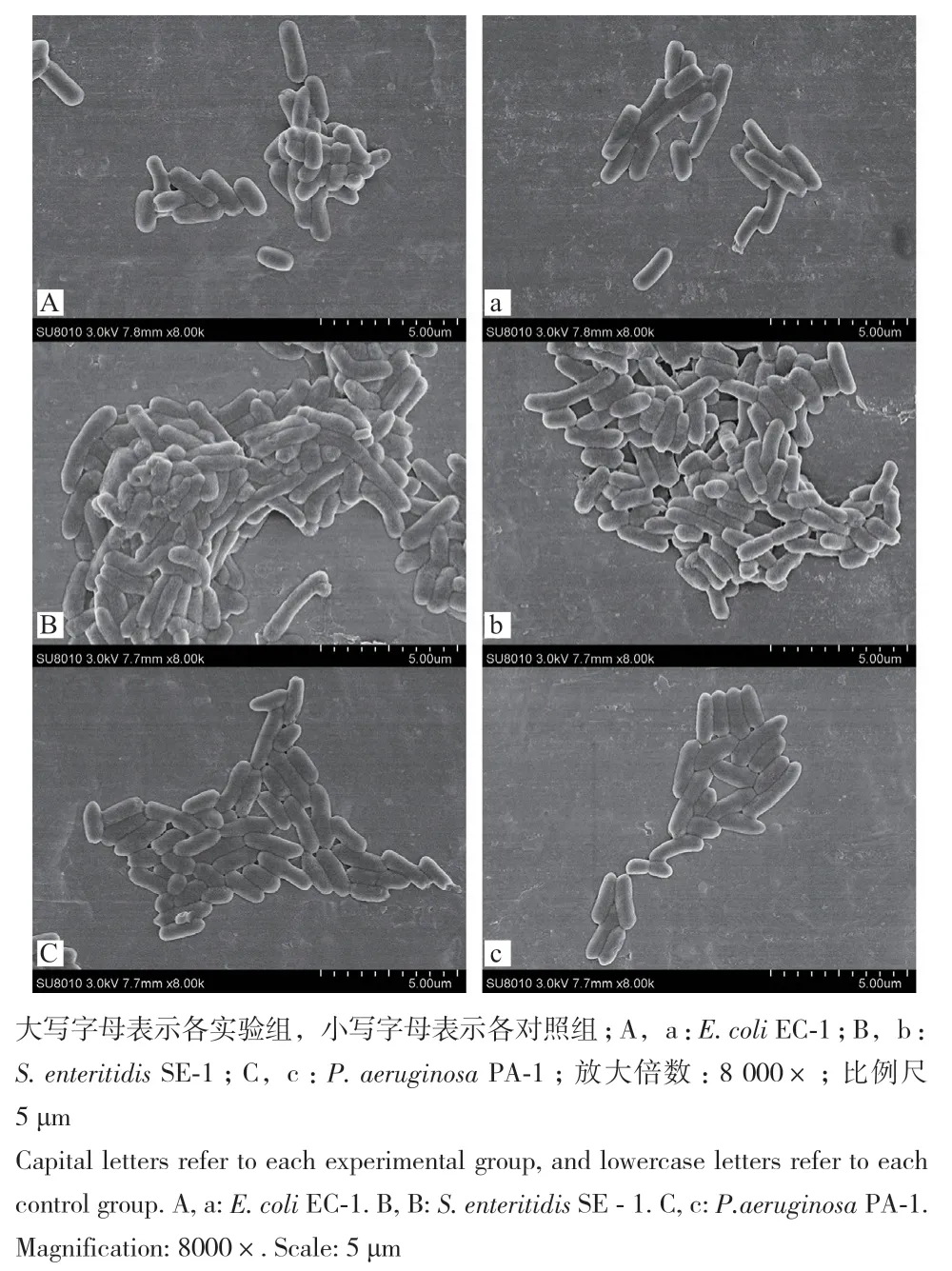
图5 场发射扫描电镜下的供试G-菌形态Fig.5 Morphology of tested G- bacteria under field emission scanning electron microscope
研究结果显示虫草素对供试G+菌具有明显的抑制作用并呈浓度依赖性,而对供试G-菌无明显抑制作用,表明虫草素在抑菌方面具有一定的选择性,但这种选择专一性并不高,可能受到环境条件的影响及菌株的适应性耐药性而变化[21]。如江琦[18]和Jiang等[20]发现虫草素对枯草芽孢杆菌(G+)和大肠杆菌(G-)均有抑制效果,分析可能与菌株耐药性的差异有关。细胞壁膜系统为细菌提供了天然的保护屏障,受到抗菌物质作用时,壁膜系统受损并丧失功能,胞内大分子物质如DNA、RNA和酶类等会外渗到培养液中,影响细菌正常的生理代谢甚至造成菌体的死亡[22-23]。渗透到胞外的主要是核酸类物质,由于核酸在260 nm处有很强的吸收峰也称“260 nm物质”,因此OD260被广泛用作评价细胞完整性的指标[23-26]。经虫草素处理后,G+菌胞内核酸等物质大量泄露且电镜观察结果显示菌体表面严重受损,表明虫草素能破坏质膜、细胞壁的结构和功能,造成细胞内容物的流失和代谢的紊乱,因此菌体的完整性受损是细菌死亡的原因之一[27]。有研究表明抗菌核苷类抗生素是细菌磷酸-N-乙酰壁氨酰-五肽转位酶的竞争性抑制剂,通过阻断肽聚糖生物合成的脂质循环进而阻碍细胞壁的生物合成,这与我们的研究结果相符[2]。虫草素对3种G-菌的抑制效果较差,这一差异可能与两类细菌结构组成有关。大多数G+菌如枯草芽孢杆菌和金黄色葡萄球菌都被厚厚的肽聚糖细胞壁所包裹,它对小分子的扩散几乎没有阻力。而像大肠杆菌和铜绿假单胞菌这样的G-菌被额外的脂多糖外膜包围,它是防止脂溶性抗生素快速渗透的有效屏障[4]。此外,G-菌还具备外排泵,抗菌药物进入后会被感知并排出,这在一定程度上也增加了G-菌的耐药性[28]。研究中发现3种G-菌经高浓度虫草素处理后,部分菌体表面出现了轻微的破损,推测进一步提高虫草素浓度可能对G-菌也起到一定的抑菌效果,但由于虫草素在常温下的溶解度有限[29],继续提高浓度后会有不溶性颗粒析出从而影响实验结果,另外过高浓度的虫草素也不适用正常的实验及应用范围,因此,本研究未对超浓度范围虫草素进一步探究。虫草素作为一种新型的广谱抗菌素,在食药保健领域日益引起重视,本研究初步获得虫草素对常见细菌的抗菌谱及选择性,分析了抑菌机理,但其具体的作用靶标和抑菌机理及运用到实际的抗菌治疗中还需更深入的研究。
4 结论
本实验探究了虫草素对6种常见细菌的抑菌性能,结果表明在溶解度范围内虫草素对供试菌的抑菌效果具有选择性,对3种G+菌有抑制效果,而对供试G-菌抑制效果不明显。虫草素能能严重破坏供试G+菌的壁膜系统,造成胞内紫外吸收物质的大量流失,影响菌体的正常生命进程。供试G-菌经高浓度虫草素处理后,部分菌体表面出现轻微破损并伴随紫外吸收物质的泄露,但细菌的整体生长进程不受影响。
