基于网络药理学对人参抗脓毒症效应的分子机制研究
2021-05-14王信林应天昊李晓丽唐一迪王艳芳杜源张雷明
王信林,应天昊,李晓丽,唐一迪,王艳芳,杜源,张雷明
(烟台大学药学院,分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
脓毒症(Sepsis)是由潜在或已知感染因素引起的全身炎症反应综合征(SIRS),常见于严重感染,烧伤,多发伤以及外科手术等病人,全球每年约有2 000万患者[1]。近年来,尽管抗炎、抗感染和器官功能支持等疗法取得了较大的进步,但脓毒症病死率仍高达30%以上[2]。
脓毒症属“厥证”“脱证”“厥脱”等范畴[3]。长期的临床实践证实,中医药治疗脓毒症具有独特的优势。在此次新冠肺炎疫情中,新冠肺炎危重症患者会出现脓毒症、脓毒症休克,最终导致患者死亡[4]。对于新冠肺炎危重症患者的中医药救治,人参的使用频率在药物分布中占了56.41%[5]。对于新冠肺炎危重症患者,人参充分发挥了“回阳救逆”的作用。人参很早就用于厥脱证(脓毒症)的治疗,《伤寒大全》记载的独参汤单用一味人参,可治疗“气虚气脱,脉微欲绝”等症,曾是中国古代抢救危重症患者的重要方剂[6]。2015版《中华人民共和国药典》指出人参具有“大补元气、复脉固脱、补脾益肺、生津养血、安神益智 ”之功效,常用于体虚欲脱,肢冷脉微等临床病症(包括现代医学的脓毒症休克)[7]。以人参为主成分的参附注射液被国家中医药管理局列为首批“全国中医院急诊室必备中成药”,一直应用于脓毒症休克患者的临床治疗[8]。
人参为五加科植物人参(PanaxginsengC.A.Mey.)的干燥根和根茎[9]。研究表明,人参的有效成分主要为人参皂苷和多糖[10]。人参皂苷和人参多糖具有广泛的药理活性,包括抗炎、抗肿瘤、抗病毒和提高机体免疫功能等作用[11-14]。目前,人参抗脓毒症作用的研究主要集中在人参皂苷单体上,对其发挥抗脓毒症效应的物质基础及整体作用机理缺乏系统而深入的研究。通过网络药理学方法可以综合分析人参发挥抗脓毒症的效应有效成分,挖掘人参与脓毒症的共同作用靶点,以分析人参抗脓毒症靶点所涉及的生物学功能和信号通路[15]。因此,本研究旨在通过网络药理学的方法研究人参发挥抗脓毒症作用的物质基础和分子机制,为新药研发及中药人参的拓展应用提供理论依据。
1 材料与方法
1.1 人参有效成分及相关靶点的筛选
在中药系统药理数据库及分析平台(TCMSP)中检索人参的有效成分,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18[16]两个关键药物代谢动力学参数为筛选条件,以获得人参的有效成分。使用TCMSP数据库中相关靶点检索功能,通过有效成分的MOLID检索人参有效成分的作用靶点,去除没有检索到靶点的有效成分,依次得到17种有效成分对应的作用靶点。运用Uniprot蛋白质数据库(https://www.uniprot.org)将有效成分的作用靶点进行规范化处理以便用于后续研究。
1.2 脓毒症相关靶点的筛选
以脓毒症的英文名“sepsis”作为检索关键词,在GeneCards数据库(https://www. genecards. org)、DrugBank数据库(https://www.drugbank.ca/)和OMIM数据库(https://www.omim.org/)中检索脓毒症的潜在靶点[17]。在GeneCards数据库中,Score值越高则代表该靶点与疾病联系越密切。
1.3 人参有效成分-脓毒症靶点网络的构建
使用R语言将人参有效成分的作用靶点与脓毒症相关靶点取交集并绘制韦恩图,两者交集部分即为人参抗脓毒症的潜在作用靶点,通过Cytoscape3.7.2构建人参有效成分-脓毒症靶点网络图。
1.4 人参有效成分-脓毒症靶点蛋白互作网络的构建
将人参有效成分作用靶点与脓毒症靶点的交集靶点信息提交到STRING11.0数据库(https://string-db.org)用以构建蛋白互作(PPI)网络,在生物种类选项中选择 “Homo sapiens”,即可得到PPI网络关系图。
1.5 人参有效成分-脓毒症靶点GO生物功能分析与KEGG信号通路富集
运用Metascape数据库(http://metascape.org)对人参有效成分作用靶点与脓毒症靶点的交集靶点进行富集分析。将上述交集靶点信息导入Metascape数据库中进行GO及KEGG分析,显著性差异设置为P<0.01,保存GO及KEGG分析结果并通过R语言对结果进行可视化处理。
1.6 人参有效成分-脓毒症靶点-信号通路网络图的构建
运用Cytoscape3.7.2软件构建人参有效成分-脓毒症靶点-信号通路的网络图并使用软件中内置分析工具分析有效成分及靶点的网络拓扑参数。以连接度(Degree)、介度(Betweenness)及紧密度(Closenesss)等[18]网络拓扑学参数判断人参发挥抗脓毒症作用的核心有效成分及其作用的核心靶点。
2 结果
2.1 人参的有效成分及其作用靶点
在TCMSP数据库中根据OB和DL参数筛选初步获得22个成分,剔除5个未查询到靶点的成分,最终获得17个有效成分(见表1)。运用TCMSP靶点预测功能对上述17个成分作用靶点加以预测,预测到人参有效成分作用靶点256个,筛选合并后删除重复值共得到靶点110个。利用 Cytoscape3.7.2软件对人参有效成分及其作用靶点的关系网络进行绘制和分析,共获得127个节点(包含110个靶点和17个有效成分)与240条关系,图中节点的大小代表相应的Degree值,节点面积越大代表Degree值越大,表示涉及的生物功能越多,其生物学重要性越高(见图1)。
2.2 脓毒症相关靶点
使用GeneCards数据库筛选获得脓毒症相关靶点2 316个。选择Score值大于中位数的靶点为脓毒症的相关靶点,即在 GeneCards数据库中脓毒症靶点Score值最大为31.51,最小为0.19,中位数为2.54,故选择Score值>2.54的靶点为脓毒症的相关靶点[19]。使用OMIM和DrugBank数据库筛选靶点分别得到97个和1个脓毒症相关靶点,合并3个数据库后删除重复值,最终得到1 314个脓毒症相关靶点。
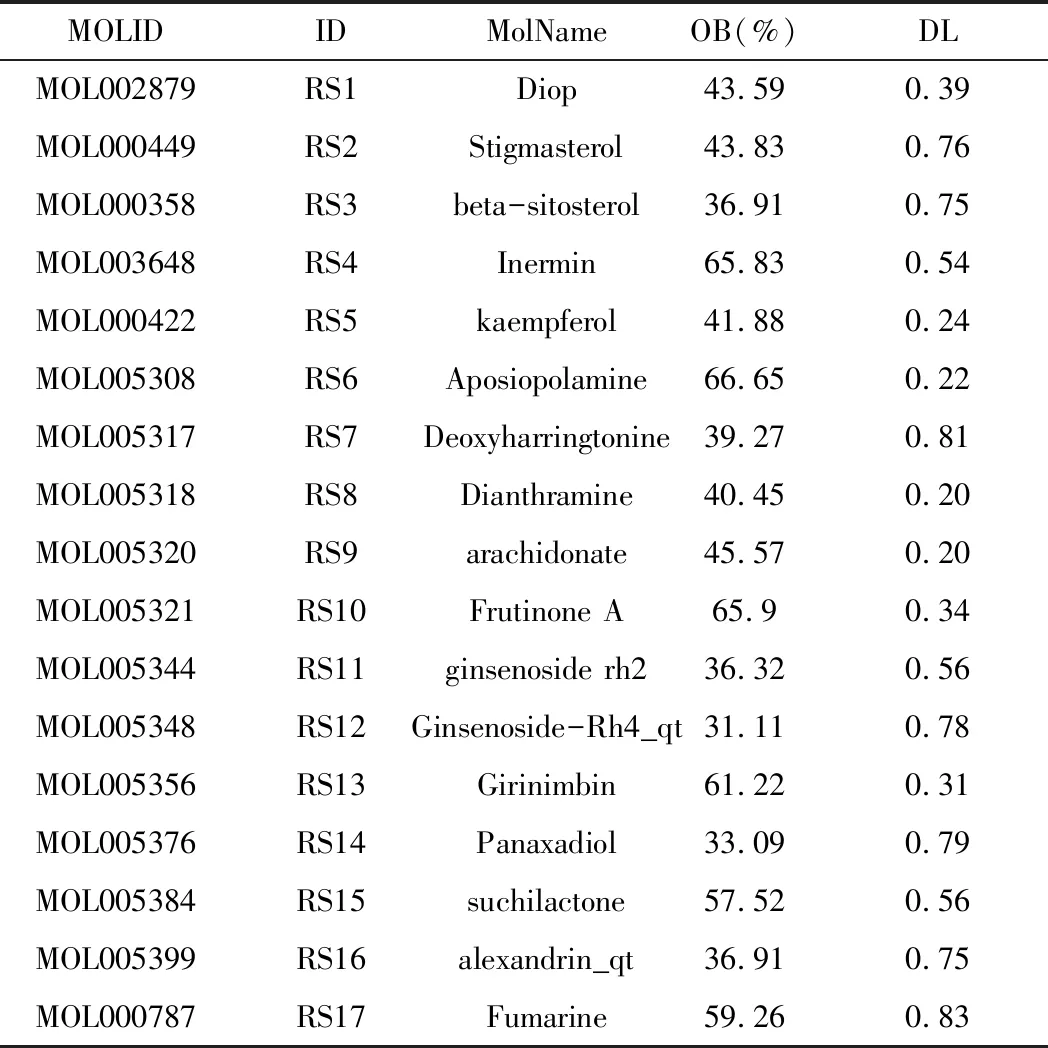
表1 人参有效成分
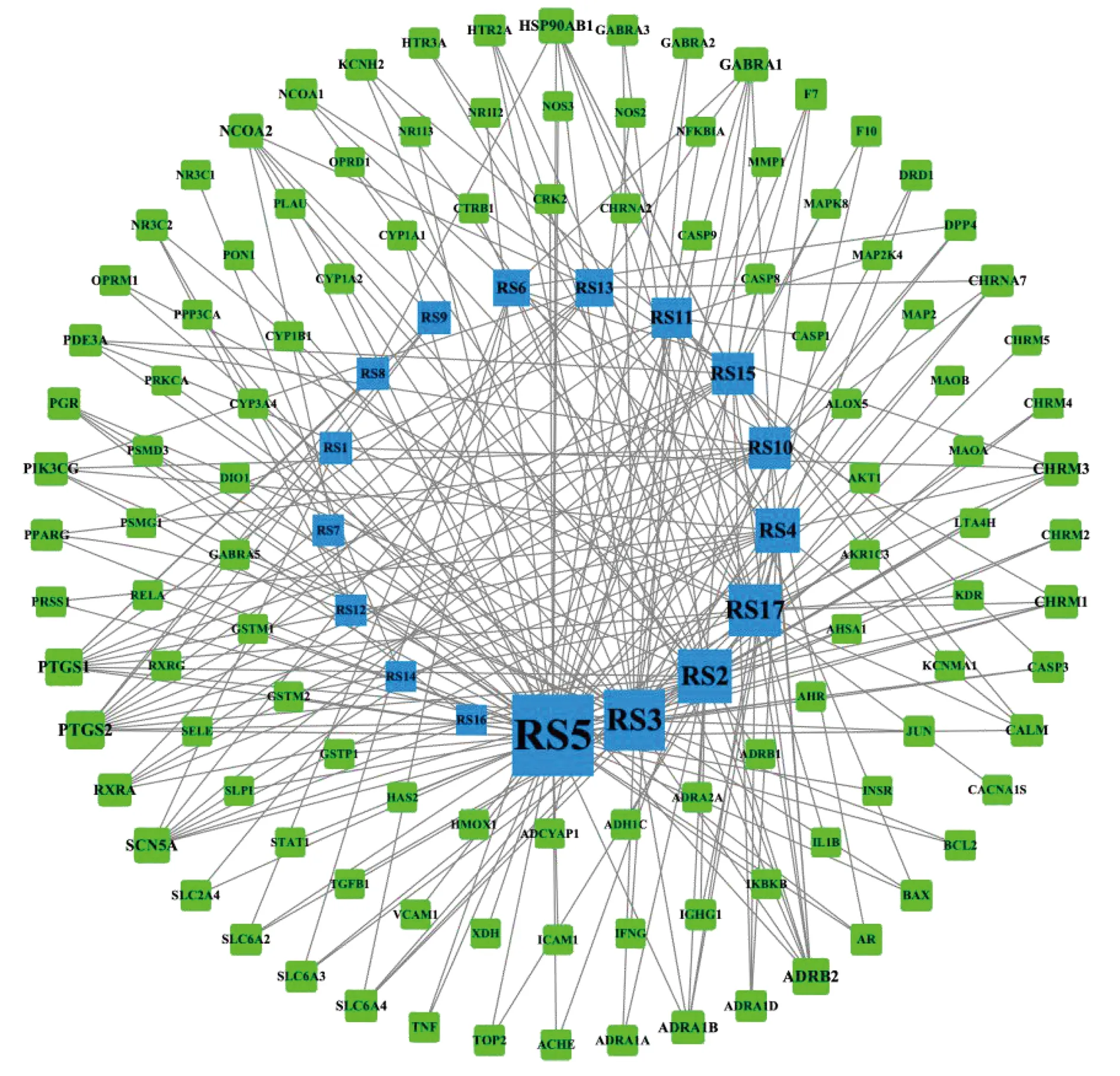
注:图中绿色代表有效成分作用的靶点;蓝色代表17个有效成分。 图1 人参有效成分-作用靶点网络图
2.3 人参有效成分-脓毒症靶点网络的构建
应用R语言将人参有效成分和脓毒症相关的作用靶点取交集,绘制韦恩图(见图2),得到交集靶点43个,即人参有效成分抗脓毒症作用的潜在靶点。使用Cytoscape3.7.2软件构建人参有效成分-脓毒症靶点网络图(见图3)。网络图中共有57个节点,86条边,体现了人参可通过多组分,多靶点协同抗脓毒症的特点。网络图中菱形代表抗脓毒症作用靶点,六边形表示15种有效成分。15种有效成分中作用靶点较多的6个有效成分为山奈酚(27个)、β-谷甾醇(10个)、人参皂苷rh2(9个)、原阿片碱(8个)、灌木远志酮 A(7个)、豆甾醇(6个),以及对应有效成分较多的3个靶点为PTGS2(对应11个有效成分)、ADRB2(对应9个有效成分)、CHRNA7(对应4个有效成分)可能为人参抗脓毒症的关键有效成分和关键作用靶点。

图2 人参有效成分-脓毒症靶点韦恩图
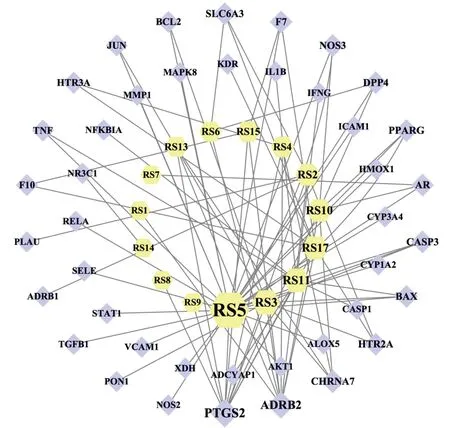
图3 人参有效成分-脓毒症靶点网络图
2.4 人参有效成分-脓毒症靶点PPI网络的构建
将筛选得到人参成分-脓毒症43个交集靶点提交到 STRING11.0在线平台,物种选择为“人”,交互作用选择>0.4的靶点即可得到人参靶点PPI网络图(见图4)。为了更加清楚体现核心蛋白在PPI中的调控作用,使用 Cytoscape3.7.2软件中内置的Network Analyzer工具进行网络可视化处理得到可视化PPI网络(见图5)。PPI网络图中共有43个节点,320条边,平均节点度为14.88,平均局部聚类系数为0.65。网络图中连接度值通过节点的大小和颜色表示,节点越大,颜色越深(由浅黄到橙色),表示靶点连接度值越大,反之表示连接度值越小,由图5可以看出,AKT1、TNF、CASP3、MAPK8、IL1B、PTGS2、JUN、ICAM1、NOS3、VCAM1、PPARG等靶点在PPI网络中发挥了较为关键的调控作用。
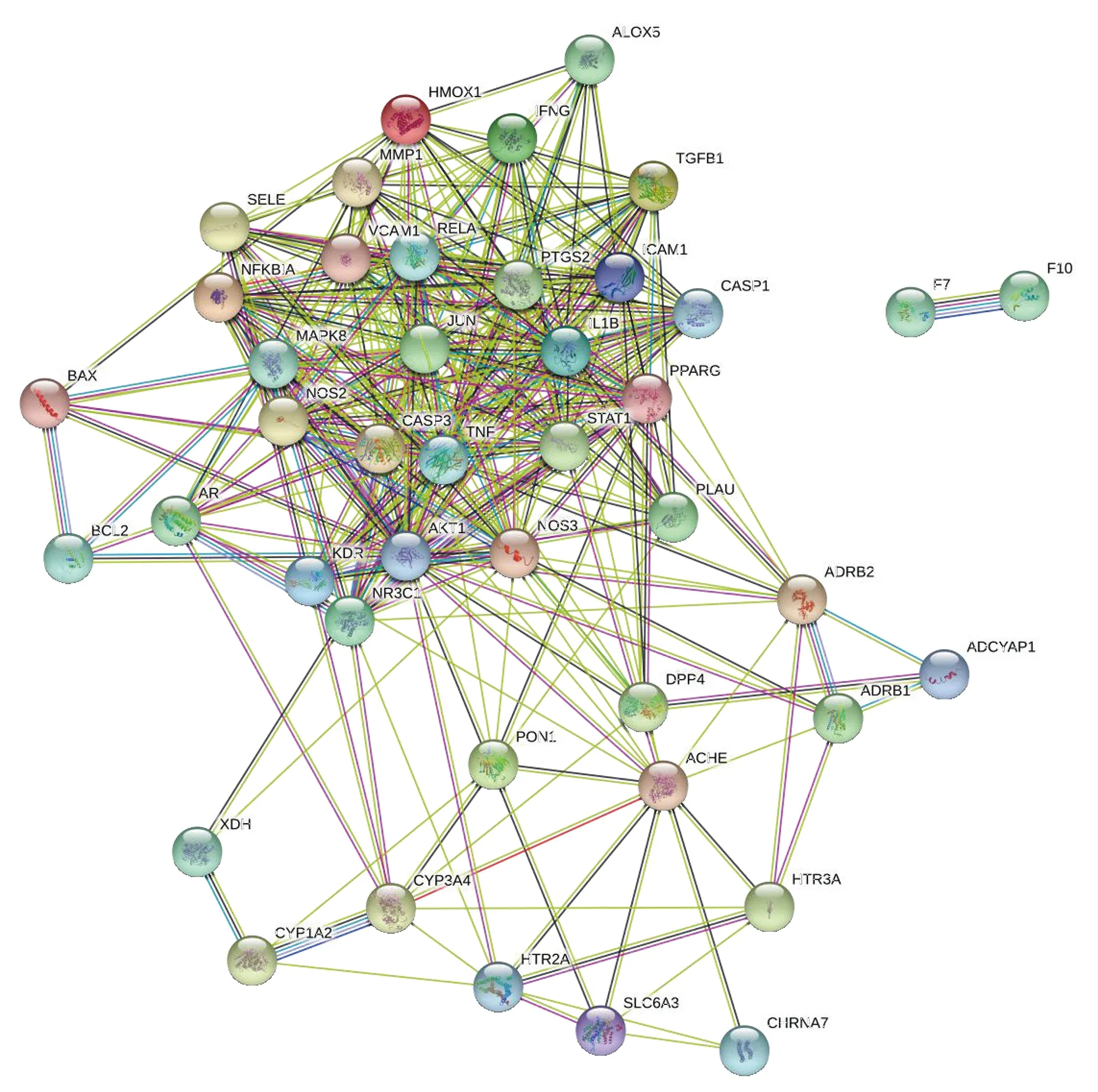
图4 人参-脓毒症靶点PPI网络(STRING11.0)

图5 人参-脓毒症靶点PPI网络
2.5 人参抗脓毒症潜在靶点生物功能分析与通路的富集
利用Metascape平台,将人参有效成分作用靶点与脓毒症靶点的交集靶点进行GO的生物过程(Biological Process, BP)、细胞组分(Cell Component, CC) 和分子功能(Molecular Function, MF)富集分析,选择P<0.01的项目进行筛选,总共富集到1 064条生物过程,其中65项与分子功能相关,25项与细胞组分相关。GO分析结果按照富集的显著性差异取排名前10的项目使用R语言绘制柱状图(见图6)。KEGG通路分析按P<0.01进行筛选,总共富集到102条信号通路,筛选排名前20通路进行气泡图绘制(见图7)。
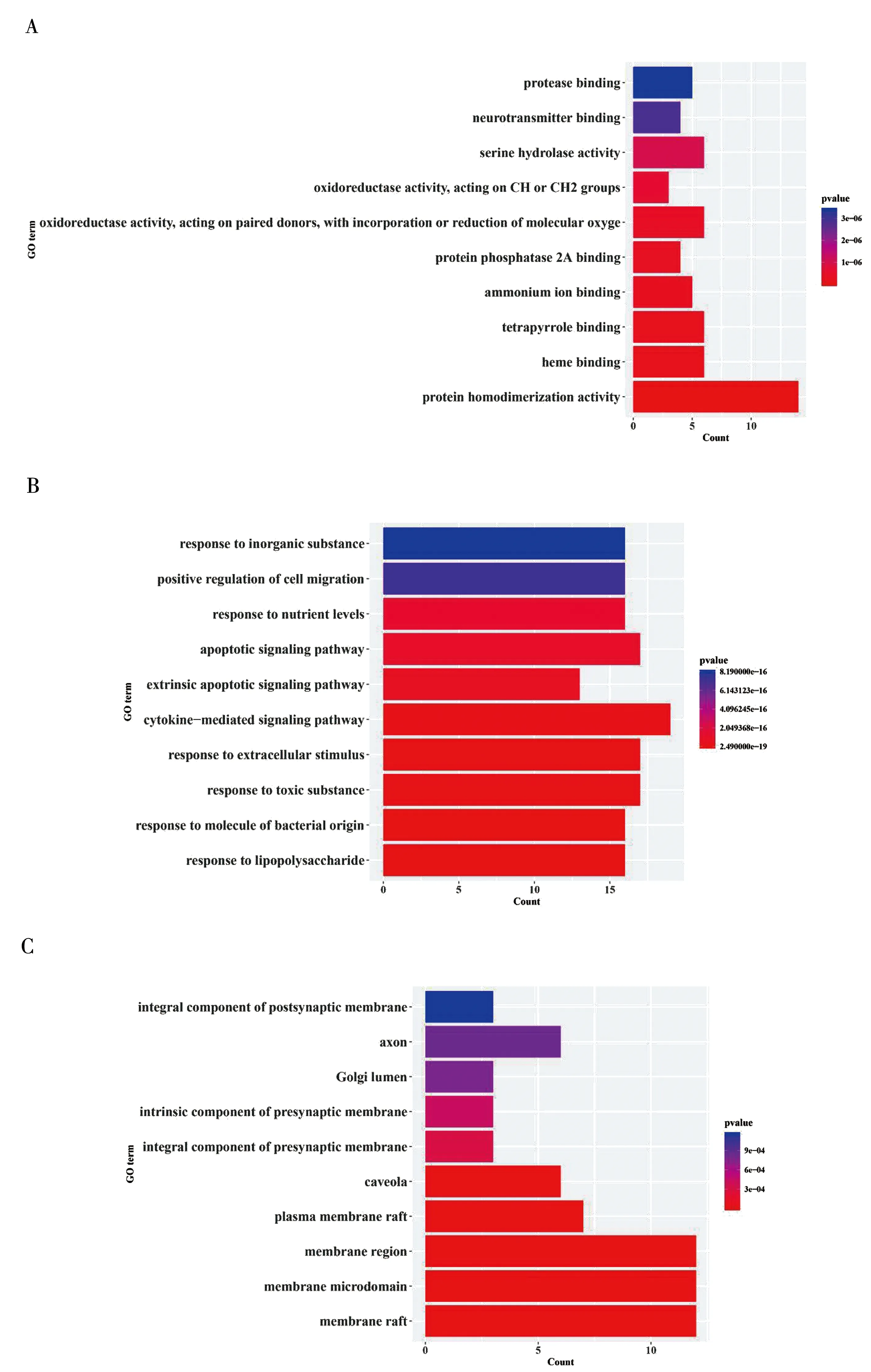
注:A为生物过程富集分析;B为分子功能富集分析;C为细胞组分富集分析。图6 GO分析
2.6 人参有效成分-脓毒症靶点-信号通路网络图的构建
使用Cytoscape3.7.2软件构建人参有效成分-脓毒症靶点-信号通路网络图(见图8)。通过该软件内置的分析工具分析人参抗脓毒症效应的网络拓扑学参数,得到核心成分及核心作用靶点。人参治疗脓毒症的核心有效成分为山奈酚、人参皂苷rh2、β-谷甾醇和灌木远志酮 A等(见表2)。人参治疗脓毒症的最主要靶点为TNF、RELA、JUN、MAPK8、PTGS2、IL1B、AKT1、CASP3、NFKBIA和TGFB1等(见表3)。
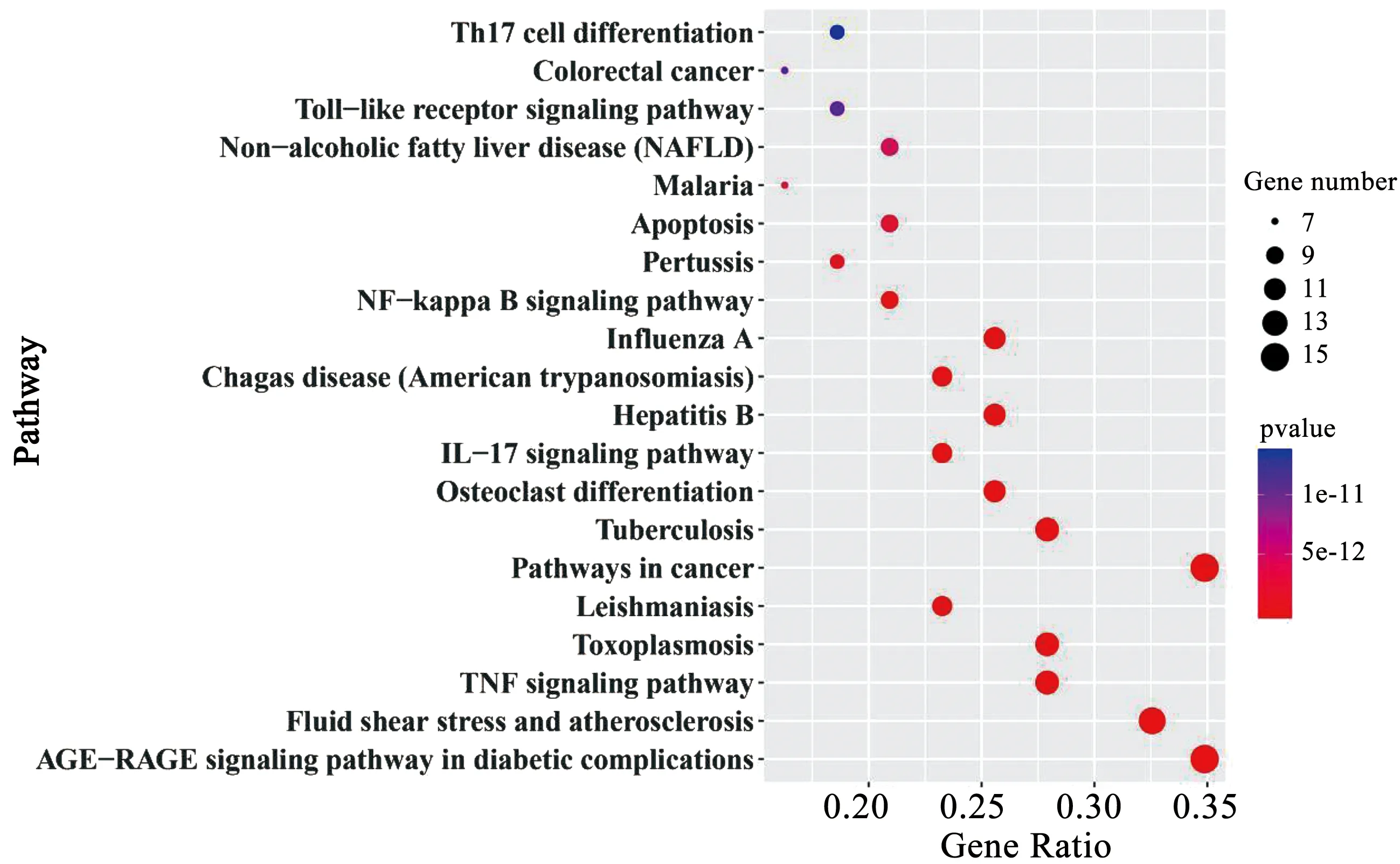
图7 KEGG通路富集分析
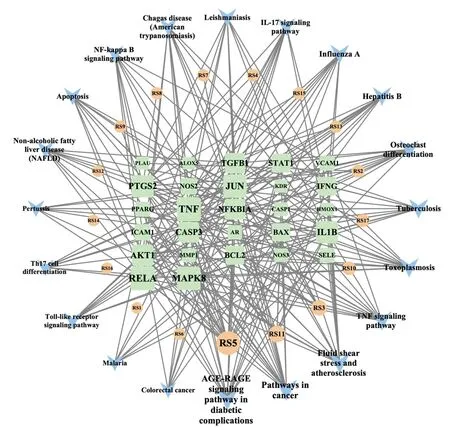
注:橙色圆形节点为人参的有效成分,浅绿色矩形为有效成分作用靶点,浅蓝色倒三角为有效成分作用的信号通路;节点的面积大小和颜色深浅代表其度数,面积越大、颜色越深说明该节点在网络调控中的作用越重要。图8 人参有效成分-脓毒症靶点-通路网络图

表2 人参有效成分网络节点特征参数

表3 人参有效成分靶点网络节点特征参数
3 讨论
中药在治疗疾病时具有多组分、多靶点、多途径、系统调控及协同作用的特点[20]。由于中药复杂的物质组分导致其作用机制难以阐明。网络药理学可以从药物、靶点、疾病三者之间相互作用的系统性出发,以复杂的网络模型分析中药的药理学性质,阐明中药成分-靶点-疾病复杂的相互作用关系,为中药多成分作用机制研究及中药现代化应用提供依据[21]。
本研究表明,人参中多种有效成分可以通过多靶点,多信号通路发挥抗脓毒症的效应。本研究运用网络药理学的方法筛选得到人参抗脓毒症效应的核心有效成分为山奈酚、人参皂苷rh2、β-谷甾醇、灌木远志酮A、豆甾醇、原阿片碱等。山奈酚(Kaempferol)主要是来源于姜科植物山奈(KaempferiagalangalL.)根茎的黄酮类化合物,广泛存在于各种水果和蔬菜[22]。研究表明, 山奈酚具有较强的抗氧化、抗炎药理活性[23-24]。山奈酚对盲肠结扎穿刺所致小鼠肺损伤具有明显的保护作用,提示其具有抗脓毒症的潜力[25]。人参皂苷rh2具有很强的抗炎活性,其可通过抑制NF-κB的活化进而显著抑制RAW264.7巨噬细胞炎症因子的释放[26]。同时,人参皂苷rh2对脂多糖(LPS)诱导的小鼠急性肺损伤具有明显的保护作用[27]。豆甾醇和β-谷甾醇均属于天然植物甾醇类化合物,两者药理活性较为相似[28-29],具有抗氧化、抗炎等药理活性[30-31]。灌木远志酮 A和原阿片碱未见详细抗炎报道。本研究通过PPI蛋白互作分析,得到PPI核心基因AKT1、TNF、CASP3、MAPK8、IL1B、PTGS2、JUN、ICAM1、NOS3、VCAM1、PPARG,上述基因靶点在人参抗脓毒症中发挥了关键作用。
运用GO生物学功能分析和KEGG通路富集以明确人参有效成分作用靶点-脓毒症靶点的43个交集靶点在生物学功能和信号通路中的调控作用。GO分析表明上述交集基因主要通过影响对脂多糖的反应、对细菌起源分子的反应、对有毒物质的反应、对细胞外刺激的反应、细胞因子介导的信号通路等过程而发挥抗脓毒症的作用。KEGG富集结果显示,人参发挥抗脓毒症效应的靶点主要富集的通路涉及TNF、NF-κB、Toll样受体、IL-17以及Th17细胞分化等信号通路。这些通路都与脓毒症的发生和发展密切相关。研究表明,肿瘤坏死因子(TNF)是脓毒症和休克(由循环和/或代谢异常引起的危及生命的疾病)炎症反应的主要介质。同时,注射外源性肿瘤坏死因子会导致一种与感染性休克难以区分的综合征,而向人类体内注射肿瘤坏死因子则会导致全身炎症反应综合征(SIRS)[32]。Toll样受体(TLR)家族是哺乳动物中最具有特征性的模式识别受体,其中TLR4是革兰氏阴性菌脂多糖的特异性受体,在脓毒症发病机制中扮演关键角色[33]。在脓毒症发生过程中,NF-κB信号通路激活后可引起TNF-α、IL-6等炎症因子的释放进而损伤组织,过度释放的炎症因子再次刺激NF-κB的激活使得炎症因子进一步释放形成炎症风暴,加重病情[34]。Th17细胞是初始免疫与获得性免疫之间的重要桥梁,可在感染发生时诱导其他辅助性T细胞发挥作用[35]。脓毒症患者外周血Th17细胞表达增加,同时脓毒症急性肺损伤和肾损伤患者外周血Th17细胞表达亦显著增加,提示Th17细胞分化通路在脓毒症发生发展过程中发挥重要作用[36-38]。
综上所述,人参及其有效成分可通过对物质代谢、信号转导、炎症反应等多靶点及多通路的调节而发挥抗脓毒症的效应,为人参抗脓毒症的临床应用和科学研究提供重要参考。
