As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs对肿瘤细胞MCF-7/ADR增殖和凋亡的影响
2021-05-14郝若祎耿雪徐世一苏慧张新宇李雪莹霍元子王琪阎雪莹
郝若祎,耿雪,徐世一,苏慧,张新宇,李雪莹,霍元子,王琪,阎雪莹
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
三氧化二砷 (arsenic trioxide,ATO),分子式为As2O3,为矿物质砒霜的主要成分。由于As2O3对急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)及其他恶性血液肿瘤具有良好的疗效[1],因此其对其他实体肿瘤的影响也引起了研究者们的广泛兴趣。大量实验结果证实,As2O3对不同组织来源的实体肿瘤,包括人舌鳞癌细胞Tca8113[2]等,具有抑制增殖并促进细胞凋亡的作用。
聚乳酸(PLA)因良好的生物可降解性和相容性已经成为药剂学领域研究最多的载体材料之一[3-5]。Tang 等[6]采用共沉淀法制备了一种胆酸- 聚乳酸-生育酚聚乙二醇琥珀酸酯(CA-PLA-TPGS)嵌段共聚物,载药后制成粒径100 nm左右纳米粒,在抑制乳腺癌细胞方面显示出良好效果。聚乙二醇(PEG)具有突出的物理化学性能和生物性能,主要表现在亲水性、在水和有机溶剂中的可溶性、无毒、无抗原性和免疫性[7]。此外,聚乙二醇抗生物游积的作用,能减少细胞和蛋白非特异性吸附。通过将亲水基团引入聚乳酸的端基中,得到的改性聚乳酸既保留了其原来的可生物降解性和良好的力学性能,又改善载体材料的亲水性,生物亲和性。经聚乙二醇修饰的聚乳酸进入人体后,毒副反应更小、且能有效逃避免疫防御系统的吞嚼作用,使聚乳酸成为优良的药物载体材料。
将药物制备成被载体包裹的纳米粒,会提高对肿瘤细胞多药耐药的逆转作用[8],对纳米粒表面进行亲水基团修饰,可改善药物体内生物过程[9-12]。本研究选择As2O3为模型药物,以聚乳酸、聚乙二醇修饰的聚乳酸为载体材料制成纳米粒,并比较纳米粒在体外对乳腺癌细胞MCF-7/ADR药效作用的异同[13-17],以及对乳腺癌耐药细胞MCF-7/ADR耐药倍数的逆转[18-22]。为纳米给药系统提供参考,同时也为临床增加高效低毒的治疗药物奠定基础。
1 材料与仪器
1.1 材料
1.1.1 细胞株
MCF-7细胞株(获赠于黑龙江中医药大学中药化学实验室);MCF-7/ADR细胞株(上海揽宝仪器设备有限公司)。
1.1.2 主要试剂与药品
三氧化二砷原料药(Merck Parmstadt);三氧化二砷聚乳酸纳米粒冻干粉(本实验室自制);F1640培养基(赛默飞世尔生物化学制品有限公司);胎牛血清(杭州四季青生物材料工程公司);胰蛋白酶消化液(BiLLab公司);Hoechst 33342荧光染色液(碧云天生物技术有限公司);Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术有限公司)。
1.2 主要仪器
洁净工作台(WT-1ND型);氧化碳恒温培养箱(郑州南北仪器设备有限公司,HF-90型);倒置荧光显微镜(德国蔡司公司,Axio型);酶标仪(美国热电仪器有限公司,MK3型);低速台式离心机(TDL-4型,上海安亭科学仪器厂);流式细胞仪(美国BD Accui C5)。
2 方法
2.1 纳米粒冻干粉的制备
2.1.1 As2O3-PLA-NPs冻干粉的制备
采用复乳溶剂挥发法制备纳米粒,精密称量PLA 40 mg,加入1.5 mL乙酸乙酯,超声至完全溶解。精密吸取浓度为30 mg/mL的As2O3溶液100 μL,100 W超声60 s(超声2 s,间歇2 s),将初乳加入到6 mL含6%吐温20的外水相中,80 W冰浴超声60 s(超声2 s,间歇2 s)形成复乳,以旋转蒸发法除去有机溶剂,以去离子水转移至25 mL容量瓶中,定容至刻度线,即为As2O3-PLA-NPs样品。
按体积比1∶1加入5%甘露醇作为冻干保护剂,分装于西林瓶中,预冻处理后,在-80 ℃的超低温冰箱中冷冻24 h,取出,再放在冷冻干燥机中干燥约48 h,即可得纳米粒冻干粉。
2.1.2 As2O3-mPEG -PLA-NPs纳米粒冻干粉的制备
采用复乳溶剂挥发法制备纳米粒,精密称量mPEG-PLA 40 mg,其他步骤同“2.1.1”。
2.2 三氧化二砷纳米粒细胞毒性研究
2.2.1 细胞生长曲线的绘制
细胞以2×104个/mL 密度接种于25 cm2细胞培养瓶,每瓶3 mL,共21瓶。在37 ℃,5% CO2培养箱中培养。每隔24 h取出3瓶,先在倒置显微镜下观察细胞生长范围,然后用含0.25 %胰蛋白酶的消化液消化,用完全培养基终止消化后,1 000 r/min离心5 min,用 5 mL 培养基调成细胞悬液,分别计数,取3次计数平均值。计数连续7 d的细胞数目。根据细胞计数结果,以单位细胞数(万/mL)为纵坐标,以时间(D)为横坐标绘制生长曲线。
2.2.2 三氧化二砷游离药及纳米粒的细胞毒性研究
取对数生长期的MCF-7/ADR细胞,胰酶消化,离心后,用培养基稀释,细胞计数使得细胞密度在1×104个/mL,接种于96孔板,每孔200 μL,当细胞生长到亚融合状态时,进行相应药物处理。将As2O3原料药用1 mol/L的NaOH溶解,以1 mol/L HCl调节至中性,配成浓度为100 μmol/L的As2O3溶液,再加培养基稀释至所需浓度。药物分组:As2O3组,As2O3-PLA-NPs溶液组,As2O3-mPEG-PLA-NP溶液组,以及空白纳米粒载体组,每组均设1、2、4、8、16 μmol/L5个浓度,每个浓度设6个复孔。对照组加同体积的空白培养基。向96孔板最外侧孔内添加PBS溶液,加入药物后,放入培养箱继续培养,分别在24、48 h后终止培养,在每孔加入20 μL CCK-8试液,培养4 h后,在酶标仪450 nm波长下测定吸光值。根据测定的吸光值,计算抑制率。
增值抑制率(%)=(1-实验组OD值/对照组OD值)×100%
2.3 采用流式细胞仪检测不同As2O3- NPs对MCF-7/ADR细胞凋亡的影响
2.3.1 细胞样品的制备
选取对数生长期的MCF-7/ADR 细胞,胰蛋白酶消化后,调整细胞浓度为 3×105个/mL,用 6 孔细胞培养板培养 MCF-7/ADR细胞,每孔接种2 mL单细胞悬液,于37 ℃、5%CO2培养箱中培养,24 h后吸弃旧培养液。每孔分别加入含4、8、16 μmol/L的As2O3、As2O3-PLA、As2O3-mPEG-PLA纳米粒的培养基分散液,对照组加等量培养基,每个浓度3个复孔,继续培养48 h后收集细胞。
2.3.2 细胞样品的处理
将细胞培养液吸至5 mL离心管中,PBS洗涤贴壁细胞1次,加入1 mL胰酶细胞消化液消化细胞。室温孵育至轻轻调打细胞可以脱落时,停止消化,吸除胰酶消化液。加入离心管内细胞液,混均,1 000 r/min离心5 min,弃上清,收集细胞,用PBS重悬细胞并计数。取3×105个/mL重悬细胞,1 000 r/min离心5 min,弃上清,每孔分别加入195 μL Annexin V-FITC结合液、5 μL Annexin V-FITC、10 μL碘化丙啶染色液,轻轻混匀。室温25 ℃避光孵育15~20 min,随后置于冰浴中。用铝箔包裹避光,随即进行流式细胞仪检测。
2.4 Hoechst染色观察As2O3纳米粒对细胞凋亡的作用
取对数生长期的MCF-7/ADR细胞,用胰蛋白酶消化后,调整细胞密度为3×105个,接种于6孔板,每孔分别加入含4、8、16 μmol/L的As2O3、As2O3-PLA、As2O3-mPEG-PLA纳米粒的培养基分散液,对照组加等体积培养基,每个浓度3个复孔,继续培养48 h后收集细胞。
每个样品收集约100万细胞于15 mL离心管内,离心弃上清液。用1.0 mL细胞染色缓冲液重悬细胞。加入5 μL Hoechst33342染色液,混匀,于37 ℃培养箱孵育30 min,检测前离心沉淀细胞,用PBS缓冲液洗涤2次,使用倒置显微镜观察蓝色荧光。
2.5 As2O3-NPs对MCF-7/ADR细胞周期的影响
2.5.1 细胞样品的制备
将MCF-7/ADR细胞接种于6孔板中,每孔接种2 mL单细胞悬液(3×105个/mL),于37 ℃、5%CO2培养箱中培养,24 h后更换培养液。各孔分别加入2 mL药物浓度为8 μmol/L的As2O3-PLA-NP、As2O3-mPEG-PLA-NP培养液,对照组加等体积As2O3游离药培养液;为了考察空白纳米粒对细胞周期的影响,增设同浓度空白纳米粒组,每一个浓度设3个复孔,分别于加药后48 h收集细胞。小心收集细胞培养液到15 mL离心管内备用。用胰酶消化液消化细胞,至细胞轻轻吹打可以脱落停止消化,用枪头将细胞吹落下来,加入前面收集的细胞培养液,混悬均匀,收集到一个离心管内,1 000 r/min离心5 min,沉淀细胞。小心吸除上清液,加入约1 mL PBS重悬,并转移到5 mL离心管内,再次离心沉淀细胞。
2.5.2 细胞固定
加入1 mL预冷的70%乙醇,轻轻吹打混均,4 ℃固化12 h。固化完成后,1 000 r/min离心5 min,沉淀细胞。小心吸除上清,加入1 mL冰浴预冷的PBS溶液,重悬细胞。再次离心沉淀细胞,轻轻弹击离心管底,防止细胞成团。
2.5.3 细胞染色
在每管细胞样品中,加入染色缓冲液6 mL,碘化丙啶染色液(20×)300 μL,RNase A(50×)120 μL,混合均匀。每管细胞样品中,加入0.5 mL配制好的碘化丙啶染色液,轻轻混悬细胞,37 ℃避光孵育30 min。通过流式细胞仪,检测不同药物纳米粒对MCF-7/ADR的细胞周期作用结果。
2.6 CCK-8法测定药物对MCF-7多药耐药细胞株耐药的逆转
将MCF-7和MCF-7/ADR分为5组,分别为MCF-7组、MCF-7/ADR组、MCF-7/ADR+As2O3组、MCF-7/ADR+As2O3-PLA-NP组和MCF-7/ADR+As2O3-mPEG-PLA-NP组。以上各组分别加入浓度为0.04、0.4、4、40、400 μmol/L的阿霉素。
用CCK-8法测定MCF-7和耐药细胞MCF-7/ADR对化疗药物ADM的敏感性。取对数生长期细胞用胰酶消化后用培养液制成单细胞悬液,细胞计数,以每孔1×104个细胞接种到96孔板上,每孔体积为100 μL。细胞贴壁后,用细胞培养液配制不同浓度梯度的药物培养细胞,对照组为不含药物普通培养基。给药浓度分别为0.04、0.4、4、40、400 μmol/L,每组设6个复孔。药物作用24 h后,吸除培养液。每孔加入100 μL不含血清的1640培养基、20 μL CCK-8于5%CO2,37 ℃孵育0.5 h,终止培养。选择波长490 nm,在酶标仪上测定各孔的OD值并记录实验结果。计算各药物对细胞的半数抑制浓度(IC50)、耐药倍数及逆转倍数。
lgIC50=lg最大剂量-lg(最大剂量/相临计量)[阳性反应率之和-(3-最大阳性反应率-最小阳性反应率)/4]
耐药倍数=(耐药细胞)/(亲本细胞)×100%
逆转倍数=逆转前MCF-7/ADR细胞IC50值/逆转后MCF-7/ADR细胞IC50值
3 结果
3.1 细胞生长曲线的绘制
连续培养7 d,细胞计数结果见表1,绘制细胞生长曲线,呈“S”型,见图1。
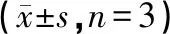
表1 流式细胞仪计数法细胞计数

图1 MCF-7/ADR细胞生长曲线
3.2 三氧化二砷游离药及纳米粒的细胞毒性结果
As2O3组、As2O3-PLA-NPs组、As2O3-mPEG-PLA-NPs组所计算的抑制率结果如表2~表4所示。空白纳米粒PLA-NPs、mPEG-PLA-NPs组所计算的抑制率结果如表5和表6。根据结果可知,给药组对细胞毒性作用呈浓度-时间依赖性,随着给药浓度及作用时间增加,药物对细胞毒性增强。各组与对照组比较,浓度大于2 μmol/L时,抑制率有显著差异,作用48 h后,各组抑制率明显提高。As2O3-PLA-NPs含药浓度为4 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为18.38%和25.86%;As2O3-mPEG-PLA-NPs含药浓度为4 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为22.40%和26.44%;As2O3-PLA-NPs含药浓度为16 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为51.65%和70.35%;As2O3-mPEG-PLA-NPs含药浓度为16 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为64.04%和85.41%;空白纳米粒对细胞抑制率实验表明各给药组抑制率均小于10%,证明纳米粒载体安全无毒,不会干扰实验结果。
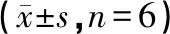
表2 As2O3组对MCF-7/ADR的抑制结果
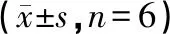
表3 As2O3-PLA-NPs组对MCF-7/ADR的抑制结果
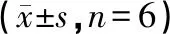
表4 As2O3-mPEG-PLA-NPs组对MCF-7/ADR的抑制结果

表5 PLA-NPs空白纳米粒不同时间抑制率结果

表6 mPEG-PLA-NPs空白纳米粒不同时间抑制率结果
3.3 As2O3-PLA-NPs对MCF-7/ADR细胞凋亡的结果
通过流式细胞仪检测计算出4、8、16 μmol/L 3个浓度时,三氧化二砷纳米粒分别诱导MCF-7/ADR凋亡48 h后,细胞在早晚期凋亡率,见图2、表7。
3.4 Hoechst荧光染色纳米粒对细胞凋亡的作用结果
用倒置显微镜观察蓝色荧光,结果见图3。由图观察得,随给药剂量增加,凋亡细胞增多;纳米粒组凋亡多于游离药物组,mPEG组48 h凋亡结果强于PLA组。
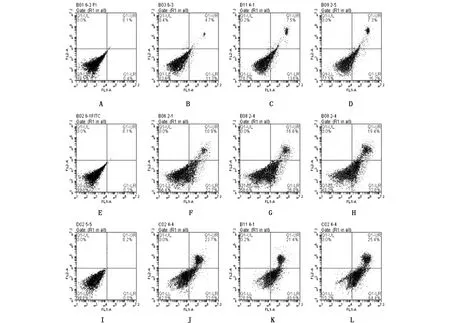
注:A、E、I分别为对照组;B、C、D分别为4 μmol/L的 As2O3、As2O3 -PLA-NPs、As2O3-mPEG-PLA-NPs ;F、G、H 分别为8 μmol/L的 As2O3、As2O3 -PLA-NPs、As2O3-mPEG-PLA-NPs ;J、K、L分别为16 μmol/L的 As2O3、As2O3 -PLA-NPs、As2O3-mPEG-PLA-NPs。图2 48 h各组药物不同浓度下对MCF-7细胞凋亡的流式细胞仪检测结果
表7 三氧化二砷及其纳米粒诱导MCF-7/ADR凋亡结果

注:A、E、I分别为对照组;B、C、D分别为4 μmol/L的 As2O3、As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs ;F、G、H分别为8 μmol/L的 As2O3、As2O3 -PLA-NPs、As2O3-mPEG-PLA-NPs ;J、K、L分别为16 μmol/L的As2O3、As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs。图3 不同浓度As2O3、As2O3-PLA-NPs、As2O3-mPEG-PLA-NPs对细胞凋亡的荧光染色
3.5 As2O3- NPs对MCF-7/ADR细胞周期的影响
通过流式细胞仪,检测不同药物纳米粒对MCF-7/ADR的细胞周期作用结果,见表8、图4。不论游离药物组还是纳米粒组,均阻滞细胞于G2/M期,所占细胞平均比例As2O3为26.48%,为31.37%,As2O3-mPEG-PLA-NP为35.79%,各组均有统计学意义(P<0.05)。
3.6 CCK-8法测得各组细胞的半数抑制率、耐药倍数和逆转倍数
通过CCK-8实验,在波长450 nm下测定ADM对人乳腺癌MCF-7和MCF-7/ADR的吸光度值(OD),根据公式计算抑制率,结果见表9。

注:A为阴性对照组;B、C分别为PLA、mPEG-PLA空白纳米粒;D为As2O3游离药物组,E为As2O3-PLA-NP;F为As2O3-mPEG-PLA-NP。图4 原料药及纳米粒对MCF-7/ADR的细胞周期作用结果

表8 原料药及纳米粒对MCF-7/ADR的细胞周期作用结果

表9 ADM对MCF-7、MCF-7/ADR细胞抑制作用结果
利用公式计算得出,ADM对MCF-7细胞IC50为12.59 μmol/L,对MCF-7/ADR细胞IC50为70.79 μmol/L,耐药倍数为5.62。
根据“2.2.2”得到的纳米粒对细胞毒性结果及实验分组,用药物浓度为1 μmol/L的As2O3、As2O3-PLA-NP、As2O3-mPEG- PLA-NP联合ADM,作用于MCF-7/ADR,ADM对MCF-7/ADR的IC50降低。当用As2O3、As2O3-PLA-NP、As2O3-mPEG-PLA-NP作逆转剂时,ADM对MCF-7/ADR的IC50分别为56.63、39.33、33.55 μmol/L;逆转倍数分别为1.32、1.80、2.11。结果见表10。

表10 ADM对细胞MCF-7/ADR的IC50及其逆转倍数(n=6)
4 讨论
本实验分别对游离药物、两组载药纳米粒对MCF-7/ADR细胞毒性、凋亡、周期的作用进行了实验研究。比较了游离三氧化二砷、三氧化二砷纳米粒对人乳腺癌耐药细胞MCF-7/ADR体外细胞生长的影响,各项结果显示,经PEG修饰的纳米粒子对抗耐药细胞的效果更显著。采用Annexin V/FITC-PI凋亡试剂盒考察了不同浓度三氧化二砷纳米粒对细胞的生长抑制作用,发现三氧化二砷纳米粒肿瘤细胞的抑制呈浓度和时间依赖性,As2O3-PLA-NPs含药浓度为16 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为51.65%和70.35%;As2O3-mPEG-PLA-NPs含药浓度为16 μmol/L时,24 h和48 h对细胞生长的平均抑制率分别为64.04%和85.41%,较PLA组显著提高(P<0.05)。细胞周期实验则发现,各给药组均阻滞细胞于G2/M期,所占细胞平均比例As2O3为26.48%,As2O3-PLA-NP为31.37%,As2O3-mPEG-PLA-NP为35.79%,各组件均有统计学意义(P<0.05)。用As2O3、As2O3-PLA-NP、 As2O3-mPEG-PLA-NP分别作逆转剂时,逆转倍数分别为1.32、1.80、2.11,As2O3-mPEG-PLA-NP效果最好。
综上所述,PLA为载体的纳米粒,作用效果强于游离药物,且随药物剂量的增加,对癌细胞的抑制效果也提高;经PEG修饰的聚乳酸载体,显示出更好的抗癌细胞作用效果。可能是由于药物被包裹载体材料后,增加了对细胞膜的亲和性,使药物更容易被细胞所摄取,而PEG的修饰,可以提高这种亲和作用,使药物更容易被细胞摄取,从而提高其抗肿瘤效果。对于增强凋亡的具体可能机制,还需通过进一步的实验进行研究。
