稀土元素掺杂上转换纳米材料在卫生分析领域中的应用
2021-05-14程娇娇孟佩俊张凌燕李淑荣梁青青张丽萍罗利霞
程娇娇,孟佩俊*,2,彭 微,张凌燕,2,靳 敏,2,李淑荣,2,梁青青,2,张丽萍,2,罗利霞*,2
(1.内蒙古科技大学包头医学院公共卫生学院,内蒙古包头 014040;2.内蒙古自治区卫生检测与评价工程技术中心,内蒙古包头 014040)
1 前言
稀土元素(Rare Earth Elements,REEs)具有独特的4f、5d电子层结构、优异的能量转移、双光子/多光子吸收和上转换发光等功能,由REEs掺杂于晶体构成的稀土掺杂上转换纳米材料(REEs-UCNPs)融稀土与纳米颗粒的独特性与优异性于一体,是近年来新兴的一种稀土纳米荧光材料,它能够通过能量转移和双光子/多光子吸收机制把近红外光转换成短波辐射(可见光),其在卫生检测等领域的应用日益广泛。
与传统的下转换荧光材料(如有机染料、荧光蛋白、量子点等)相比,REEs-UCNPs具有光学/化学稳定性好、发光强度高而稳定、荧光寿命长、生物相容性好等显著优点。另外,因近红外光为REEs-UCNPs的激发光,将其应用于生物体内发光和成像研究,可以有效地避免生物体内自发荧光的干扰,同时对生物组织具有良好的穿透能力,且对组织和组织分子(如DNA、蛋白质等)的损伤小,能有效提高分析检测的灵敏度和信噪比[1]。此外,REEs-UCNPs作为新兴一代生物发光材料,可通过调节所掺杂的REEs的种类和基质材料,在同一波长激发光激发下实现多色上转换发光,实现多目标物的同时标记与检测[2]。鉴于REEs-UCNPs上述显著优点,近些年来,基于REEs-UCNPs开发了一系列应用于卫生样品中各种物质的分析检测方法。本文从共振能量转移体系构建、REEs-UCNPs表面修饰基团、检测原理、分析方法和检测能力等方面就REEs-UCNPs应用于卫生样品中金属离子、有机化合物、活性氧自由基和生物大分子等的最新分析检测方法的研究进行了综述。
2 REEs-UCNPs在卫生分析检测中的应用
目前,基于REEs-UCNPs纳米探针的分析检测技术多集中于构建荧光共振能量转移(FRET)体系或者发光共振能量转移(LRET)体系来实现。其原理是上转换纳米材料受近红外光激发产生的荧光被受体所猝灭,因供体相应的发射波段与受体的激发波段重叠,使供体传递了一部分能量而使自身荧光强度下降。由于REEs-UCNPs在980 nm近红外光激发下能够发出强烈的可见光,因此REEs-UCNPs被用作体系中的能量供体。其荧光激发波长为近红外光,且在此波段中绝大部分分子无法被激发,能显著降低生物本底荧光,提高灵敏度、降低激发光对生物体的损伤。此外,基于REEs-UCNPs的纳米传感器和荧光免疫方法也逐步兴起,在物质的定性或定量检测中应用日益广泛。相比其他荧光材料,基于REEs-UCNPs应用与卫生样品中各类物质的分析检测方法均显示出高灵敏度、高选择性和省时简便等显著优势。
2.1 金属离子
卫生样品中金属离子的常规检测方法,包括原子吸收分光光度法、原子荧光光谱法、电感耦合等离子体发射光谱法、电感耦合等离子体质谱法、电位溶出法、离子色谱法等等。但这些方法繁杂的样品预处理、较高的仪器设备要求和存在不同程度的干扰等缺点,在一定程度上限制了他们在卫生分析领域中的普及性和快速检测方面的适用性。近十年来,REEs-UCNPs的兴起为开发简单易行的分析检测方法提供了新思路。在实际应用中,为提高REEs-UCNPs的水溶性及其检测的灵敏度、选择性,往往需要在REEs-UCNPs表面修饰不同的功能基团或者结合金纳米颗粒(Au NPs)、银纳米颗粒(Ag NPs)等。常见的功能基团如邻苯二胺(OPD)、聚乙烯亚胺、3,3′,5,5′-四甲基联苯胺(TMB)等。2017年的一项研究结果显示,在REEs-UCNPs(NaYF4∶Yb,Tm)的表面修饰OPD可用于检测自来水中的Ag+的含量[3],检测限为33 nmol/L。除OPD修饰以外,Shao等[4]研究发现,支化聚乙烯亚胺功能化的REEs-UCNPs(NaYF4∶Yb,Er)通过比色和荧光检测法,同样可用于检测自来水中Cu2+的含量,检测限为45 nmol/L,具有较高的灵敏度和选择性。Yang等[5]采用Zn2+特异性DNA酶与REEs-UCNPs(NaYF4∶Yb,Tm)结合形成纳米传感器(DNAzyme-UCNPs),可用于检测活细胞中的Zn2+含量,同时监测活体模型中Zn2+的动态分布情况。Vijayan等[6]同样使用DNA功能化的REEs-UCNPs(NaYF4∶Yb,Tm)完成了对饮用水中Hg2+的定量检测,检测下限为0.14 nmol/L,远低于美国环保局对饮用水中Hg2+的限量值(2 nmol/L)。同年,Meng等[7]研制了TMB功能化的REEs-UCNPs(NaYF4∶Yb,Er)上转换纳米探针,在0.217~100 μmol/L浓度范围内对Fe3+的检测具有高灵敏度和高选择性,检测限为100 μmol/L,且检测系统的颜色变化很容易被肉眼识别。
除在REEs-UCNPs表面修饰不同功能基团外,结合Au NPs或Ag NPs的REEs-UCNPs,基于二者间的荧光共振能量转移原理,同样适用于卫生样品中金属离子的分析检测。2018年,Liu等[8]采用长链适配体功能化的REEs-UCNPs(NaYF4∶Yb,Er)和短链适配体功能化的Au NPs,研制出一种检测Hg2+的启动型纳米传感器,线性范围0.2~20 μmol/L,检测下限为60 nmol/L,适用于自来水和牛奶样品中Hg2+的测定。Sun等[9]选择SiO2核壳包覆的REEs-UCNPs(NH2-NaYF4∶Yb,Er/NaYF4@SiO2)和未修饰的Au NPs,实现了饮用水中Cd2+的检测,检测限为59 nmol/L。同年,Chen等[10]改变了REEs-UCNPs体系,利用适配体功能化的REEs-UCNPs(NaYF4∶Gd,Yb,Ho)和磁性Fe3O4修饰的Au NPs,设计出定量检测茶叶和废水中Pb2+的荧光纳米探针,检测范围为25~1 400 nmol/L,检测限可达5.7 nmol/L。Liu等[11]改用柠檬酸盐修饰的Ag NPs(Cit-AgNPs)与REEs-UCNPs(NaY/GdF4∶Yb,Er)混合体系,建立了一种高选择性检测Cr3+的无标记荧光分析方法,Cr3+检测范围为0.5~40 μmol/L,检测限为34 nmol/L,可用于自来水和速溶茶样品中Cr3+的定量分析检测。
REEs-UCNPs在金属离子的分析检测方面发挥着重要作用,显示出高灵敏度、高选择性、省时省力,方便快速等独特优势。近十年内,基于REEs-UCNPs检测金属离子的典型研究列于表1。

表1 基于REEs-UCNPs分析检测金属离子典型示例
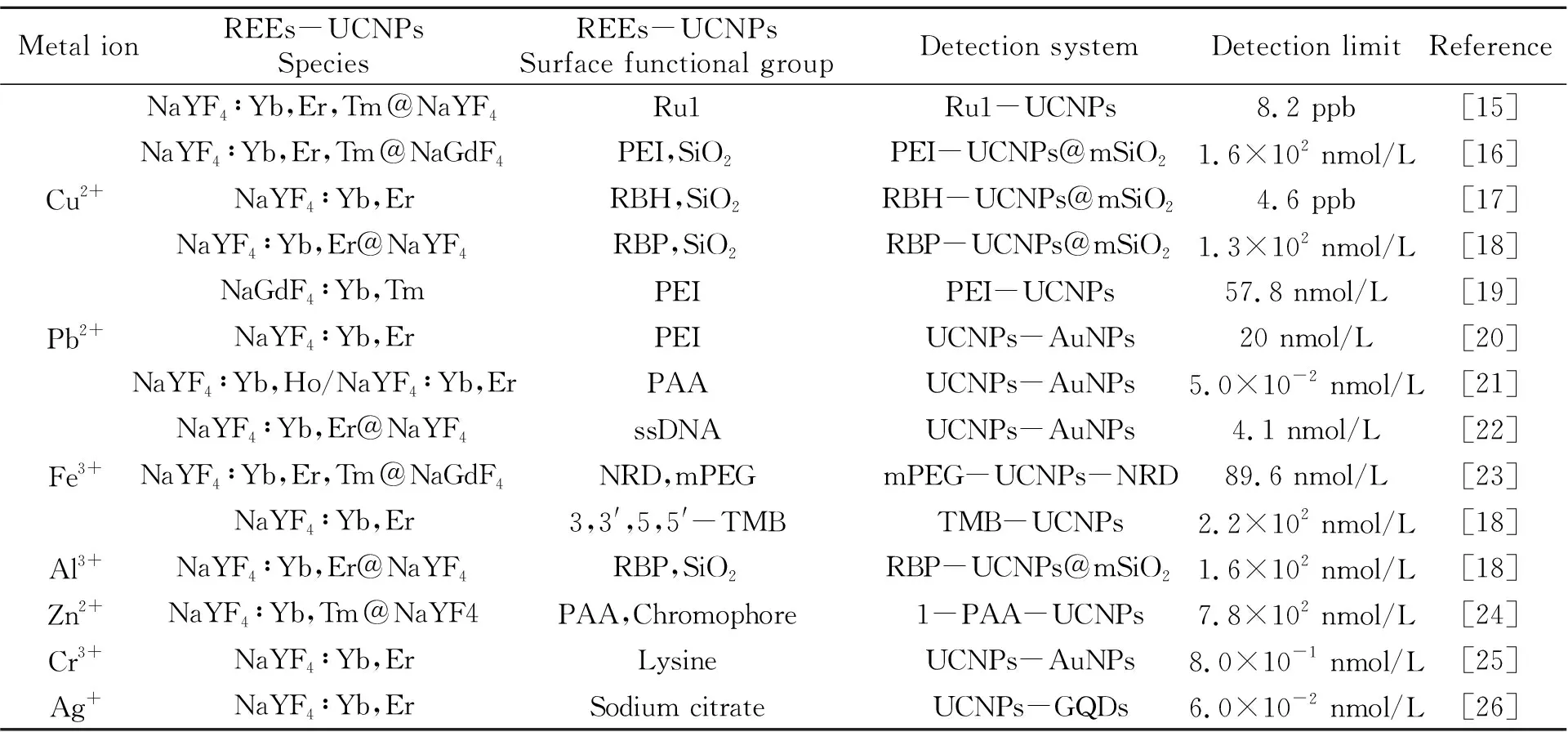
(续表1)
2.2 有机化合物
2.2.1 有机小分子日常生活中,人体每时每刻都在接触各种有机化合物,因此建立灵敏度高、选择性好的新型检测方法对于满足人们日益增长的对高品质健康生活的追求具有重要意义。2015年,Wu等[27]利用REEs-UCNPs-Au NPs之间的FRET原理,从牛奶样品中成功检测到三聚氰胺(MEL)的含量。REEs-UCNPs-Au NPs发生FRET效应导致荧光猝灭,当加入MEL后,Au与MEL之间的Au-N键结合致使Au NPs脱离UCNPs表面,进而使荧光恢复,其荧光强度与样品中MEL含量成正比。检测线性范围为32~500 nmol/L,检出限为18.0 nmol/L。同样在食品检测领域,Hu等[28]设计带有酸性/PEG杂化配体的REEs-UCNPs探针,将虾细胞置于罗丹明B(RhB)浓度大于3 μg/mL的水溶液中孵育12 h后,实现了虾体内中RhB残留量的快速检测。同年,Chen等[29]利用UCNPs和方酸-铁(SQA-Fe3+)的内过滤效应,制备出高灵敏度的用于检测人血清中葡萄糖水平的纳米传感器,检测葡萄糖浓度的线性范围在7~340 μmol/L之间,检出限为2.3 μmol/L,目前已成功应用于人血清中葡萄糖的监测。2018年,Zhao等[30]构建了REEs-UCNPs荧光探针,利用荧光猝灭机制直接检测新鲜人血清等生物体液中的多巴胺(DA)含量。随后,Pulgarín等[31]建立了高灵敏度共振光散射传感器,成功从尿液中完成DA的检测,检测线性范围为0~300 μmol/L,检出限为1.62 μmol/L。
另外,农药残留的检测历来是卫生分析领域持续关注的重要课题,由于其本底含量较低,对其检测灵敏度提出更高的要求,常规分析方法往往需要在样品预处理阶段对其进行富集,过程复杂,回收率不高。因此,开发基于REEs-UCNPs实现农药残留的高灵敏检测方法具有重要意义。2019年,Wang等[32]利用乙酰胆碱酯酶(AChE)调节的UCNPs-Cu2+传感器检测有机磷农药(OPs)的残留量。其检测原理为:Cu2+对REEs-UCNPs荧光有较强的猝灭作用,加入AChE后,其酶解产物硫代胆碱从UCNPs-Cu2+混合物中捕获Cu2+从而荧光恢复;而OPs具有不可逆地抑制AChE活性作用,使硫代胆碱生成减少,从而降低荧光恢复。该方法检测OPs的线性范围为0.1~50 ng/mL,检出限为0.05 ng/mL。2020年,Saleh等[33]利用REEs-UCNPs研制了光学传感器膜,成功应用于农药灭草净残留量的检测,检测线性范围为0.23~1.5 μmol/L,检测限为68 nmol/L,方法分析时间短,响应时间仅需7 min。
2.2.2 激素近年来,基于REEs-UCNPs快速检测卫生样品中激素的方法同样得到广泛应用。2017年,姜会聪等[34]将REEs-UCNPs偶联单克隆抗体(mAb)形成的UCNPs-mAb探针,用于快速定量检测牛奶中天然激素雌二醇(E2)。该方法特异性强,稳定性好,灵敏度高,检测线性范围为5~2 000 ng/mL,检出限低至2.75 ng/mL。同年,基于REEs-UCNPs的免疫层析试纸条同样适用于人工合成激素己烯雌酚的定量检测[35]。REEs-UCNPs(NaYF4∶Yb,Er)与己烯雌酚(DES)单克隆抗体偶联,硝酸纤维膜上的牛血清白蛋白(BSA)-DES偶联物和羊抗鼠二抗分别为试纸条T线和C线。检测时间仅需15 min,且检测设备轻巧便携,适用于食品中DES的现场大批量快速定量检测。此外,2019年,Hu等[36]利用REEs-UCNPs与阿霉素之间FRET机制,在小鼠血液内检测到浓度为0.005 μg/g的阿霉素,检测灵敏度高,表明REEs-UCNPs可用于血液中阿霉素残留的快速分析检测。基于REEs-UCNPs应用于激素类物质的检测方法均具有快速、便捷、高效等优点,适用于现场实时批量检测,在卫生分析检测领域发挥着举足轻重的重要作用。
2.2.3 生物毒素常见的生物毒素,如赭曲霉毒素、葡萄球菌肠毒素和黄曲霉毒素等,容易通过生物链富集进入人体内,进而对人体健康产生严重危害。对生物毒素检测的常规分析方法有薄层色谱法、气相色谱法、高效液相色谱法、酶联免疫吸附法等。目前,基于REEs-UCNPs构建的生物传感器检测生物毒素的方法因其简便、快捷、灵敏度高等优点而备受关注。赭曲霉毒素A(OTA)分布最广、属于与人们健康最为密切的一种生物毒素,2016年,Dai等[37]利用REEs-UCNPs和cDNA-MNPs研制出近红外磁性适配体传感器用于检测OTA。检测线性范围为0.01~100 ng/mL,检测限低至0.005 ng/mL。该传感器具有较高的灵敏度和良好的选择性,也可用于啤酒样品中OTA的测定。在上述研究基础上,2018年,Jo等[38]制备出检测OTA的LRET适配体传感器,可以在10 min内选择性地检测有色食品样品中的真菌毒素,简化了生物检测步骤,形成高效快捷的检测OTA新型手段。此外,葡萄球菌肠毒素B(SEB)也是一种是可以导致人体机能严重失调的生物毒素,Wu等[39]构建了Au NR@Pt-UCNPs适配体传感器实现SEB的快速准确检测,检测线性范围为2.0~400 pg/mL,检测限低至0.9 pg/mL,可用于添加牛奶样品中SEB的测定。黄曲霉毒素B1(AF B1)是已知的致癌性最强的一种生物毒素,2020年欧阳秀酝等[40]研制了UCNPs-Au NPs免疫传感器用于食品中AF B1的快速定量检测,检测线性范围为0.05~20 ng/mL,检测限低至0.02 ng/mL,方法具有高灵敏度和高特异性。总之,基于REEs-UCNPs的生物传感技术极大地提高了食品中生物毒素检测的准确度和灵敏度,具有广泛的适用性,为基于REEs-UCNPs的生物传感技术用于其他物质的检测方法开发提供了思路。
2.3 活性氧自由基
活性氧自由基(ROS)属于生物体内高活性分子,包括超氧阴离子、羟自由基和过氧化氢等,由于其与人体健康关系密切,其定性定量分析是当前卫生分析领域的研究热点之一。基于REEs-UCNPs对ROS进行活体内检测简便高效。2019年,Hao等[41]开发出UCNP@MOF-NiSx纳米组装体,适用于生物体内ROS的定量和选择性检测。在以H2O2为活细胞中ROS验证目标时,UCNPs@MOF-NiSx成功定量监测到了生物体内的H2O2,实现了生物体内ROS的检测功能。同年,Zhang等[42]研制出高选择性的Ru@UCNPs纳米探针,用于无背景的HOCl检测,检测限为0.21 μmol/L。此外,Song等[43]设计出具有超高的灵敏度的CMS-UCNPs@偶氮染料纳米探针,对 ·OH进行体内外的定量检测,检测限低至0.10 fmol/L。2020年,Yu等[44]利用REEs-UCNPs和亚甲基蓝(MB)之间的FRET原理,设计了具有高度选择性和高灵敏度的检测 ·OH 的探针。检测 ·OH的浓度可通过MB氧化损伤引起的REEs-UCNPs荧光恢复的程度来确定。
2.4 生物大分子
2.4.1 核酸近些年来,对生物大分子检测的新型检测方法逐渐增多,基于REEs-UCNPs的高灵敏度、高特异性的核酸定量检测与定性方法取得了一定成果。2015年,Zhu等[45]利用REEs-UCNPs与染料标记适配体之间的FRET作用,研制了检测特定序列DNA的新型适配体传感器。检测靶DNA序列的线性浓度范围为40~200 nmol/L,检出限为2.8 nmol/L,适用于分析检测人体唾液和血清样本中的溶菌酶水平。随后,2016年的一项研究显示,表面修饰有变性牛血清蛋白的REEs-UCNPs(NaYF4∶Yb,Er)与核酸单链耦联形成荧光探针,利用碱基堆积原理可对DNA进行精准检测[46]。同年,在实现DNA精确检测后,Kim等[47]基于REEs-UCNPs开发出新的FRET系统用于检测CDKN2A基因的DNA甲基化水平,为后续分子诊断提供了研究基础。
此外,利用REEs-UCNPs检测RNA的研究也受到广泛关注。2018年,Liu等[48]采用UCNPs@DNA共轭探针,并结合电感耦合等离子体质谱对microRNA-21(miRNA-21)进行定量检测。0.1~500 fmol/L范围内miRNA-21表现出很高的灵敏度,检测下限为41 amol/L。除体外检测miRNA外,同年,Gao等[49]在Au NPs表面包覆Pt和UCNPs颗粒形成Pt-UCNPs@Au NR体系,在活细胞中实现了胸苷激酶I miRNA的高选择性检测,检测范围1.17~65.21 fmol/10μg,检出限为0.67 fmol/10μg。随后,Lu等[50]采用REEs-UCNPs(NaGdF4∶Yb,Er@NaYF4)纳米材料,同Au NPs和以miRNA155双修饰互补的DNA序列耦联,设计出UCNPs-DNA-Au NPs探针用于定量检测miRNA155,检测范围为0.1~15 nmol/L,检出限低至0.045 nmol/L。
2.4.2 蛋白质目前,基于REEs-UCNPs的蛋白质定量检测技术已成为研究热点之一。2015年,Zhou等[51]利用单带REEs-UCNPs(SB-UCNPs)实现对靶向性肿瘤癌蛋白的原位定量检测。随后,Liang等[52]根据MnO2包覆的REEs-UCNPs同抗坏血酸之间的氧化还原反应,对碱性磷酸酶进行了定量检测,检测线性范围为0.25~150 mU/mL,检出限为0.045 mU/mL。除直接利用REEs-UCNPs进行检测外,2016年,朱瑾等[53]开发出REEs-UCNPs荧光免疫层析试纸条,能够快速测定血清中的降钙素原,检测线性范围为0.05~50 μg/L,检测限为0.020 μg/L,方法简便快捷,灵敏度高、选择性好,为实现快速检测提供了新的研究思路。2017年,Chen等[54]基于REEs-UCNPs设计出定量检测甲胎蛋白(AFP)的近红外光触发光电化学(PEC)传感器,检测AFP线性范围为0.05~100 ng/mL,检测限达0.04 ng/mL。2018年,Li等[55]采用羧基功能化的REEs-UCNPs和Ag NPs设计出夹心式单粒子计数免疫分析法,用于流室中前列腺特异性抗原的定量检测,在Tris-Buffered生理盐水中检测PSA的动态范围为0~500 pm,检测限为1.0 pm,在血清样本获得的检测限为2.3 pm,体现出该方法较高的实用性和应用范围。
此外,基于REEs-UCNPs实现多种物质的同时分析检测成为近年来该领域的一个研究热点。例如,Zhan等[56]通过制备两种大小和形貌相似、发射光谱不同的REEs-UCNPs,采用侧向流动分析技术,可以快速、简便、经济的实现血清中降钙素原和C反应蛋白(CRP)的双重定量检测,检出限分别低至0.12 ng/mL和0.24 μg/mL。2020年,Sun等[57]基于REEs-UCNPs和Au NPs之间的FRET体系,开发出谷胱甘肽(GSH)和Cd2+的双功能检测系统,该体系中GSH和Cd2+的检测限分别为0.016 μmol/L和0.059 μmol/L,具有较高的选择性,适用于人体血浆中GSH和饮用水中Cd2+的检测。
3 总结与展望
REEs-UCNPs作为新兴一代的荧光纳米探针,具备多种独特的光/化学性质,适用于卫生样品中多种物质的分析检测。本文就REEs-UCNPs对卫生样品中金属离子、有机化合物、活性氧自由基和生物大分子等的最新分析检测方法的研究应用和进展进行了综述,并对基于REEs-UCNPs分析检测金属离子的典型示例进行了归纳总结。在这些研究中,利用REEs-UCNPs构建的FRET体系和LRET体系实现各类物质的检测具有灵敏度高、准确度高,简便、快速、经济等优异特点,研究成果进展迅速,体现了REEs-UCNPs在卫生分析检测方面的巨大优势和在卫生分析领域中发挥着越来越突出的重要作用。
尽管REEs-UCNPs在卫生分析领域取得了一定进展,但仍面临着诸多问题,有待深入研究。第一,相对较低的上转换效率在一定程度上限制了其灵敏度的进一步提高。目前,提高上转换效率是一个很大的技术挑战,有待进一步研究探索。第二,通常情况下,为保证合成的REEs-UCNPs稳定性,其表面往往覆盖有疏水层,为便于检测应用,需要在后期对其进行改性,即在外表面包覆亲水基团,但这一环节会在一定程度上破坏合成的REEs-UCNPs的结构并降低其荧光效率,因此开发新的水溶性好、稳定性好、可以直接应用于卫生检测领域的REEs-UCNPs势在必行。第三,目前对REEs-UCNPs生物安全性的研究仅仅在细胞实验方面,动物实验研究比较少,虽然目前的一些研究声称REEs-UCNPs在短期应用下不会对生物体造成较大的毒性损害,但对其长期毒性、慢性毒性及具体毒性作用机制等方面仍没有明确的研究结果。这在一定程度上限制了REEs-UCNPs应用范围。因此,一方面,需要对REEs-UCNPs的生物毒性进行深入研究探索;另一方面,鉴于REEs-UCNPs本身独特的优势,采用绿色合成方法制备生物相容性好、环保健康的REEs-UCNPs意义重大,其临床应用未来可期。第四,将基因芯片技术、生物传感技术、荧光免疫技术和计算机云技术等现代技术结合起来,发展基于REEs-UCNPs的传感生物芯片,实现多组分、快速、实时、准确的定性定量分析值得期待。总之,REEs-UCNPs作为新兴一代的荧光纳米探针,在卫生分析检测领域积淀了许多优异的研究成果,进一步优化改进空间巨大,具有良好的发展潜力。
