基于磷光量子点-表面印迹材料细胞色素c人工抗体的制备及其应用
2021-05-14杨文丽孙晓杰吕金枝苗艳明
杨文丽,孙晓杰,吕金枝,苗艳明
(山西师范大学生命科学学院,山西临汾 041000)
蛋白质已成为后基因组时代生命科学和生物医学等相关领域研究的焦点。然而,长期以来抗原-抗体识别的方法是经典的蛋白质分析方法,而量子点(Quantum Dots,QDs),表面分子印迹聚合物(Surface Molecularly Imprinted Polymers,SMIPs)纳米复合材料(QDs-人工抗体)为经典蛋白分析方法开启了新的解决方案。QDs的粒径大小与蛋白等生物大分子相匹配,而QDs又具备优异发光特性,因此QDs是蛋白分子的传感的较理想材料[1,2]。但QDs对蛋白质的识别无特异性。而SMIPs是模仿自然界抗原-抗体反应原理[3,4],对目标分子具有较高的专一识别性能[5],且具有性质稳定、易于保存、成本低等特点[6 - 8]。
目前,有关QDs的SMIPs主要是基于QDs的荧光性质[8 - 11],但生物样品所具有的背景荧光干扰使其在实际应用中受到局限,由于生物样品中磷光极为少见,因此QDs的室温磷光(RTP)性质可以有效地避免上述情况的发生[12,13]。本研究发展了一种既具有人工抗体功能又具有室温磷光特性的Cyt c QDs-SMIPs纳米复合材料,并实现对Cyt c的选择性识别分析。
1 实验部分
1.1 仪器、试剂与材料
磷光由Cary Eclipse荧光分光光度计(美国,瓦里安有限公司)测定;pH值由pH酸度计(上海安莱立思仪器(中国)科技有限公司)测量;Mn-ZnS QDs的形貌采用JEM-2100透射电子显微镜(TEM)(日本,电子)测量;QDs-SMIPs形貌由SU8020场发射扫描电子显微镜(SEM)(日本,日立公司)测量;紫外-可见光谱通过岛津UV-29100分光光度计进行测定。
3-巯基丙酸(MPA)、牛血清蛋白(BSA)和卵白蛋白(OB)购于北京百灵威科技有限公司;Na2S·9H2O购于上海源叶生物有限公司;Zn(Ac)2·2H2O和Mn(Ac)2·4H2O购于天津市科密欧化学试剂有限公司;3-氨丙基三乙氧基硅烷(APTES)、正硅酸乙酯(TEOS)、十二烷基硫酸钠(SDS)和细胞色素c(Cyt c)购于Sigma(美国);NaOH购于天津市风船化学试剂科技有限公司。所用的试剂均为分析纯,超纯水(18.2 MΩ·cm)采用WaterPro超纯水系统(美国Labconco公司)制备。
1.2 Mn-ZnS QDs的合成
Mn-ZnS QDs在已有文献方法[14]的基础上合成。简要过程为:取100 mL 0.04 mol·L-1MPA溶液,10 mL 0.1 mol·L-1的Zn(Ac)2溶液,4 mL 0.01 mol·L-1的Mn(Ac)2溶液,加入到250 mL的三颈烧瓶中。然后用1 mol·L-1NaOH溶液将上述溶液的pH值调节至11,隔绝空气反应30 min后,再用注射器将10 mL 0.1 mol·L-1的Na2S溶液加入到上述溶液中,密闭搅拌反应20 min。将得到的上述溶液50 ℃陈化2 h。加入同等体积的无水乙醇使QDs沉降,高速离心得到沉淀,真空干燥24 h,即可得到所需的Mn-ZnS QDs粉末。
1.3 Cyt c QDs-SMIPs人工抗体纳米复合材料的合成
将5 mg的模板分子Cyt c,10 mL 1 mg·mL-1的Mn-ZnS QDs溶液,20 μL APTES依次加入到两口烧瓶中,搅拌30 min,再加入0.10 mL TEOS溶液和0.10 mL氨水,反应12 h。将得到的QDs-SMIPs离心,并用0.5%SDS溶液洗涤。非印迹聚合物(QDs-SNIPs)的制备过程除没加模板分子外其余步骤同上。
1.4 磷光检测
首先制备浓度为250 μmol·L-1的Cyt c溶液,然后在比色管中依次加入500 μL 0.2 mol·L-1磷酸盐缓冲溶液(PBS,pH=7.4),50 μL 1 mg·mL-1QDs-SMIPs或QDs-SNIPs溶液,以及不同体积的Cyt c溶液,定容至5 mL,摇匀,反应5 min,用305 nm为激发波长测定其磷光。
2 结果与讨论
2.1 磷光QDs及QDs-SMIPs的表征
由Mn-ZnS QDs的透射电镜图(图1(a))可知Mn-ZnS QDs粒径约为3.5 nm左右。该QDs的最大磷光激发峰为305 nm(图1(b)曲线1),最大磷光发射峰为590 nm(图1(b),曲线2),该室温磷光性质由Mn2+的4T1-6A1的跃迁产生[15],ZnS母体吸收激发光后,其电子受到激发,空穴则被Mn2+俘获,电子和空穴各自在Mn2+上复合导致Mn2+的激发,完成三重态(4T1)到基态(6A1)的跃迁并产生橙色磷光[11,16]。
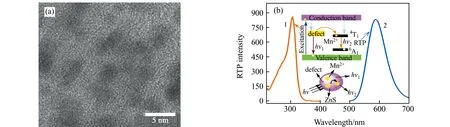
图1 (a)Mn-ZnS QDs透射电镜(TEM)图;(b) Mn-ZnS QDs的激发光谱(曲线1)和发射光谱(曲线2)图Fig.1 (a) TEM image of Mn-ZnS QDs;(b) Excitation(curve 1) and emission(curve 2) spectra of Mn-ZnS QDs
图2(a)为QDs-SMIPs的扫描电镜图,由图中可知QDs-SMIPs的粒径明显大于图1(a)Mn-ZnS QDs的粒径,表明SMIPs已经成功包覆在Mn-ZnS QDs的表面。图2(b)为QDs-SMIPs、QDs-SNIPs和QDs的红外光谱。1 141 cm-1处的强峰为Si-O-Si的伸缩峰,785 cm-1为Si-O的振动峰,3 142 cm-1处的峰为C-H的伸缩峰,3 440 cm-1和1 628 cm-1为N-H的伸缩振动峰,这表明QDs的表面已经包覆了印迹材料。由于QDs-SMIPs和QDs-SNIPs成分相似,所以两者的主要吸收峰的位置也相似。
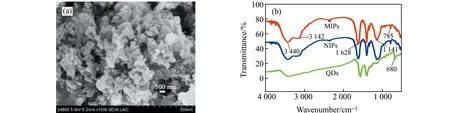
图2 (a) QDs-SMIPs人工抗体纳米复合材料的扫描电镜(SEM)图;(b)QDs-SMIPs、QDs-SNIPs人工抗体纳米复合材料和Mn-ZnS QDs傅立叶红外(IR)光谱图Fig.2 (a) SEM image of QDs-SMIPs artificial antibody nanocomposites;(b) IR spectra of QDs-SMIPs,QDs-SNIPs artificial antibody nanocomposites and Mn-ZnS QDs
2.2 影响QDs-SMIPs稳定的因素
由图3(a)可知,QDs-SMIPs的磷光强度随着pH值的增大呈上升趋势,pH值7.5时QDs-SMIPs的磷光强度达到最大值。且在pH为7.0~8.0范围内相对稳定。由于生理pH值为7.4,因此将7.4作为该传感体系的最佳pH值。QDs-SMIPs的磷光强度在80 min内(图3(b)),及0.7 mol·L-1较高盐浓度下(图3(c))基本保持相对稳定。

图3 pH值(a)、时间(b)和盐浓度(c)对QDs-SMIPs人工抗体纳米复合材料的影响Fig.3 Effects of pH (a),time (b) and salt concentration (c) on QDs-SMIPs artificial antibody nanocomposites
2.3 QDs-SMIPs的识别性能
2.3.1 QDs-SMIPs对目标蛋白的识别分析由图4(a)可知,随着Cyt c浓度的逐渐增加,QDs-SMIPs的磷光强度逐渐降低,且磷光猝灭强度与Cyt c浓度之间呈良好的线性关系,线性范围为0.25~5.0 μmol·L-1,检出限为0.015 μmol·L-1,相关系数R=0.999,相对标准偏差为3.66%。比较图4(a)和图4(b),QDs-SMIPs对Cyt c的识别效果明显优于QDs-SNIPs人工抗体纳米复合材料,表明QDs-SMIPs对Cyt c具有更强的结合能力。

图4 不同浓度Cyt c与QDs-SMIPs(a)和QDs-SNIPs(b)人工抗体纳米复合材料磷光的关系Fig.4 Relationship between Cyt c concentrations and phosphorescence of QDs-SMIPs(a) and QDs-SNIPs (b) artificial antibody nanocompositesAll solutions were prepared in PBS(20 mmol·L-1,pH=7.4).
与其他纳米材料检测Cyt c方法的比较[16 - 21]见表1。本研究中的QDs-SMIPs检测Cyt c的检出限低于或相当于其他方法。更重要的是该方法是基于QDs的磷光性质,能够避免生物样品背景荧光的干扰,提高了检测效率和检测特异性,且减少了生物样品复杂的前处理过程。
2.3.2 QDs-SMIPs的竞争实验为验证QDs-SMIPs对目标蛋白Cyt c的特异性识别能力,本研究进行了竞争实验。由图5(a)和图5(b)可看出,随着cOB/cCytc和cBSA/cCytc比值的增加,QDs-SMIPs的磷光强度变化较小,原因在于Cyt c与QDs-SMIPs表面的印迹位点相匹配,QDs-SMIPs可以特异地结合Cyt c,进而引起QDs-SMIPs明显的室温磷光强度变化。而竞争蛋白因为与印迹位点不匹配,结合能力较弱,因此不会明显影响QDs-SMIPs对Cyt c识别。竞争实验进一步证明该QDs-SMIPs对Cyt c具有较强的特异识别能力。
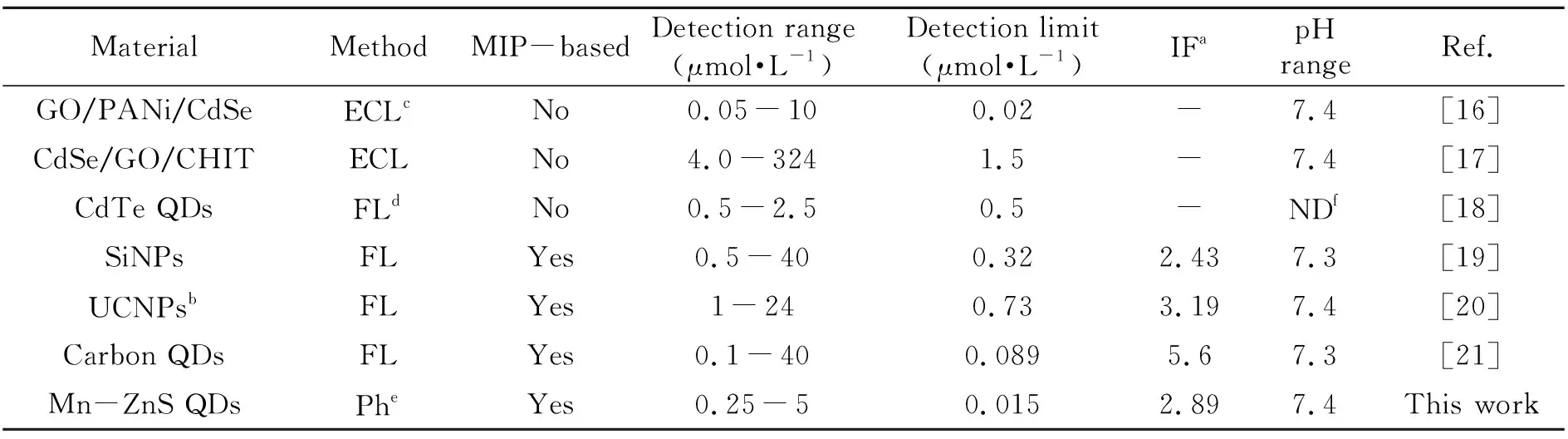
表1 测定Cyt c含量方法的比较

图5 争蛋白OB(a)和BSA(b)对QDs-SMIPs人工抗体纳米复合材料识别Cyt c(5 μmol·L-1)的影响Fig.5 Effects of competitive proteins OB(a) and BSA(b) on QDs-SMIPs artificial antibody nanocomposites in Cyt c(5 μmol·L-1) identificationPBS(20 mmol·L-1,pH 7.4).
2.3.3 QDs-SMIPs的吸附-解吸性能图6(a)为5 μmol·L-1的Cyt c蛋白质溶液经QDs-SMIPs和QDs-SNIPs吸附前后的紫外-可见光谱。吸附前(曲线1)与QDs-SNIPs吸附后Cyt c的紫外可见吸收值(曲线2)相比变化较小,但经QDs-SMIPs吸附后上清液中Cyt c的浓度明显降低(曲线3),依据紫外吸收光谱计算QDs-SNIPs的平均吸附容量为3.92 μmol·L-1,QDs-SMIPs的平均吸附容量为0.86 μmol·L-1(图6(b)),说明印迹材料对模板分子具有良好的富集能力,而QDs-SNIPs由于没有印迹位点,主要是非特异性吸附。
本研究还对QDs-SMIPs的解吸特性进行了分析。用0.5%SDS溶液洗涤吸附Cyt c后的QDs-SMIPs,并测定水相中Cyt c的最终浓度,然后通过洗脱液中Cyt c与QDs-SMIPs吸附Cyt c的量的比值计算解吸率,吸附-解吸循环5次。由图6(c)可知,随着吸附-解吸次数的增加,吸附率变化在92%~95%之间(图6(c)插图),吸附量和解吸量呈逐渐减少趋势。这可能与洗涤过程中QDs-SMIPs的损失有关,但总体变化都较小。以上结果表明在反复使用5次的情况下QDs-SMIPs的解吸能力基本保持稳定。
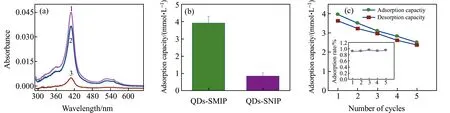
Fig.6 (a) 5 μmol·L-1的Cyt c蛋白质溶液紫外-可见光谱(曲线1),QDs-SNIPs吸附后的紫外-可见光谱(曲线2),QDs-SMIPs吸附后的紫外-可见光谱(曲线3);(b)QDs-SMIPs和QDs-SNIPs吸附Cyt c的量;(c)在吸附-解吸循环5次条件下,QDs-SMIPs吸附量和解吸量以及解吸率(插图)的变化情况Fig.6 (a) The UV-Vis spectrum of 5 μmol·L-1 Cyt c protein solution(curve 1),the UV-Vis spectrum after QDs-SNIPs adsorption(curve 2),the UV-Vis spectrum after QDs-SMIPs adsorption(curve 3);(b) The amount of Cyt c adsorbed by QDs-SMIPs and QDs-SNIPs;(c) Under the condition of 5 cycles of adsorption-desorption,the changes of adsorption,desorption capacity and desorption rate(Illustrated) of QDs-SMIPs
2.3.4 QDs-SMIPs的干扰实验为考察生物体样品中的一些常见金属离子和生物分子对QDs-SMIPs检测体系的影响,进行了干扰实验。将干扰物加入到QDs-SMIPs和Cyt c的混合溶液中,测量室温磷光强度,结果表明,100 000倍Na+,10 000倍的K+、Mg2+、葡萄糖,500倍的Ca2+,0.05倍的Al3+,0.04倍的Cu2+,0.02倍的Fe3+、谷氨酸,200倍的丙氨酸、酪氨酸、蛋氨酸、甘氨酸、亮氨酸、脯氨酸,100倍的赖氨酸,50倍的精氨酸对室温磷光强度基本无影响,部分金属离子(Al3+、Cu2+、Fe3+)对该检测体系影响较大,但生物样品中这些金属离子含量很低,影响较小,并可通过稀释样品的方法进一步降低其影响。以上结果表明QDs-SMIPs检测体系对Cyt c具有较好的选择识别能力。
2.4 Cyt c猝灭QDs-SMIPs磷光的机理
Cyt c属具有铁卟啉中心的含铁蛋白质,其中所含的Fe(Ⅲ)是一种高效的猝灭剂,具有电子传递功能[22]。QDs受到光激发时,Cyt c(Ⅲ)可以直接截获受激电子转变为Cyt c(Ⅱ),导致QDs磷光猝灭[23,24]。过程如下:

(1)
(2)
为验证Cyt c中的Fe(Ⅲ)是QDs磷光猝灭的原因,本研究将不同浓度的Fe2(SO4)3溶液分别加入到QDs溶液中,静置5 min后测定QDs的磷光,表明在一定范围内Fe(Ⅲ)与室温磷光猝灭量ΔRTP呈良好的线性关系,由此推测QDs-SMIPs磷光猝灭的主要原因是Fe(Ⅲ)。为进一步验证QDs的磷光猝灭是由Fe(Ⅱ) 引起,本研究将Cyt c与QDs-SMIPs反应体系进行80 ℃加热处理,加热处理后的Cyt c对QDs-SMIPs的猝灭强度明显降低。这是由于经过加热处理的Cyt c在反应过程中生成的Fe(Ⅱ)有一部分会变回Fe(Ⅲ)[25],而未加热处理的Cyt c在反应过程中生成的Fe(Ⅱ)不变,这进一步证明QDs-SMIPs磷光的猝灭由Cyt c中的Fe(Ⅲ)引起。
综上得出,Cyt c(Ⅲ)结合于QDs-SMIPs表面后可截获受激电子并转变为Cyt c(Ⅱ),进而阻止了受激电子和QDs内空穴的复合,导致QDs-SMIPs磷光猝灭,因此,Cyt c对QDs-SMIPs的磷光猝灭过程为光诱导的电子转移。
2.5 样品分析
为验证QDs-SMIPs能否用于实际生物样品中Cyt c含量的测定,进行了人血清和尿液样品的加标回收实验(尿液和血清样品均来自健康志愿者),样品加标回收率在96%~104%之间,结果如3所示。
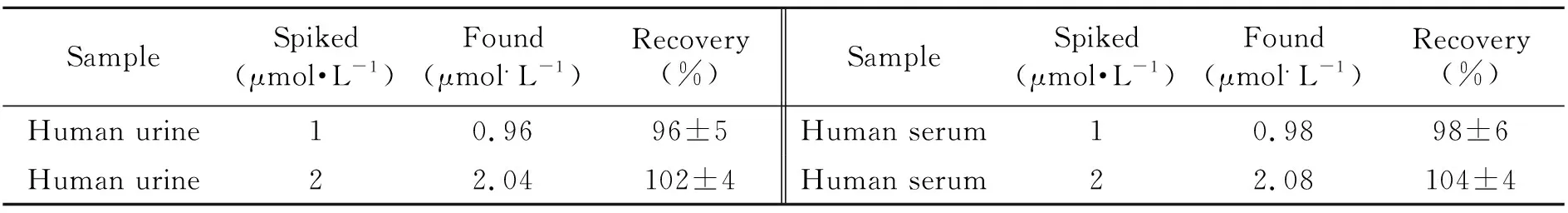
表3 血清和尿液中Cyt c的加标回收试验
3 结论
本研究以SMIPs为人工抗体,Mn-ZnS磷光QDs为信号载体,制备了一种可对Cyt c识别分析的磷光型QDs-SMIPs人工抗体。在最佳实验条件下,该QDs-SMIPs不仅能够实现对Cyt c的选择性识别分析,而且其具有的磷光特性能够避免生物样品背景荧光的干扰,因此该方法更适用于生物样品中痕量Cyt c的检测,并为其他种类蛋白质分子的分析检测提供方法借鉴。
