TBBPA-DHEE暴露对斑马鱼的神经毒性及机制研究
2021-05-14徐彤冯伟伟丁阳阳钱显陈瑶茆广华仰榴青吴向阳
徐彤, 冯伟伟, 丁阳阳, 钱显, 陈瑶, 茆广华, 仰榴青, 吴向阳
(江苏大学1. 环境与安全工程学院; 2. 化工学院, 江苏 镇江 212013)
四溴双酚A(Tetrabromobisphenol A, TBBPA)是目前使用最为广泛的一种溴代阻燃剂,各种环境介质如土壤、水体、大气及生物体中均可检测到。已有研究表明,TBBPA可通过干扰神经相关激素、神经递质分泌和神经相关信号通路产生神经毒性[1]。TBBPA的部分结构与甲状腺激素相似,进入生物体血液后可扰乱甲状腺激素分泌,导致内分泌紊乱并进一步造成神经元损伤[2]。四溴双酚A双(2-羟基乙基)醚[TBBPA bis(2-hydroxyetyl) ether,TBBPA-DHEE]是TBBPA典型的衍生物之一,广泛用于生产工程聚合物、涂料、热塑性聚酯及聚苯乙烯泡沫等材料,已在水体、土壤等环境介质中检出[3-4]。其结构与TBBPA母体高度类似,是否具有类似的毒理学效应尚不清楚。研究发现,TBBPA-DHEE对大鼠嗜铬瘤细胞、新生大鼠均具有神经毒性[5-6],而对水生动物的影响尚不清楚。因此,本文以斑马鱼胚胎为研究对象,通过对胚胎发育相关指标、行为学指标、酶学指标及Ca2+信号通路相关mRNA表达的分析,系统研究TBBPA-DHEE暴露对斑马鱼胚胎的神经毒性,并探明潜在的作用机制。
1 材料与方法
1.1 试剂与仪器
主要试剂:TBBPA-DHEE标准品(纯度98%)购于美国Sigma-Aldrich公司,其余试剂购于国药集团,均为分析纯;RNA提取试剂盒(日本TaKaRa公司);逆转录试剂盒(美国Bio-Rad公司);引物序列由上海生工生物工程股份有限公司设计。
主要仪器:体式荧光显微镜(日本Olympus公司);超低温冰箱(日本Panasonic公司);组织匀浆器(德国IKA公司);电子天平(德国Sartorius公司);超微量核酸蛋白测定仪(美国Thermo公司);实时荧光定量PCR(瑞士Roche公司);斑马鱼行为分析系统(荷兰Noldus公司)。
1.2 TBBPA-DHEE溶液的配置
TBBPA-DHEE用二甲基亚砜助溶,配制成27 mmol/L的贮备液避光保存,实验前用胚胎培养液将贮备液稀释。根据环境相关浓度,最终暴露浓度设置低、中、高剂量组分别为0.086 mg/L、0.860 mg/L和8.600 mg/L,各剂量组二甲基亚砜含量均为0.05%(V/V),并设置空白对照组和二甲基亚砜组。
1.3 受试动物
亲鱼选用AB系斑马鱼(Daniorerio),购于南京一树梨花生物科技有限公司。用海盐调节去离子水电导率至500~530 μS/cm饲养斑马鱼。鱼房温度(28.0±0.5)℃,光照周期14 h ∶10 h,每日喂食2次丰年虾。实验前一天,将雌雄亲鱼按1 ∶1比例放入鱼卵收集缸中;次日早取出隔板,雌雄斑马鱼自行交配,30 min后收集产下的受精卵,挑选出发育正常的胚胎用于后续胚胎暴露实验。
1.4 斑马鱼胚胎发育毒性
将已暴露的胚胎置于培养箱中,设置培养箱的培养条件与鱼房一致,暴露至120 hpf(hourpost fenilized,受精后数小时),每天更换一半暴露液。自暴露开始后每24 h在体式显微镜下观察胚胎和(或)脱膜后幼鱼的死亡、孵化情况,观察至96 hpf。分别于24、48、72和96 hpf观察胚胎/仔鱼的畸形情况。48、72 hpf时置于显微镜下观察胚胎/仔鱼1 min内的心跳次数。96 hpf时在显微镜下测量仔鱼从头部最前端到尾尖的长度(不包括尾鳍)。
1.5 斑马鱼仔鱼行为学实验
1.5.1 自主运动分析 28~29 hpf时,在体式显微镜下观测胚胎1 min内的自主运动次数。
1.5.2 仔鱼运动行为分析 斑马鱼仔鱼的运动行为量化用斑马鱼行为分析系统进行测定。将120 hpf的斑马鱼仔鱼置于96孔板中,每孔一条鱼测定其游动活性。先将斑马鱼放进行为室中适应10 min后,观察仔鱼对环境由黑暗到光明再到黑暗转变(10 min暗—10 min光—10 min暗—10 min光—10 min暗)的响应情况,每30 s记录一次数据(包括移动频率、行进距离和累计持续移动时间)。
1.6 氧化应激相关酶测定
将斑马鱼胚胎暴露120 hpf后,加入PBS制成10%的组织匀浆,于4 ℃、2 000 r/min离心5 min,将上清液转移至冰浴预冷的离心管中。按照试剂盒说明书检测超氧化物歧化酶(SOD)活力、丙二醛含量及谷胱甘肽过氧化物酶(GPx)活力。
1.7 组织内Ca2+及γ-氨基丁酸含量测定
TBBPA-DHEE暴露120 hpf后,将仔鱼清洗干净,加入PBS制成10%的组织匀浆,2 500 r/min离心10 min,取上清液,根据试剂盒说明书测定其Ca2+含量和斑马鱼γ-氨基丁酸含量。
1.8 qRT-PCR法测定Ca2+信号通路中相关mRNA表达
仔鱼暴露120 hpf后,每组随机选取30条仔鱼,根据RNA提取试剂盒说明书提取总RNA,用超微量核酸蛋白测定仪测定总RNA浓度。取1 μg RNA采用反转录试剂盒将RNA反转录合成cDNA。根据实时荧光定量PCR试剂盒说明书加入样品和试剂进行PCR扩增,实验反应体系为20 μL,包括1 μL DNA模板及0.2 μL上、下游混合引物;反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸20 s,共55个循环;熔融曲线反应条件:95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。PCR引物设计由上海生工生物工程股份有限公司设计,选取β-actin作为内参基因,Cacna1ab、Atp2a1、Atp2a1l、Camk1ga、Calml4a、Ppp3ca、Plcd3a和Prkca的引物设计如表1所示。目的基因表达水平用2-ΔΔCt法进行计算处理。

表1 Ca2+通路相关基因引物
1.9 数据分析

2 结果
2.1 斑马鱼胚胎/仔鱼形态的变化
如图1A所示,与空白对照组相比,TBBPA-DHEE各剂量组斑马鱼胚胎死亡率呈上升趋势,且8.600 mg/L暴露剂量组显著上升(P<0.05)。由此可见,TBBPA-DHEE暴露可致斑马鱼死亡率升高。
如图1B所示,与空白对照组相比,72 hpf时TBBPA-DHEE各暴露剂量组胚胎孵化率呈下降趋势,且0.860 mg/L暴露剂量组孵化率显著下降(P<0.05);96 hpf时,0.860 mg/L剂量组孵化率较空白对照组显著降低(P>0.05)。由此可见,TBBPA-DHEE暴露可导致胚胎孵化延迟。
如图1C所示,斑马鱼胚胎畸形率随TBBPA-DHEE浓度增加而上升,各暴露剂量组仔鱼出现心包水肿、身体弯曲、游囊关闭等畸形形态,且与空白对照组相比,8.600 mg/L暴露剂量组畸形率显著上升(P<0.05)。由此可见,TBBPA-DHEE暴露剂量增加可增加仔鱼畸形率,影响其正常发育。
如图1D所示,72 hpf时,随着暴露剂量升高,心率变化呈倒“U”型变化趋势,即低剂量增强心率而高剂量抑制心率,与空白对照组相比,8.600 mg/L暴露剂量组仔鱼心率显著降低10.7%(P<0.01)。由此可见,TBBPA-DHEE暴露可致斑马鱼心脏发育受损,血液循环减缓,营养物质运输受阻,进一步影响斑马鱼胚胎的发育。
如图1E所示,96 hpf时,各暴露剂量组斑马鱼仔鱼平均体长呈剂量-效应关系,8.600 mg/L暴露剂量组中的斑马鱼仔鱼平均体长显著低于空白对照组(P<0.05)。由此可见,TBBPA-DHEE暴露可显著抑制仔鱼正常生长发育。

A:96 hpf时斑马鱼胚胎/仔鱼的死亡率;B:72和96 hpf时斑马鱼胚胎的孵化率;C:96 hpf时斑马鱼胚胎/仔鱼畸形率及畸形形态;D:48和72 hpf时斑马鱼胚胎/仔鱼的心率;E:96 hpf时斑马鱼仔鱼的平均体长。a: P < 0.05, b: P<0.01,与空白对照组比较图1 各组斑马鱼胚胎/仔鱼的形态学变化
2.2 斑马鱼胚胎/仔鱼行为的变化
2.2.1 胚胎早期自主运动分析 TBBPA-DHEE暴露对斑马鱼胚胎早期自主运动次数的影响如图2所示。暴露于0.086、0.860和8.600 mg/L剂量TBBPA-DHEE中的胚胎,其运动次数较空白对照组分别下降44.92%,66.95%和83.90%(P<0.01)。自主运动是影响胚胎孵化的因素之一,其与胚胎孵化结果一致。由此表明,TBBPA-DHEE暴露可显著抑制胚胎早期运动。

*:P < 0.01,与空白对照组比较图2 各组斑马鱼胚胎的早期自主运动次数
2.2.2 仔鱼的运动行为分析 图3A所示,空白对照组斑马鱼仔鱼在明暗刺激下,运动活力呈周期性变化,即开灯时(黑暗转为明亮)仔鱼的运动活力迅速下降,而关灯时(明亮转为黑暗)仔鱼的运动活力迅速上升,在黑暗条件下仔鱼的平均运动距离高于光照条件下的平均运动距离。
图3B所示,黑暗条件下,0.860和8.600 mg/L暴露剂量组的运动活力较空白对照组显著降低(P<0.01),光照条件下各暴露剂量组与空白对照组相比,差异无统计学意义(P>0.05)。图3C所示,与空白对照组相比,黑暗期下0.860和8.600 mg/L暴露剂量组仔鱼累计持续移动时间显著降低(P<0.01),光照期下各暴露剂量组比较,差异无统计学意义(P>0.05)。

A:暗—明—暗—明—暗光照周期刺激下斑马鱼平均游泳距离;B:明暗刺激下相应的平均游泳距离;C:光暗周期下斑马鱼仔鱼累计持续移动时间。*:P<0.01,与空白对照组比较图3 120 hpf时各组斑马鱼的运动行为变化
2.3 斑马鱼体内氧化应激相关酶的变化
如图4A所示,与空白对照组相比,各暴露剂量组仔鱼体内SOD活力均呈上升趋势;0.086和8.600 mg/L暴露剂量组SOD活力分别提高28.48%和20.66%(P<0.01);0.860 mg/L暴露剂量组SOD活力提高7.90%(P<0.05)。如图4B所示,与空白对照组相比,各暴露剂量组斑马鱼体内丙二醛含量呈浓度-效应关系,0.860 mg/L和8.600 mg/L暴露剂量组丙二醛含量分别提高62.68%(P<0.05)和99.56%(P<0.01)。如图4C所示,120 hpf时各浓度TBBPA-DHEE暴露剂量组GPx活力与空白对照组相比呈上升趋势,0.860和8.600 mg/L暴露剂量组分别上升111.73%和173.94%(P<0.01)。由此表明,TBBPA-DHEE暴露可造成斑马鱼仔鱼机体氧化应激损伤,影响斑马鱼仔鱼的神经系统。

A:斑马鱼仔鱼体内SOD活力;B:斑马鱼仔鱼体内丙二醛含量;C:斑马鱼仔鱼体内GPx活力。a:P<0.05,b:P<0.01,与空白对照组比较图4 各组斑马鱼体内氧化应激相关酶的活性及含量
2.4 斑马鱼体内Ca2+及γ-氨基丁酸含量的变化
图5A和5B所示,随着TBBPA-DHEE暴露剂量的增加,斑马鱼仔鱼Ca2+含量呈上升趋势,γ-氨基丁酸含量呈下降趋势。与空白对照组相比,0.860和8.600 mg/L暴露剂量TBBPA-DHEE可显著增加Ca2+含量,分别升高34.85%和55.79%(P<0.05或<0.01);各暴露剂量组斑马鱼仔鱼γ-氨基丁酸含量显著降低(P<0.05或<0.01)。由此可见,TBBPA-DHEE可显著增加斑马鱼体内Ca2+含量,降低γ-氨基丁酸含量,产生神经毒性。
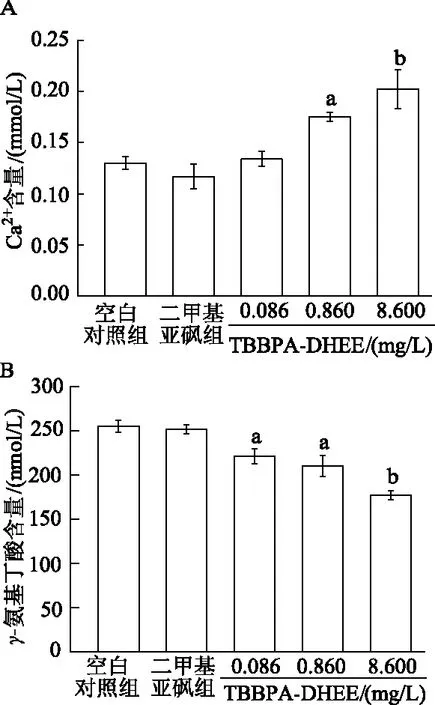
A:斑马鱼仔鱼体内Ca2+含量;B:斑马鱼仔鱼体内γ-氨基丁酸含量。a:P<0.05,b:P<0.01,与空白对照组比较图5 各组斑马鱼体内Ca2+及γ-氨基丁酸的含量
2.5 Ca2+信号通路中相关mRNA表达量的变化
如图6所示,与空白对照组相比,0.860 mg/L和8.600 mg/L暴露剂量TBBPA-DHEE均显著上调仔鱼Cacna1ab、Atp2a1、Atp2a1l、Camk1ga、Ppp3ca、Plcd3a和Prkca等mRNA表达(P<0.05或<0.01);0.086 mg/L暴露剂量TBBPA-DHEE显著下调Atp2a1和Plcd3a表达(P<0.05或<0.01)。可见,TBBPA-DHEE可显著影响Ca2+信号通路相关mRNA表达。
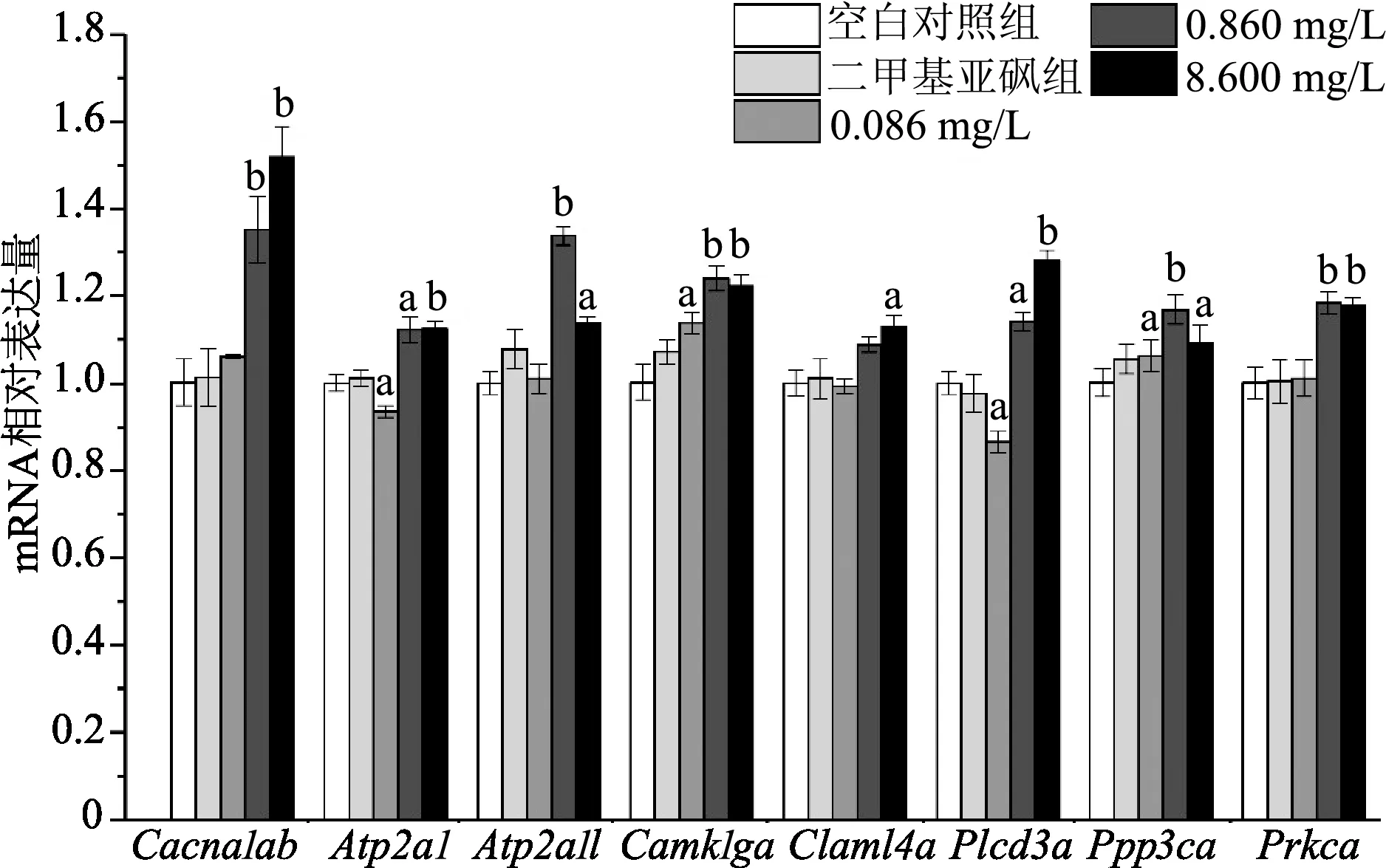
a:P<0.05,b:P<0.01,与空白对照组比较图6 各组斑马鱼仔鱼体内Ca2+通路中相关mRNA表达量比较
3 讨论
斑马鱼胚胎的自发运动能够反映斑马鱼的神经元活力。17~29 hpf时胚胎出现早期自主运动,其表现为尾巴交替摆动。28~29 hpf时,随着中枢系统的发育,胚胎早期自主运动受到自发控制,此阶段运动频率趋于稳定[7]。本研究结果表明,TBBPA-DHEE暴露可显著抑制胚胎的自发运动。在生命早期阶段,斑马鱼仔鱼的运动行为常作为神经系统发育的评价指标,行为受外在环境干扰,对环境污染物比较敏感。本研究结果表明,TBBPA-DHEE暴露显著抑制黑暗条件下斑马鱼的运动活力及累计持续移动时间,且降低仔鱼对光暗刺激的敏感性。先前的研究中,200和400 μg/L TBBPA暴露可显著降低斑马鱼仔鱼在光照期和黑暗期运动活力[1],本实验结果与其一致,表明TBBPA-DHEE与TBBPA具有相似的神经毒性,均对斑马鱼仔鱼神经系统造成影响。
氧化应激可破坏机体内活性氧与抗氧化系统间的平衡,影响神经突触的可塑性[8],是引起兴奋性毒性的重要因素。氧化与抗氧化系统间的失衡将影响斑马鱼胚胎的发育。SOD和GPx作为抗氧化酶,在保护细胞免受氧化应激中起重要作用。脂质过氧化是氧化损伤的主要表现之一,丙二醛是衡量机体脂质过氧化的标志性检测之一,其含量间接反映膜损伤程度。本研究结果表明,TBPPA-DHEE暴露显著增加斑马鱼体内SOD、GPx活力,这可能是一种机体应激反应;丙二醛含量显著上升,表明TBBPA-DHEE暴露对机体造成氧化损伤。Linhartova等[9]发现,斑马鱼暴露于TBBPA中,体内SOD活力呈上升趋势;左优[10]将斑马鱼暴露在TBBPA中,其体内GPx活力显著升高;Zhang等[11]研究发现,TBBPA暴露会导致斑马鱼体内丙二醛含量显著增加;本研究结果均与上述研究类似,表明TBBPA-DHEE与TBBPA具有相似的氧化应激反应,影响斑马鱼仔鱼神经系统。
Ca2+作为第二信使,在细胞信号传递过程中起重要作用,参与去极化信号的传输和突触传递、调节细胞凋亡、学习记忆等生物过程[12]。TBBPA-DHEE暴露可诱导斑马鱼仔鱼体内Ca2+含量增加,Ca2+失衡会诱导氧化应激、线粒体去极化和细胞毒性,同时引起神经毒性[13]。过量的Ca2+内流和快速升高可诱导神经元不可逆损伤,本研究结果表明TBBPA-DHEE可破坏机体内的钙稳态。γ-氨基丁酸是中枢神经系统中主要的抑制性神经递质[14]。本研究发现,随着TBBPA-DHEE剂量增加,仔鱼体内γ-氨基丁酸含量呈下降趋势。由此表明,TBBPA-DHEE对机体内神经递质的摄取产生影响,从而产生神经毒性。
CaV2.1b(Cacna1ab)由感觉神经元表达,在细胞活动依赖性神经递质释放过程中,可将Ca2+信号传导到突触前末梢[15]。Atp2a1和Atp2a1l调控的肌浆/内质网Ca2+-ATP酶在Ca2+跨膜运输中起重要作用,有助于将Ca2+重新隔离至肌浆网中,促使肌肉放松[16]。本研究结果表明,与空白对照组相比,高剂量TBBPA-DHEE暴露显著上调Cacna1ab、Atp2a1和Atp2a1lmRNA表达。Camk1ga调控的钙调素主要存在于脊椎动物中枢神经系统中,富集于突触后膜、突触后致密区及突出囊泡,CAMK属于钙调素激酶家族。当Ca2+浓度上升时,先与钙调素结合,而后激活CAMK[17]。Ppp3ca调控的钙调神经磷酸酶是一种Ca2+钙调蛋白调节蛋白磷酸酶,在Ca2+信号传导与细胞反应的耦合中起关键作用[18],是一种负性调控学习记忆蛋白,上调时可导致学习记忆受损。Ppp3ca可能与癫痫神经发育障碍有关。Plcd3a调控的PLC是磷酸肌醇途径中的关键酶,通过生成二酰基甘油和肌醇1,4,5-三磷酸,介导激活蛋白激酶C,且调节释放细胞内的Ca2+;研究发现其与神经退行性疾病和阿尔茨海默病有关[19]。本研究结果表明,TBBPA-DHEE暴露诱导Camk1ga、Ppp3ca、Plcd3a和PrkcamRNA表达上升。由此可见,TBBPA-DHEE暴露可激活斑马鱼仔鱼钙信号通路从而产生神经毒性。
综上所述,TBBPA-DHEE暴露可致胚胎/仔鱼死亡率和畸形率升高,延缓胚胎孵化,对斑马鱼运动行为产生显著影响,同时引起斑马鱼仔鱼体内SOD、GPx活力及丙二醛含量显著上升,造成氧化损伤,产生神经毒性,可能与TBBPA-DHEE暴露诱导仔鱼体内 Ca2+含量上升,破坏钙稳态,抑制摄取γ-氨基丁酸,并影响斑马鱼仔鱼Ca2+信号通路相关mRNA的表达相关。
