3种主要短链脂肪酸减轻5-氟尿嘧啶诱发的THP-1细胞炎症反应
2021-05-14席月陈述丁龙坤夏雯戴晓玥闫曼张敏吴亮马洁阴晴许化溪
席月, 陈述, 丁龙坤, 夏雯, 戴晓玥, 闫曼,张敏, 吴亮, 马洁, 阴晴, 许化溪
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学附属医院检验科, 江苏 镇江 212001)
短链脂肪酸(short-chain fatty acids, SCFAs)是肠道内厌氧菌发酵膳食纤维的主要代谢产物,主要有乙酸钠、丙酸钠和丁酸钠,占总量90%以上,通常以离子状态存在[1-2]。SCFAs可促进肠黏膜上皮细胞增殖,减轻肠黏膜萎缩,维护肠黏膜的正常形态。临床研究结果表明,通过增加膳食纤维或SCFAs摄入量,可以改善结直肠炎患者治疗效果,但其确切机制仍不明晰[3]。
5-氟尿嘧啶(5-Fluorouracil,5-FU)是目前常用的一类抗癌药物,通过干扰DNA合成阻断肿瘤细胞分裂增殖,广泛用于乳腺癌、胃肠道肿瘤和头颈部肿瘤等治疗[4-5]。但是,在治疗过程中有40%~80%患者会出现严重肠黏膜炎等不良反应,甚至造成化疗无法继续[6]。5-FU可以诱发健康小鼠肠道强烈炎症反应,并致其肠黏膜中巨噬细胞NOD样受体家族3(NLRP3)炎症小体活性显著升高,而以5-FU刺激NLRP3基因缺陷小鼠则仅出现轻微的肠黏膜炎症反应[7]。因此,通过下调细胞NLRP3炎症小体的活化,抑制肠黏膜中炎症反应可以减轻5-FU诱发的肠黏膜炎,改善小鼠对5-FU的耐受程度。目前,关于SCFAs对5-FU所诱发的巨噬细胞炎症反应的影响尚不清楚。因此,本研究探讨乙酸钠、丙酸钠和丁酸钠对5-FU所诱发巨噬细胞炎症反应的影响及其可能机制。
1 材料与方法
1.1 细胞、试剂与仪器
人单核巨噬THP-1细胞购自上海细胞库,由本实验室自行保种和培养;5-FU注射液(天津金耀氨基酸有限公司);乙酸钠、丙酸钠和丁酸钠均为国产分析纯;RPMI 1640细胞培养液和胎牛血清(以色列BI公司);荧光定量PCR仪、免疫印迹系统及凝胶成像系统(美国Bio-Rad公司);2×TaqPCR预混液、逆转录试剂盒、实时定量PCR试剂盒(SYBR Green染料法)、总RNA提取试剂盒均为南京诺唯赞公司产品;引物由苏州金唯智生物科技公司合成;RIPA裂解液、蛋白酶抑制剂PMSF、细胞核蛋白和细胞质蛋白抽提试剂盒、活性氧检测试剂盒为碧云天生物技术公司产品;ELISA试剂盒以及兔抗TLR9、NLRP3、Caspase-1、Beclin-1、LC3-Ⅱ、组蛋白H1、NF-κB p65、鼠抗β-肌动蛋白抗体和HRP标记的山羊抗兔或鼠抗体(美国ABclonal生物科技公司);ECL显色液(美国Thermo公司)。
1.2 细胞培养
THP-1细胞按常规方法培养于含10%胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2稳定传代至第6代后用于本研究。取对数生长期细胞接种于6孔板(1×106个/孔),37 ℃、5% CO2培养过夜。
1.3 细胞分组及处理
将THP-1细胞分为5组,分别为对照组、5-FU+乙酸钠组、5-FU+丙酸钠组、5-FU+丁酸钠组和5-FU组。5-FU+乙酸钠组、5-FU+丙酸钠组和5-FU+丁酸钠组细胞预先分别以100 μmol/L乙酸钠、丙酸钠和丁酸钠处理24 h,再与5-FU组一并加入2.5 mmol/L 5-FU刺激细胞24 h,诱发炎症反应;对照组细胞未经任何处理。收集细胞用于后续研究。
1.4 qRT-PCR检测THP-1细胞炎性相关因子mRNA表达
用Trizol试剂抽提THP-1细胞总RNA,以oligo(dT)为引物经逆转录合成cDNA链,行qRT-PCR。qRT-PCR反应总体系共20 μL,包括SYBR Green Master预混液10 μL,上、下游引物各0.4 μL (10 μmol/L),cDNA模板2 μL。反应程序:95 ℃预变性5 min,95 ℃变性3 s,58 ℃退火20 s,72 ℃延伸30 s,反应共计40个循环。以GAPDH作为内参,通过公式2-△△Ct计算mRNA相对表达量。所用引物序列见表1。

表1 引物序列
1.5 ELISA法测定细胞因子水平
收集各组细胞培养上清液各2 mL,4 ℃、1 000 r/min离心20 min;取上清液,按ELISA试剂盒检测上清液中IL-1β、IL-6和IL-10含量。用酶标仪检测450 nm处光密度值,绘制相应细胞因子检测的标准曲线,并计算各组细胞上清液中细胞因子含量。
1.6 蛋白质印迹法检测通路相关蛋白和自噬蛋白表达
1.6.1 TLR9、NLRP3、Caspase-1、LC3-Ⅱ和Beclin-1蛋白表达检测 每孔细胞中加入120 μL RIPA裂解液(含1.2 μL PMSF)于冰上裂解30 min;4 ℃、12 000 r/min离心10 min;收集上清液。100 V恒压电泳120 min;300 mA恒流90 min转印至PVDF膜;用5%脱脂奶粉于室温封闭1 h;加入兔抗TLR9、NLRP3、Caspase-1、LC3-Ⅱ、Beclin-1和鼠抗β-肌动蛋白抗体,1 ∶1 000稀释,于4 ℃孵育过夜;次日以TBST缓冲液洗涤3次,每次15 min;加入羊抗兔(鼠)IgG-HRP (1 ∶2 000)室温孵育1 h;TBST洗涤3次;采用ECL显色液曝光显色,通过灰度扫描分析分析各目的蛋白表达量。
1.6.2 胞质和胞核NF-κB p65蛋白表达检测 按照试剂盒使用说明书操作,每孔加入150 μL细胞质蛋白抽提试剂A(含1.5 μL PMSF)剧烈振荡5 s后冰浴15 min;加入细胞质蛋白抽提试剂B 10 μL剧烈振荡5 s后冰浴1 min;4 ℃、12 000 r/min离心5 min;收集上清液即获得细胞质蛋白;吸尽残余上清液,在沉淀中加入50 μL细胞核蛋白抽提试剂(含0.5 μL PMSF),冰上裂解30 min;4 ℃、12 000 r/min离心10 min,收集上清液即获得细胞核蛋白。蛋白质印迹检测同“1.6.1”。
1.7 流式细胞术检测活性氧水平
采用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针法检测THP-1细胞中活性氧水平。无血清培养基按照1 ∶1 000稀释DCFH-DA至终浓度为10 μmol/L。细胞重悬于稀释后的DCFH-DA探针溶液中,于37 ℃细胞培养箱内避光孵育20 min,每隔5 min颠倒混匀,使探针和细胞充分接触。无血清细胞培养基洗涤3次,以去除未进入细胞内的DCFH-DA探针,再以无菌PBS重悬细胞后进行检测。
1.8 统计学分析
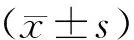
2 结果
2.1 3种SCFAs对5-FU诱导THP-1细胞炎症相关因子表达的影响
与对照组比较,5-FU组IL-1β和IL-6表达量均显著升高(P<0.01);与5-FU组比较,5-FU+丙酸钠组和5-FU+丁酸钠组IL-1β表达量均显著降低(P<0.01);5-FU+乙酸钠组、5-FU+丙酸钠组和5-FU+丁酸钠组IL-6表达量均显著降低(P<0.01),其中5-FU+乙酸钠组IL-6表达量下降较其他两组更显著(P<0.01);5-FU+乙酸钠组、5-FU+丙酸钠组和5-FU+丁酸钠组IL-10及其mRNA表达量均显著升高(P<0.01)。见图1。
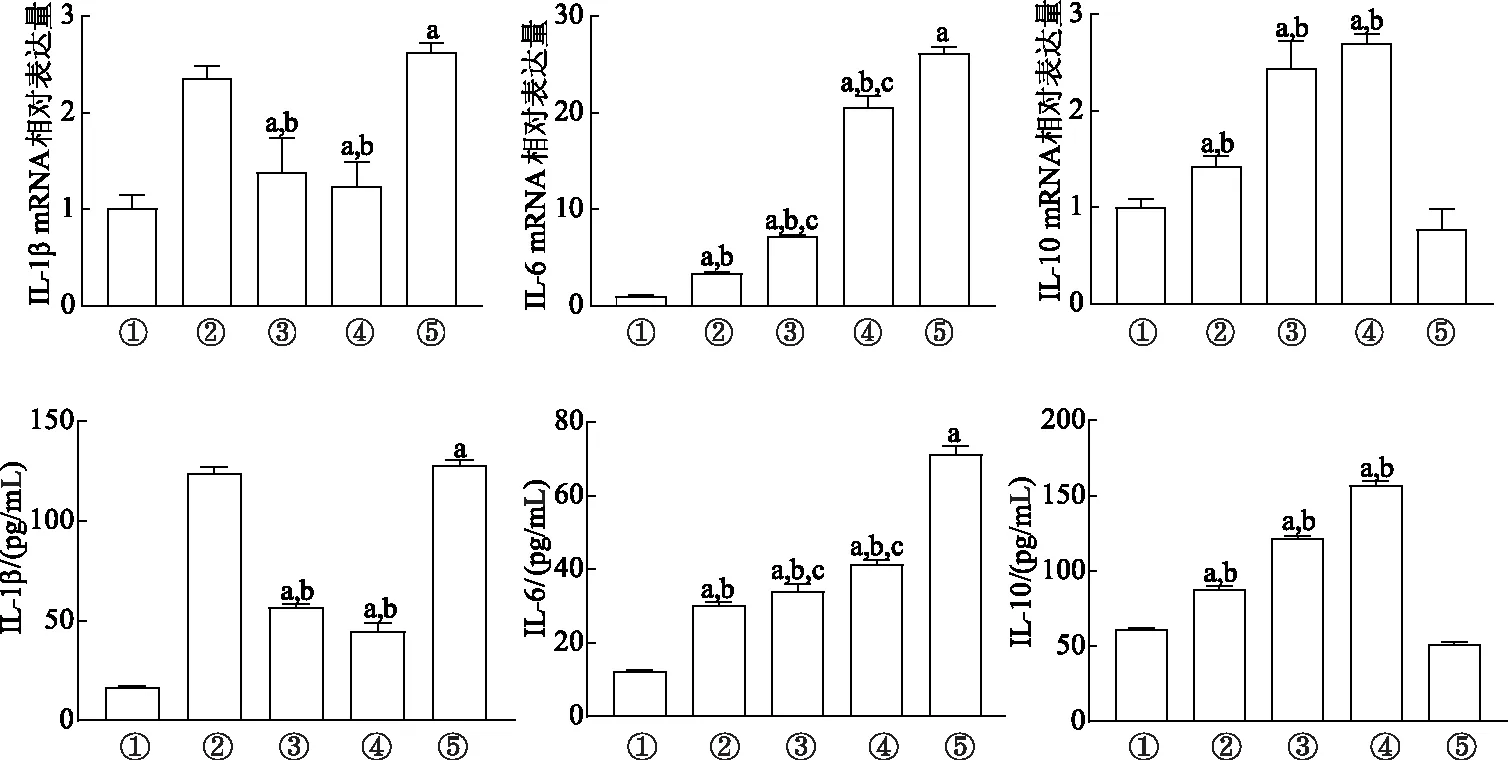
①:对照组;②:5-FU+乙酸钠组;③:5-FU+丙酸钠组;④:5-FU+丁酸钠组;⑤:5-FU组;a:P<0.01,与对照组比较;b:P<0.01,与5-FU组比较;c:P<0.05,与5-FU+乙酸钠组比较图1 qRT-PCR和ELISA法检测细胞因子mRNA表达及含量
2.2 3种SCFAs对THP-1细胞TLR9、NLRP3、Caspase-1 mRNA和蛋白表达的影响
与对照组比较,5-FU组TLR9、NLRP3、Caspase-1 mRNA和蛋白表达均显著升高(P<0.01)。与5-FU组比较,5-FU+乙酸钠组和5-FU+丙酸钠组细胞TLR9 mRNA和蛋白表达显著降低(P<0.01);5-FU+乙酸钠组、5-FU+丙酸钠组和5-FU+丁酸钠组细胞NLRP3和Caspase-1mRNA和蛋白表达显著降低(P<0.01)。见图2。
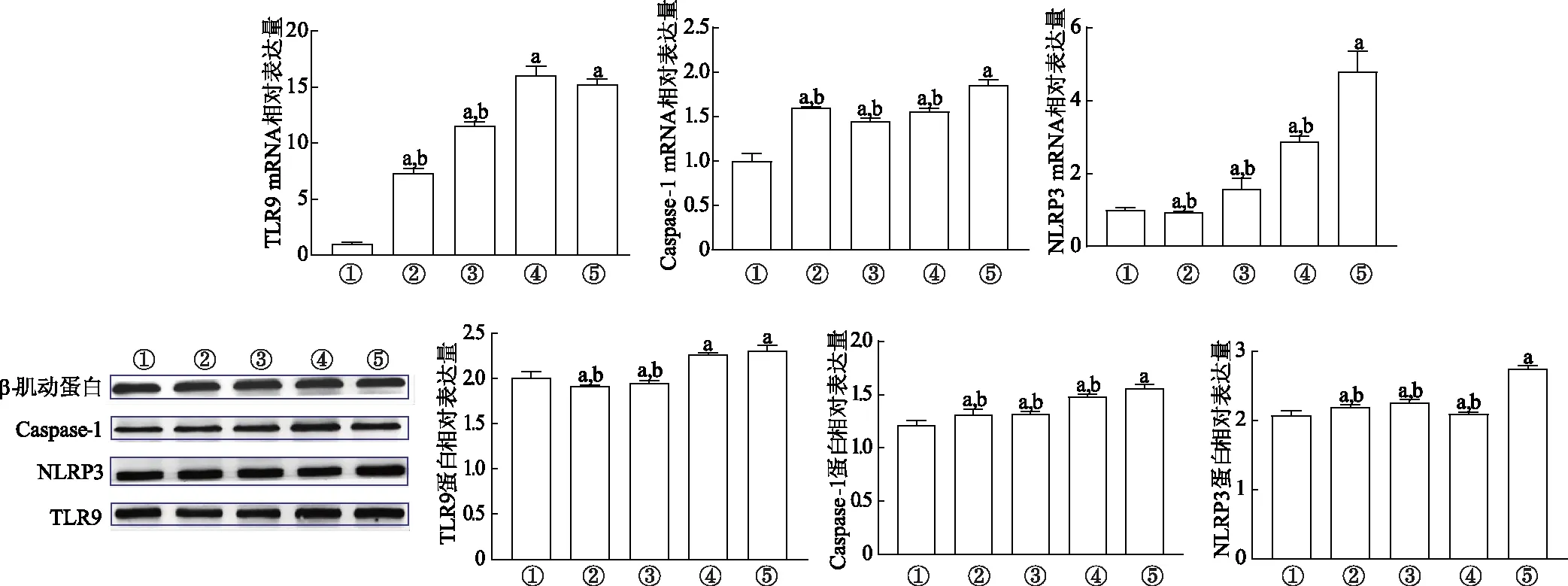
①:对照组;②:5-FU+乙酸钠组;③:5-FU+丙酸钠组;④:5-FU+丁酸钠组;⑤:5-FU组;a:P<0.01,与对照组比较;b:P<0.01,与5-FU组比较图2 qRT-PCR和蛋白质印迹法分别检测TLR9、NLRP3、Caspase-1 mRNA和蛋白表达
2.3 3种SCFAs对THP-1细胞自噬相关蛋白表达的影响
如图3所示,与对照组比较,5-FU组细胞LC3-Ⅱ和Beclin-1蛋白表达水平明显升高(P<0.01);与5-FU组比较,5-FU+乙酸钠组相比、5-FU+丙酸钠组和5-FU+丁酸钠组细胞LC3-Ⅱ和Beclin-1表达显著降低,差异有统计学意义(P<0.01或P<0.05);与5-FU+丙酸钠组和5-FU+丁酸钠组比较,5-FU+乙酸钠组细胞Beclin-1表达量明显降低(P<0.05);与5-FU+乙酸钠组和5-FU+丁酸钠组比较,5-FU+丙酸钠组组细胞LC3-Ⅱ表达量明显降低(P<0.05)。

①:对照组;②:5-FU+乙酸钠组;③:5-FU+丙酸钠组;④:5-FU+丁酸钠组;⑤:5-FU组;a:P<0.05,与对照组比较;b:P<0.01,与5-FU组比较;c:P<0.05,与5-FU+乙酸钠组比较;d:P<0.05,与5-FU+丙酸钠组比较图3 蛋白质印迹法检测THP-1细胞LC3-Ⅱ和Beclin-1蛋白表达
2.4 3种SCFAs对THP-1细胞NF-κB信号通路活化能力的影响
蛋白质印迹法检测结果显示(图4),与对照组比较,5-FU组胞核内NF-κB p65蛋白表达水平明显升高(P<0.01),胞质中NF-κB p65蛋白表达水平则明显降低(P<0.01)。与5-FU组比较,5-FU+乙酸钠组和5-FU+丁酸钠组细胞核内NF-κB p65蛋白表达水平明显降低(P<0.01);5-FU+丁酸钠组细胞胞质中NF-κB p65蛋白表达水平则明显升高(P<0.01)。与5-FU+乙酸钠组比较,5-FU+丁酸钠细胞核内NF-κB p65蛋白表达明显降低(P<0.01)。

①:对照组;②:5-FU+乙酸钠组;③:5-FU+丙酸钠组;④:5-FU+丁酸钠组;⑤:5-FU组;a:P<0.01,与对照组比较;b:P<0.01,与5-FU组比较;c:P<0.01,与5-FU+乙酸钠组比较图4 蛋白质印迹法检测THP-1细胞胞质和胞核中NF-κB p65蛋白水平
2.5 3种SCFAs对THP-1细胞活性氧生成能力的影响
流式细胞术检测结果显示(图5),与对照组相比,其余4组活性氧生成水平均显著升高(P<0.01)。
与5-FU组比较,5-FU+丙酸钠组和5-FU+丁酸钠组THP-1细胞活性氧水平显著降低(P<0.01)。

①:对照组;②:5-FU+乙酸钠组;③:5-FU+丙酸钠组;④:5-FU+丁酸钠组;⑤:5-FU组;a:P<0.01,与对照组比较;b:P<0.01,与5-FU组比较图5 流式细胞术检测THP-1细胞活性氧水平
3 讨论
5-FU在干扰肿瘤细胞DNA合成的同时也对正常组织细胞的DNA合成造成干扰,导致细胞死亡并释放出大量双链DNA(dsDNA)。在此过程中,细胞自身dsDNA作为一种重要的损伤相关分子模式(damage-associated molecular patterns, DAMPs),是诱发炎症反应和自身免疫损伤的关键因素[8]。死亡细胞释放出的自身dsDNA可以经免疫细胞(如巨噬细胞和树突状细胞等)表面TLR9受体识别,并将信号传递至细胞内激活相关DNA感受器,进而诱发炎症反应[9]。本研究发现5-FU可以上调THP-1细胞TLR9表达,并促进NF-κB p65蛋白入核,激活NLRP3炎症小体,最终导致各种促炎因子表达水平和细胞内活性氧水平升高。由此提示,5-FU可能通过TLR9/NF-κB/ROS信号通路激活THP-1细胞NLRP3炎症小体继而引发强烈炎症反应。
自噬是哺乳动物细胞的一种特殊死亡形式,对于维持机体的稳态有重要意义,在饥饿或其他应激如缺氧、活性氧、DNA损伤等刺激下被激活[10-11]。Beclin-1基因是第一个经确认的哺乳动物自噬调控基因,其编码产物Beclin-1是自噬发生的标志蛋白[12]。LC3-Ⅱ是目前发现的唯一定位于自噬体膜上的自噬相关蛋白,其含量与自噬泡数量成正比[13]。巨噬细胞是宿主固有免疫的重要组成部分,其大量自噬发生虽然可以降低各种炎性细胞因子的释放,但机体免疫防御能力也随着巨噬细胞数量的减少而降低。确保降低巨噬细胞炎症反应的同时仍维持一定水平的免疫力是目前肿瘤治疗面临的两难局面[14-15]。本研究发现,3种SCFAs均可不同程度地抑制THP-1细胞炎症反应,降低细胞炎症反应水平,同时降低THP-1细胞自噬水平以维持细胞数量。经过3种SCFAs孵育后,THP-1细胞Th1型细胞因子(IL-1β)表达显著降低,而Th2型细胞因子(IL-10)表达显著升高,提示SCFAs在抑制巨噬细胞过度炎症反应的同时,还有利于组织的修复,这对于肿瘤化疗患者极为有利。
在人体肠道中,SCFAs浓度可达70~140 mmol/L,并迅速经血液吸收,其中主要包括乙酸钠、丙酸钠和丁酸钠[16]。肠道中发酵产生的SCFAs不仅能为肠黏膜上皮细胞增殖提供能量,促进细胞代谢和生长,还可调节人体肠道菌群组成,减少有害菌的生长,防止肠道功能紊乱[17]。更重要的是,SCFAs能够抑制免疫细胞释放各种促炎因子,抑制肠道内过度的炎症反应,减轻结直肠炎患者肠道黏膜损伤[18-19]。已有研究结果表明,3种重要SCFAs(乙酸钠、丙酸钠和丁酸钠)均能减少免疫细胞促炎因子释放,抑制炎症反应,并且在较低浓度(1~1 200 mol/L)即可促进抗炎细胞因子IL-10大量生成;同时乙酸盐和丁酸盐还可以通过抑制NF-κB信号通路活化发挥抗炎作用[20]。本文研究结果与上述研究一致,丙酸钠和丁酸钠能显著下调THP-1细胞促炎因子IL-1β表达,3种SCFAs均显著降低细胞促炎因子IL-6表达,并显著上调抗炎因子IL-10表达,丙酸钠还可降低细胞活性氧生成,而乙酸钠和丁酸钠可以显著抑制NF-κB p65蛋白移位至细胞核内,从而抑制NLRP3炎症小体的激活进而降低炎症反应。
综上所述,3种SCFAs均可降低5-FU诱导的THP-1细胞自噬水平;丙酸盐和丁酸盐可以通过抑制NLRP3炎症小体激活下调IL-1β表达;乙酸盐和丙酸盐可以抑制细胞TLR9活化,而丁酸盐对细胞TLR9表达无明显影响,但可以显著显抑制NF-κB p65蛋白移位至细胞核内。3种SCFAs均可体外抑制巨噬细胞炎症反应,但具体机制并不完全一致,可能是因为SCFAs可以作为能量物质影响细胞自噬,也可作为组蛋白去乙酰化酶抑制剂影响NLRP3炎症体,具体原因还有待进一步探讨。
