长链非编码RNA LUCAT1对恶性黑色素瘤增殖的影响
2021-05-13吕大伦端木龙胜
丁 伟,朱 薇,吕大伦,李 敏,端木龙胜
(1.皖南医学院第一附属医院 弋矶山医院 烧伤整形科,安徽 芜湖 241001;2.皖南医学院 护理学院,安徽 芜湖 241002)
人恶性黑色素瘤,简称恶黑,是起源于皮肤黑色素细胞的恶性疾患,大约占皮肤所有恶性肿瘤的10%[1],恶性程度极高,我国晚期恶黑患者5年生存率仅为24%~29%[2]。本病病因及机制不完全清楚,与恶黑早期诊治相关的发病机制研究包括生物标志物等近年来多有涉及,到目前为止,文献报道多种长链非编码RNA (lncRNA,>200 bp)与恶黑发病或肿瘤增殖相关[3]。
肺癌相关转录本1(lung cancer associated transcript 1,LUCAT1)位于5号染色体,2013年首次在非小细胞肺癌细胞中发现[4],目前LUCAT1与恶黑之间的关系文献报道较少,本研究运用生物信息学方法验证LUCAT1在恶黑中的表达,通过qRT-PCR技术对比检测人恶黑细胞SK-MEL-1、A375和正常人表皮黑色素细胞HEMn-LP中LUCAT1的表达情况;并通过siRNA技术下调LUCAT1表达,运用细胞形态学及MTT实验探索LUCAT1对细胞生长能力的影响。
1 材料与方法
1.1 试剂和仪器 qRT-PCR试剂盒购自大连Takara公司。RNA抽取所用Trizol 试剂盒购自上海碧云天生物科技公司。转染所用脂质体2000试剂购自Invitrogen公司。MTT细胞增殖试剂盒购自上海科雅生物公司。高糖DMEM培养基、Opti-MEM无血清培养基、胎牛血清均购自Gibco公司。酶标仪来自Tecan infinite,型号M2009PR。Real time PCR 仪器为Roche公司LightCycler 480。荧光显微镜为奥林帕斯公司IX71。
1.2 细胞培养及转染 人恶黑细胞SK-MEL-1、A375以及正常人表皮黑色素细胞HEMn-LP来自中科院上海细胞库。SK-MEL-1细胞最初提取自一位淋巴结转移性恶黑的29岁男性患者,低转移性A375细胞从一54岁女性皮肤恶黑分离获得,正常人表皮黑色素细胞HEMn-LP是从正常新生儿浅色素包皮组织分离获得的表皮黑素细胞。所用DMEM培养基含有10% 胎牛血清(Gibco公司),于37℃ 5% CO2的恒温培养箱中常规培养,传代使用胰蛋白酶消化,按照1∶4的比例进行。siLUCAT1和阴性对照siRNA(siNC)购自Invitrogen公司,转染操作按脂质体2000说明书进行,将siLUCAT1或siNC和脂质体分别溶于Opti-MEM无血清培养基中,混合后于24孔板中进行细胞转染。 使用的siLUCAT1序列正义链5′-CCCAUCAGAAGAUGUCAGAAGAUAA-3′,反义链5′-UUAUCUUCUGACAUCUUCUGAUGGG-3′。
1.3 MTT细胞增殖检测 将转染细胞培养至对数生长期后,以2 ×103个/孔密度铺于96孔板中,设置 6 个复孔,按说明书操作,每孔加入10 mLMTT试剂后,在培养箱中孵育2 h,用荧光相差显微镜观察记录拍照细胞形态及密度,同时用酶标仪检测波长为570 nm吸光值。连续检测5 d,每天同一时间进行检测,绘制细胞生长曲线,观察细胞生长繁殖能力。
1.4 qRT-PCR 采用RNA抽取试剂盒提取细胞总RNA,并逆转录合成cDNA,使用二步法进行Real-Time PCR,并制作熔解曲线,扩增LUCAT1和内参GAPDH基因。引物序列:GAPDH正向引物5′-CATGGCCTTCCGTGTTCCTA-3′;反向引物5′-TGTCATCATAC-
TTGGCAGGTTT-3′,扩增产物片段长度为309bp;LUCAT1正向引物5′-ACCAGCTGTCCCTCAGTGTTCT-3′,反向引物5′-AGGCCTTTATCCTCGGGTTGCCT-3′。基因表达量采用相对定量分析,即2-△△Ct法(ΔCt=目的基因Ct值-内参基因Ct值;-ΔΔCt=NC组ΔCt平均值-各样品ΔCt值)。

2 结果
2.1 在恶黑组织中分析LUCAT1表达 TCGA(The Cancer Genome Atlas)中下载恶黑数据GDC TCGA Melanoma(SKCM),进行差异表达分析,该数据采用RNA-Seq方法检测,数据中原始表达量进行fpkm变换,去除表达量为0的标本,共纳入169例原发或转移性肿瘤标本,55例对照组标本(部分来源于正常血检)。如图1所示,恶黑组LUCAT1表达水平(0.232±0.371)高于对照组(0.156±0.133),差异有统计学意义(t′=-2.245,P<0.05)。
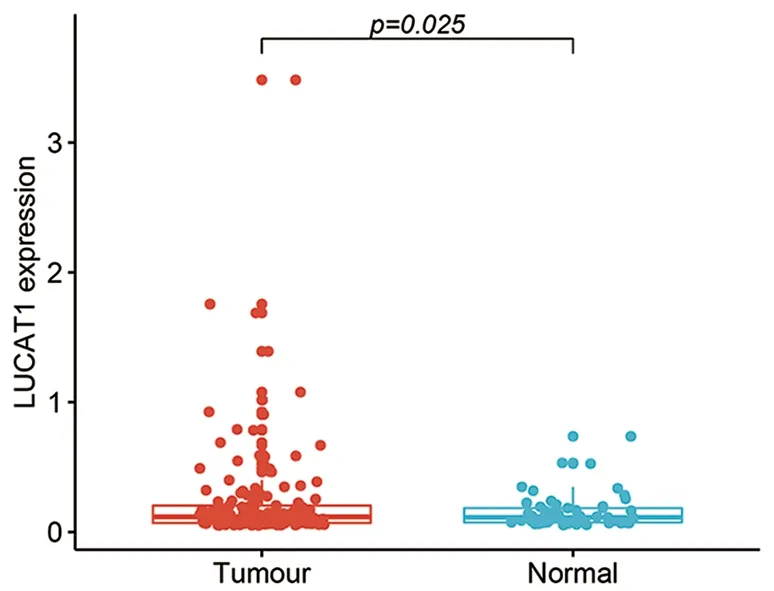
图1 恶黑和正常组织LUCAT1 表达量对比
为了进一步研究LUCAT1与其他基因的相互关系,本研究利用该TCGA数据,分析所有观测基因的表达量与LUCAT1之间的相关性(Pearson相关分析),按相关系数排序,分别选取与LUCAT1正相关和负相关基因各25个进行热图绘制。如图2所示,这可能对本研究后续分析LUCAT1与其他基因的相互作用寻找突破口。

图2 热图显示与LUCAT1具有正、负相关的基因情况
2.2 恶黑细胞SK-MEL-1、A375以及人正常黑色素细胞HEMn-LP中LUCAT1的表达分析 为进一步验证LUCAT1在恶黑的表达情况,本研究用qRT-PCR分别检测了恶黑细胞和正常黑色素细胞中LUCAT1的表达,相对于正常黑色素细胞HEMn-LP的LUCAT1表达量(1.040±0.340),恶性细胞SK-MEL-1、A375表达量(2.700±0.580、2.460±0.177)上升(n=3,F=15.728,P=0.005),提示LUCAT1可能和恶黑的恶性发展相关。
2.3 下调LUCAT1对SK-MEL-1、A375细胞生长的影响 为进一步验证LUCAT1对恶黑细胞生长的影响,本研究继续选取SK-MEL-1、A375两种恶性细胞,利用siRNA技术下调了LUCAT1的表达,并用RT-PCR验证了下调的效果,如图3所示。利用GFP标记的绿色荧光,从图4,可以直观地看到细胞生长在下调LUCAT1后受到了明显的抑制;并利用MTT细胞增殖实验进一步证实,SK-MEL-1细胞中,siLUCAT1组在24 h和72 h较siNC组MTT细胞增殖受到抑制(P<0.05),而在A375细胞中,siLUCAT1组在24 h和48 h较siNC组MTT细胞增殖受到抑制(P<0.05)(表1)。
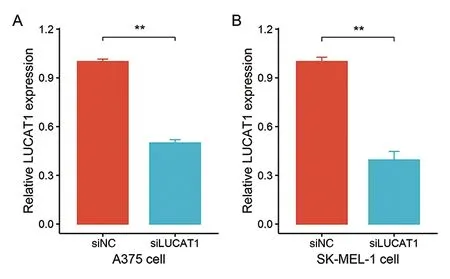
siLUCAT1组相对于siNC组在SK-MEL-1(A:1.000±0.026 vs. 0.500±0.035;n=3,t=19.863,P=0.000)和A375(B:1.000±0.046 vs. 0.395±0.090;n=3,t=10.282,P=0.009),**P<0.01。

siLUCAT1组相对于对照组,细胞生长受到抑制。

表1 siLUCAT1和siNC组在SK-MEL-1和A375中MTT细胞增殖试验比较
3 讨论
近年来,靶向治疗在恶黑的治疗中取得了很大进步,针对MAPK/ERK信号通路分子的特异抑制剂得到临床应用,免疫治疗在恶黑治疗中同样占据非常重要的地位。但是这些治疗远没有达到治愈的目的,恶黑目前仍缺乏行之有效的靶点,也缺乏有效生物标志物判断预后及指导治疗。现有研究表明在恶黑中存在很多个lncRNA可能参与肿瘤细胞生长和侵袭过程,如MALAT1、Hotair、Bancr、Spry4-it1、Anril、Llme23等多种lncRNA[3,5]证实在恶黑中异常表达。
LUCAT1最早发现于肺癌中,位于5号染色体,初步测序分析其转录本上具有4个外显子和3个内含子。LUCAT1也被称为SCAL1(smoke and cancer associated lncRNA 1),在肺癌细胞上有明显表达升高,初步研究表明LUCAT1受NRF2调节介导呼吸气道上皮细胞的基因表达调控和氧化应激过程[4]。Sun等进一步证实了LUCAT1通过p21和p57的表观遗传学抑制从而调控了肿瘤增殖和细胞周期[6]。于贵林证实 LUCAT1 在胃癌肿瘤细胞中过表达,并与静脉侵犯和癌肿迁移均存在相关性,进一步的研究发现可能与上调 FPR2 表达有关[7]。另外,相继发现在结直肠癌[8]、食管癌[9]、胶质瘤[10]、肾细胞癌[11]、肝癌[12]、乳腺癌[13]、宫颈癌[14]中都观察到相似的结果,LUCAT1 的表达均高于相邻的非肿瘤性正常组织,通过下调 LUCAT1后可以显著抑制肿瘤的生长侵袭,提示LUCAT1 作为促癌基因在很多恶性肿瘤中起到了促增殖作用,但在不同肿瘤中其具体的促癌机制不甚相同,其具体的调控机制仍需要进一步探讨。目前文献有关LUCAT1在恶黑中的研究不多,其在恶黑中生长和增殖的生物学作用和调控机制仍不清楚。
本研究通过TCGA数据库检测了恶黑组织LUCAT1表达高于正常对照组,并通过相关分析方法确立了与之正相关和负相关的基因,这可能是LUCAT1促进肿瘤增殖的调控路径中的重要分子,值得进一步研究。本研究运用qRT-PCR技术进一步发现在恶黑细胞SK-MEL-1、A375中相对于正常黑色素细胞呈明显高表达状态,利用MTT检测结果表明抑制LUCAT1表达后细胞生长得到抑制,这些数据均表明LUCAT1与恶黑的发展可能密切相关。
综上所述,LUCAT1可能上调恶黑细胞的活性,促进肿瘤的生长,但其具体的分子生物学机制如下游的靶分子仍需要进一步研究深入探讨,为恶黑的精准治疗提供依据。
