T2WI影像组学辅助诊断前列腺癌价值初探
2021-05-13张晓金汪建文徐承东徐家军张京刚
张晓金,汪建文,张 虎,徐承东,徐家军,张京刚
(1.芜湖市第二人民医院 医学影像科,安徽 芜湖 241000;2.常州市第一人民医院 医学影像科,江苏 常州 213100)
前列腺癌(prostate cancer,PCa)是老年男性最常见的恶性肿瘤之一,发病率和病死率均呈上升趋势[1],前列腺MRI检查在PCa诊断及主动监测中的作用受到越来越多临床及影像医生的青睐。第二版前列腺影像报告与数据系统(prostate imaging reporting and data system version 2,PI-RADS v2)推荐采用T2WI和DWI序列分别作为移行带(transitional zone,TZ)和外周带(peripheral zone,PZ)PCa检出的关键序列,并按危险度的增加分为1~5分5个等级[2]。影像组学不仅可用于肿瘤的诊断与分期、疗效评价和生存期预测等方面,还可辅助提高影像诊断效能,缩短耗时[3-5]。笔者将其用于鉴别PCa和非癌组织,旨在探讨其临床实用性。
1 资料与方法
1.1 研究对象 回顾性分析2018年3月~2020年1月于芜湖市第二人民医院行双参数MRI(biparametric MRI,Bp-MRI)检查,PI-RADS v2评分为3分和4分的82例住院患者的临床及影像资料,共120个病灶,PI-RADS v2评分3分68个,4分52个,其中癌灶60个。纳入标准:①Bp-MRI检查后2个月内获得病理结果;②所获图像满足诊断及研究要求;③无MRI检查禁忌,检查前签署知情同意书。排除标准:①病灶体积过小,不能准确勾画容积感兴趣区(volume of interest,VOI);②病灶的病理诊断取材部位与T2WI图像位置不匹配;③Bp-MRI检查前已针对前列腺行内分泌或放射治疗者。
1.2 MRI检查方法 采用Philips Achieva 3.0T MR扫描仪,16通道腹部相控阵线圈。检查前告知患者检查流程,线圈中心对准耻骨联合。Bp-MRI扫描符合PI-RADS v2推荐标准[2],横轴位T2WI采用快速自旋回波(turbo spin echo,TSE)序列,TR 4 570 ms,TE 89 ms,FOV 20 mm×20 mm,矩阵276×238,层厚3.0 mm,层间距0 mm,3次激励。其他扫描序列还包括:矢状位T2WI、冠状位T2WI、横轴位T1WI、DWI(b=0、1 000、2 000 s/mm2)。
1.3 病理获取 采用经直肠超声(transrectal ultrasonography,TRUS)前列腺系统穿刺活检术获取病理。将前列腺基底部、体部、尖部划分为左、右区,基底部和体部左、右区再细分为内、外区,共10区,每区穿1针,对可疑病灶靶向追加2针。穿刺术由超声科医师完成,操作者需记录穿刺区域和进针深度。病理切片由病理科医师负责阅读、诊断,PCa病理诊断按照Gleason评分(Gleason score,GS)系统记录,非PCa诊断包括炎症、上皮内瘤变、前列腺增生及纤维瘢痕等。
1.4 图像分割、特征筛选及建模 影像科经PI-RADS v2培训的医师运用ITK-SNAP 3.6软件根据Bp-MRI及病理结果在标准化后的T2WI图像上对病灶进行勾画,ROI放置于病灶最大层面,经放大处理并避开边缘部分,共得到120个目标区域。使用AK(version 3.2.0.R)软件进行T2WI图像影像组学特征提取,包括42个直方图特征、9个几何形态特征、144个灰度共生矩阵特征、11个灰度尺寸区域特征、10个哈拉利克特征及180个行程矩阵特征共396个影像组学特征参数。120个病灶按78∶42随机分为训练集和验证集,对训练集的数据使用最大相关最小冗余法(maximum relevant minimum reduandency,mRMR)、最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)进行特征筛选和降维,筛选模型误差最小时系数不为0的特征,根据保留的特征计算影像组学评分(Rad_score)。最终建立PI-RADS v2评分为3分和4分病灶的T2WI影像组学诊断模型,并运用验证集的数据进行内部验证。
1.5 图像分析 将入组病例按时间排序,甲乙两名医师按Bp-MRI方案分别对病灶做出PCa或非PCa的分类结果诊断并记录耗时。Bp-MRI方案除T2WI、DWI、表观扩散系数(apparent diffusion coefficient,ADC)图像外,还包括患者一般资料、前列腺特异性抗原(prostate specific antigen,PSA)水平、病灶部位和ADC值。1个月后,入组病例按年龄重新排序,甲乙两者在获得T2WI影像组学PCa和非PCa的分类结果情况下按Bp-MRI方案提供的资料重新诊断并记录耗时。
1.6 统计学方法 运用SPSS 26.0和R软件(version 3.5.0)进行统计学分析。Kappa分析操作者间一致性;使用glmnet包进行特征降维并建立影像组学模型;采用Wilcox on检验评估影像组学评分鉴别PCa和非癌组织的能力,并进行内部验证;采用pROC包绘制ROC曲线;使用混淆矩阵计算模型的灵敏度、特异度。ROC曲线分析甲乙两者两种方案对PCa的检出效能并计算曲线下面积(AUC)值、约登指数、灵敏度、特异度。
2 结果
2.1 操作者间一致性 采用Bp-MRI方案,甲乙两者Kappa系数为0.747;在影像组学辅助下,Kappa系数为0.814。甲乙采用两种方法对病灶分类结果均具有较高的一致性,在影像组学辅助下,一致性有所上升。
2.2 T2WI影像组学模型的建立 通过LASSO得到模型二项式偏差、系数随超参数λ变化(图1A),点线位置所示为最小λ,所对应的模型误差最小,λ值为0.0061。在λ最小点线处保留9个系数不为0的特征(图1B),特征按重要性排序,横坐标为系数,纵坐标为所保留的特征,系数越大,表明该特征与因变量之间的关系越大,预测作用越明显。根据保留的特征建立Rad_score,根据样本的Rad_score值对样本进行分类(图1C),两组分类结果在训练集(P<0.001)和验证集(P=0.002)中均有统计学意义,表明模型分类结果较好。影像组学评分ROC分析(图1D),训练集AUC为0.83(95%CI0.79~0.88),准确率75.6%(59/78),灵敏度59.0%(23/39),特异度92.3%(36/39);阳性预测值88.5%(23/26),阴性预测值69.2%(36/52)。验证集AUC为0.78(95%CI0.62~0.93),准确率76.2%(32/42),灵敏度66.7%(14/21),特异度85.7%(18/21),阳性预测值为82.4%(14/17),阴性预测值为72.0%(18/25)。
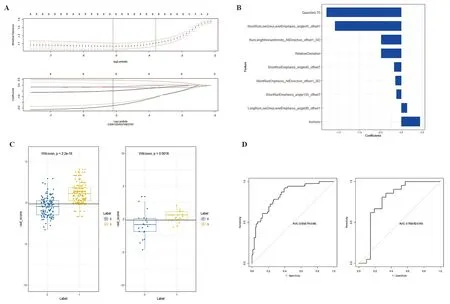
A.十折交叉验证与特征降维, 获得点线位置最优λ;B.9个系数不为0的影像组学特征及所对应的权重;C.根据所保留的影像组学特征进行分类的散点图;D.影像组学模型(左为训练集,右为内部验证集)。
2.3 T2WI影像组学辅助诊断价值 甲乙运用Bp-MRI方案诊断耗时分别为5小时46分钟、5小时33分钟,在影像组学辅助下耗时分别为5小时12分钟、4小时51分钟,分别减少9.8%和12.6%。甲乙运用Bp-MRI方案诊断PCa的AUC值分别为0.81、0.82;在T2WI影像组学辅助下的AUC值分别为 0.86、0.89(图2A、2B、表1),AUC值、灵敏度、特异度及约登指数均有所提升。
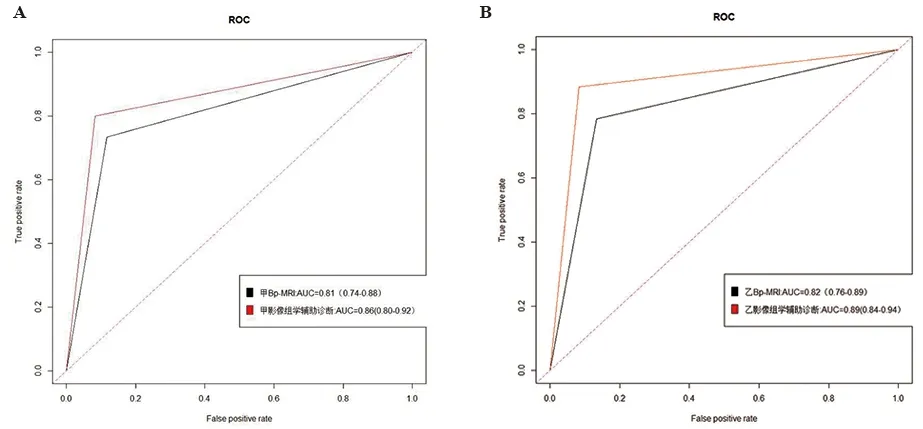
A.甲运用Bp-MRI和影像组学辅助下检出PCa的ROC曲线;B.乙运用Bp-MRI和影像组学辅助下检出PCa的ROC曲线。

表1 Bp-MRI方案和影像组学辅助诊断检出PCa的效能
3 讨论
3.1 基于PI-RADS v2的局限性 PI-RADS v2推荐多参数MRI(multiparametric MRI,Mp-MRI)用于前列腺检查,动态对比增强MRI(dynami ccontrast enhanced MRI,DCE-MRI)和磁共振波谱(magnetic resonance spectroscopy,MRS)并非检出PCa的关键序列,DCE-MRI仅用于DWI评分为3分时对PZ病灶进一步评估[6-7],定性诊断价值有限;MRS检查失败率高,现已逐渐退出PCa一线序列。PI-RADS v2没有具体阐述评分结果与临床决策之间的联系。笔者认为,对于PI-RADS v2评分为1分和2分的患者大多可采用PSA和(或)MRI进行主动监测[8],5分病灶需更多关注肿瘤分期和疗效评估。3分和4分的病灶,诊断正确与否直接影响患者预后,正确做出PCa的诊断,多可采用PCa根治术治愈疾患;对于非PCa患者,可减少不必要的手术和穿刺活检,使患者利益最大化,这也是本研究仅入组PI-RADS v2评分为3分和4分病灶的原因。
3.2 Bp-MRI方案临床应用前景 张跃跃等[9]的大样本研究发现,Mp-MRI与Bp-MRI方案检出PCa效能均较高,AUC分别为0.873、0.879,且两者对临床显著性PCa的检出价值无统计学差异。大量研究结果也证实[7,10-12],Bp-MRI方案可较好区分PCa和非癌病灶,有效指导临床决策。 Bp-MRI方案检查、诊断耗时均较Mp-MRI方案缩短,无需注射对比剂,安全性高,对技术要求低,且可节省一定的费用,在一定程度上可满足不断增长的临床需求,临床应用前景广阔。本研究单独采用Bp-MRI方案检出PCa的AUC分别为0.81、0.82,分类结果尚佳。
3.3 影像组学辅助诊断的优势 影像组学通过计算机软件将医学图像转化为数据信息,可重复、客观、定量描述肿瘤的异质性,弥补了医师根据影像图像定性诊断的不足。本研究模型训练集AUC为0.83,验证集为0.78,能较好地区分PCa和非癌组织,为临床诊断PCa提供新的思路和方法。本研究结果表明,Bp-MRI方案结合影像组学,医师对区分PCa和非癌组织的信心增加,耗时缩短,操作者间一致性、诊断效能、灵敏度、特异度及约登指数均有所提升。此外,影像组学实现了影像图像-影像数据的转化,可挖掘人眼无法分辨的图像细节信息,且无需增加扫描,在PCa的研究中已有大量工作发表。多项研究结果表明[8,13],基于T2WI和(或)DWI的影像组学模型可用于PCa的诊断、危险度评估等,对PI-RADS v2有较好的补充作用。
3.4 本研究的不足 本研究样本量小,还需纳入更多病例,深入研究。本研究只建立了基于T2WI的影像组学模型,没有运用DWI序列和ADC图建模,无法知晓各模型之间的优劣,此外,本研究模型未进行外部验证,可能使结果的泛化能力受到质疑。
综上所述,本研究采用影像组学方法对前列腺T2WI图像进行数据挖掘,并构建了PI-RADS v2评分为3分和4分病灶的PCa预测模型,该模型分类结果尚佳;其与Bp-MRI方案联合应用,可提高PCa的检出效能,有明确临床获益。
