miR-125b对晶状体上皮细胞的抗氧化应激作用及其机制
2021-05-12李翔张颖黄亚琳吴众郭浩轶
李翔 张颖 黄亚琳 吴众 郭浩轶
河南省人民医院 河南省立眼科医院 郑州大学人民医院眼科,郑州 450003
年龄相关性白内障是导致老年人群盲的重要原因。目前认为,氧化应激是导致白内障的主要因素,氧化应激反应产物导致晶状体上皮细胞(lens epithelial cells,LECs)的通透性及蛋白构象发生改变,从而导致晶状体混浊[1-3]。微小RNA(microRNA,miRNA)是非编码RNA,通过与靶基因的3’-非翻译区(3’-untranslated region,3’-UTR)的互补序列结合而刺激或抑制靶基因的翻译[4]。近年来发现多种miRNA在LECs的氧化应激损伤过程中发挥作用,参与白内障的发生和发展[5-6],此外,miRNA 125b(miR-125b)在多种细胞的氧化应激反应中发挥作用[7-8],推测其可能参与人LECs的氧化应激过程,但目前尚未得到证实。本研究探讨miR-125b对年龄相关性白内障LECs抗氧化应激能力的作用及其可能的作用机制,为白内障的防治寻找潜在靶点。
1 材料与方法
1.1 材料
1.1.1晶状体前囊膜组织标本的收集 收集2018年7月至2019年3月于河南省立眼科医院行白内障超声乳化手术的单纯性年龄相关性白内障患者24例24眼,其中男10例10眼,女14例14眼;年龄54~73岁,平均(64.32±7.93)岁,于手术中收集晶状体前囊膜组织;同时收集河南省立眼科医院眼库的供体晶状体前囊膜组织20例20眼,其中男9例9眼,女11例11眼;年龄52~70岁,平均(61.28±8.21)岁。本研究标本提供者或其家属均签署知情同意书,本研究方案及标本使用经河南省立眼科医院伦理委员会批准(批文号:YKYY20193151)。
1.1.2细胞来源、主要试剂及仪器 永生化人LECs系(HLEB-3)购自中国科学院上海细胞库。miR125b拟似物、miR-125b抑制物和miR-125b对照序列均由上海吉玛基因公司合成;CCK-8试剂盒(杭州四季青公司);LipofectamineTM2000、Trizol、兔源核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)多克隆抗体(PA5-68817)、山羊抗兔IgG(H+L)二抗(A32731)、山羊抗鼠IgG(H+L)二抗(A32723)、兔源Nrf2荧光一抗(710574)、鼠源Keap1荧光一抗(MA5-17106)(美国Invitrogen公司);DAPI染色液(北京索莱宝公司);DCFH-DA活性氧簇(reactive oxygen species,ROS)荧光探针(北京百奥莱博科技有限公司);总抗氧化能力(total-antioxidative capability,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、还原型谷胱甘肽(glutathone,GSH)、丙二醛(malondialdehyde,MDA)检测试剂盒(上海碧云天有限公司)。免疫荧光显微镜(日本Olympus公司);酶标仪(美国Bio-Rad公司);PCR仪(美国Applied Biosystems公司);紫外分光光度计(德国Eppendorf公司)。
1.2 方法
1.2.1细胞氧化应激模型的制备 将冻存的HLEB-3细胞解冻、复苏,重悬于含体积分数10%胎牛血清(fetal bovine serum,FBS)和含青链霉素混合液的DMEM培养基中,置于37 ℃、体积分数5% CO2培养箱中培养,待细胞融合至约80%时传代,按照培养基中添加H2O2浓度不同将细胞分为100、200和400 μmol/L H2O2组,对照组加入不含H2O2的培养基,于培养箱中继续培养。
1.2.2细胞转染 取处于对数生长期的HLEB-3细胞以2×105个/孔细胞密度接种于6孔板,分别使用含有miR-125b拟似物、miR-125b对照和miR-125b抑制物序列的质粒转染细胞,将细胞分为miR-125b拟似物组、miR-125b对照组和miR-125b抑制物组。按照转染试剂Lipofectamine2000说明书中所示步骤,分别转染细胞6 h,将各组细胞转移至完全培养基继续培养。
1.2.3应用DCFH-DA荧光探针检测各组细胞中内源性ROS含量 取处于对数生长期的HLEB-3细胞以1×104个/孔细胞密度接种于96孔板,将细胞按照1.2.1描述的方法制备氧化应激模型,继续培养24 h,吸去培养液,加入10 μmol/L DCFH-DA荧光探针溶液,培养箱中孵育20 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞,多功能酶标仪检测荧光强度值,即为细胞内ROS含量,用激光扫描共焦显微镜拍照,激发光波长为485 nm,发射光波长为530 nm。转染细胞在含200 μmol/L H2O2的培养基中继续培养24 h,细胞中ROS含量检测方法同上。
1.2.4ELISA法检测T-AOC、SOD、GSH-Px、GSH活性及MDA浓度 将处于对数生长期的HLEB-3细胞以1×104个/孔的密度接种于96孔板,将细胞按照1.2.1描述的方法制备氧化应激模型,细胞继续培养24 h,采用相应试剂盒说明书中的步骤测定细胞中T-AOC、SOD、GSH-Px、GSH活性和MDA浓度。转染的细胞在含200 μmol/L H2O2的培养基中继续培养24 h,采用上述方法检测细胞T-AOC、SOD、GSH-Px、GSH活性和MDA浓度。
1.2.5逆转录PCR法测定晶状体前囊膜组织标本和HLEB-3细胞内miR-125b表达 取白内障患者和正常供体晶状体前囊膜组织标本,收集对照组及不同浓度H2O2(100、200、400 μmol/L)处理组细胞,Trizol法提取组织和细胞总RNA,逆转录得到cDNA,反应体系:Master Mix 10 μl,正反向引物各2 μl,cDNA模板2 μl,ddH2O 10 μl;反应条件:95 ℃预变性10 min;95 ℃变性25 s,60 ℃退火40 s,60 ℃延伸50 s,重复45个循环。行PCR扩增,反应体系:cDNA<0.5 μl,正向引物(10 μmol/L)1.0~2.0 μl,反向引物(10 μmol/L)1.0~2.0 μl,10倍Easy Taq buffer 5.0 μl,2.5 mmol/L dNTPs 4.0 μl,Easy Taq DNA聚合酶0.5 μl,ddH2O定容至50.0 μl。扩增条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃延伸6 min。琼脂糖凝胶电泳,用图像记录分析系统对目的基因、参比基因的条带灰度值进行分析。目的基因表达量=目标DNA条带灰度值/GAPDH条带灰度值×100%。转染后细胞在含200 μmol/L H2O2的培养基中继续培养24 h,以上述方法检测细胞内miR-125b的相对表达量。每个实验结果独立重复3次。引物序列:miR-125b正向引物为5’-CGTATCGGATTCGGACTTGC-3’,反向引物为5’-CTTTAGCTAGGGCTAGCGTG-3’;GAPDH正向引物为5’-AGTGCTAGCTGATATGAC-3’,反向引物为5’-CGTAGTCGATGCATAGCT-3’。
1.2.6Western blot法测定晶状体前囊膜组织标本和HLEB-3细胞内Nrf2蛋白的表达 采用不同浓度H2O2(0、100、200和400 μmol/L H2O2)分别处理细胞24 h,收集各组细胞,RIPA裂解液提取总蛋白,将蛋白样品加入SDS-PAGE凝胶加样孔进行电泳,使蛋白转移至PVDF膜,用质量分数5%脱脂奶粉室温封闭2 h,TBST温和洗膜3 min后加入相应的一抗(1∶ 100),4 ℃孵育过夜,TBST洗涤10 min,共3次,加入对应二抗(1∶ 1 000),室温下孵育1 h,TBST洗涤10 min,共3次,加入配制好的ECL发光液,避光孵育5 min,采用化学发光凝胶成像仪采集图片信息,图片用Image pro plus 6.0软件进行灰度分析,以GAPDH为内参,计算目的蛋白和内参灰度之比,即为蛋白相对表达量。将转染细胞在含200 μmol/L H2O2的培养基中继续培养24 h,以上述方法检测细胞内Nrf2的表达。每个实验结果独立重复3次。
1.2.7免疫荧光双染色法检测细胞内Keap1、Nrf2表达 采用200 μmol/L H2O2处理细胞24 h,PBS洗涤细胞,采用预冷多聚甲醛在4 ℃下固定30 min,质量分数0.1%吐温处理10 min,室温下PBS洗涤5 min,封闭液中室温封闭30 min,加入鼠源Keap1(1∶ 20)、兔源Nrf2(1∶ 100)一抗,4 ℃孵育过夜,PBS洗涤细胞,加入相应二抗(1∶ 1 000),室温孵育1 h,PBS洗涤,加入核染色剂室温染色1 min,PBS洗涤后,荧光封片剂封片,荧光显微镜下观察细胞内Keap1和Nrf2荧光强度,每个切片任意选取5个视野。ROS阳性反应呈绿色荧光,细胞核呈蓝色荧光。
1.2.8靶基因预测及双荧光素酶报告基因分析 为了确定miR-125b在HLEB-3细胞中发挥生物学功能的靶向作用点,利用miRanda、TargetScan数据库预测miR-125b的潜在靶基因,其中Nrf2在miR-125b的3’UTR上有结合位点。将处于对数生长期的HLEB-3细胞以2×105个/孔的密度接种于24孔板,用LipofectamineTM2000将荧光素酶报告载体(Nrf2-3’-UTR-WT或Nrf2-3’UTR-MT)与miR-125b拟似物/抑制物/对照共转染细胞,以Renilla荧光素酶质粒(100 ng/孔)为对照,与载体共转染。细胞转染24 h,以GAPDH为内参,用双荧光素酶报告分析系统测定荧光素酶活性。
1.3 统计学方法
采用SPSS 20.0统计学软件(美国IBM公司)进行统计分析。计量资料的数据经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示,组间均数经Levene检验证实方差齐。采用均衡分组单因素干预多水平研究设计,正常供体晶状体前囊膜和白内障患者晶状体前囊膜组间各检测指标差异比较采用独立样本t检验,miR-125b拟似物组、miR-125b对照组和miR-125b抑制物组间各检测指标总体差异比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 正常供体和白内障患者晶状体前囊膜组织中miR-125b和Nrf2表达
白内障患者晶状体前囊膜中miR-125b和Nrf2蛋白的表达条带均明显增强。白内障患者晶状体前囊膜中miR-125b和Nrf2蛋白的相对表达量分别为0.89±0.05和0.84±0.12,明显高于正常供体中的0.21±0.03和0.27±0.06,组间比较差异均有统计学意义(t=15.355,P<0.05;t=18.647,P<0.05)(图1)。
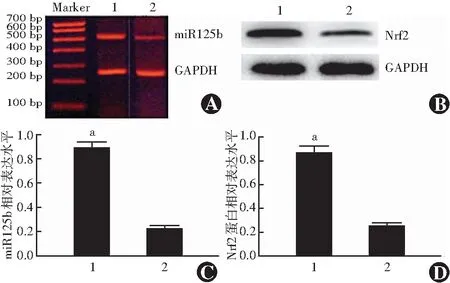
图1 正常供体和白内障患者晶状体前囊膜中miR-125b和Nrf2蛋白的表达 A:逆转录PCR法检测各组晶状体前囊膜中miR-125b的表达 B:Western blot法检测各组晶状体前囊膜中Nrf2蛋白的表达 C:各组晶状体组织中miR-125b的相对表达量比较 与正常晶状体组织比较,aP<0.05(独立样本t检验;白内障组织,n=24;正常组织,n=20) D:各组晶状体组织中Nrf2蛋白的相对表达量比较 与正常晶状体组织比较,aP<0.05(独立样本t检验;白内障组织,n=24;正常组织,n=20) 1:白内障晶状体组织 2:正常晶状体组织 miR:微小RNA;GAPDH:甘油醛-3-磷酸脱氢酶;Nrf2:核因子E2相关因子2Figure 1 Expression levels of miR-125b and Nrf2 protein in the lens anterior capsule of normal donors and cataract patients A:The expression intensity of miR-125b in the lens anterior capsule of different specimens by reverse transcription PCR B:The expression intensity of Nrf2 protein in the lens anterior capsule of different specimens by Western blot assay C:The comparison of relative expression levels of miR-125b Compared with the normal anterior lens capsule specimen,aP<0.05 (Independent-samples t test;cataract tissues,n=24;normal tissues,n=20) D:The comparison of relative expression levels of Nrf2 protein Compared with the normal anterior lens capsule specimen,aP<0.05 (Independent-samples t test;cataract tissues,n=24;normal tissues,n=20) 1:Lens anterior capsule of cataract patients 2:Lens anterior capsule of normal donors miR:microRNA;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;Nrf2:nuclear factor E2-related factor 2
2.2 不同浓度H2O2处理组细胞中miR-125b、Nrf2的表达比较
与对照组比较,100、200和400 μmol/L H2O2组细胞内miR-125b和Nrf2蛋白表达条带均明显增强,且随着H2O2浓度增加,miR-125b和Nrf2蛋白的表达条带均逐渐增强。对照组及100、200和400 μmol/L H2O2组细胞内miR-125b相对表达量分别为0.21±0.03、0.52±0.05、0.69±0.04和0.86±0.11,总体比较差异有统计学意义(F=13.513,P<0.01),100、200和400 μmol/L H2O2组细胞内miR-125b相对表达量均明显高于对照组,差异均有统计学意义(均P<0.05)。对照组及100、200和400 μmol/L H2O2组细胞内Nrf2蛋白相对表达量分别为0.24±0.04、0.49±0.06、0.74±0.06和0.91±0.10,总体比较差异有统计学意义(F=10.228,P=0.012),100、200和400 μmol/L H2O2组细胞内Nrf2蛋白相对表达量均明显高于对照组,差异均有统计学意义(均P<0.05)(图2)。
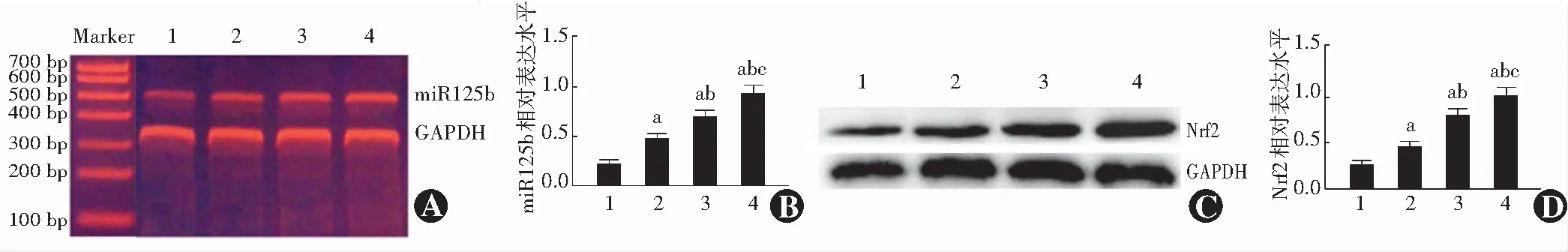
图2 不同浓度H2O2处理组细胞中miR-125b和Nrf2的表达 A:逆转录PCR法检测各组细胞中miR-125b表达 B:各组细胞中miR-125b相对表达量比较 F=13.513,P<0.01.与对照组比较,aP<0.05;与100 μmol/L H2O2组比较,bP<0.05;与200 μmol/L H2O2组比较,cP<0.05(单因素方差分析,LSD-t检验,n=6) C:Western blot法检测不同浓度H2O2处理组细胞中Nrf2蛋白表达 D:各组细胞中Nrf2蛋白相对表达量比较 F=10.228,P=0.012.与对照组比较,aP<0.05;与100 μmol/L H2O2组比较,bP<0.05;与200 μmol/L H2O2组比较,cP<0.05(单因素方差分析,LSD-t检验,n=6) 1:对照组 2:100 μmol/L H2O2组 3:200 μmol/L H2O2组 4:400 μmol/L H2O2组 miR:微小RNA;GAPDH:甘油醛-3-磷酸脱氢酶;Nrf2:核因子E2相关因子2Figure 2 Expression levels of miR-125b and Nrf2 protein in different concentrations of H2O2groups A:The expression intensity of miR-125b in different concentrations of H2O2 groups by reverse transcription PCR B:Comparison of relative expression levels of miR-125b among different concentrations of H2O2 groups F=13.513,P<0.01.Compared with the control group,aP<0.05;compared with the 100 μmol/L H2O2 group,bP<0.05;compared with the 200 μmol/L H2O2 group,cP<0.05 (One-way ANOVA,LSD-t test,n=6) C:The expression intensity of Nrf2 protein in oxidative stress model groups by Western blot D:Comparison of relative expression levels of Nrf2 protein F=10.228,P=0.012.Compared with the control group,aP<0.05;compared with the 100 μmol/L H2O2 group,bP<0.05;compared with the 200 μmol/L H2O2 group,cP<0.05 (One-way ANOVA,LSD-t test,n=6) 1:Control group 2:100 μmol/L H2O2 group 3:200 μmol/L H2O2 group 4:400 μmol/L H2O2 group miR:micro RNA;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;Nrf2:nuclear factor E2-related factor 2
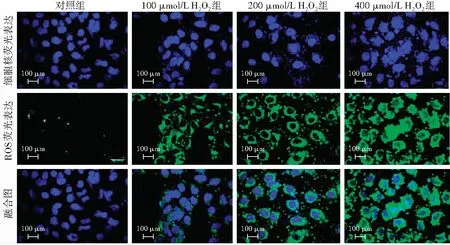
图3 不同浓度H2O2处理组细胞内源性ROS表达(×600,标尺=100 μm) ROS阳性反应呈绿色荧光(DCFH-DA),细胞核呈蓝色荧光(DAPI)。随着H2O2浓度的增加,ROS荧光明显增强 ROS:活性氧簇;H2O2:过氧化氢Figure 3 The expression intensity of endogenous ROS in different concentrations of H2O2 groups(×600,bar=100 μm) ROS-positive reaction showed green fluorescence (DCFH-DA),and nuclei showed blue fluorescence (DAPI).The ROS response was enhanced with the increase of H2O2 concentration ROS:reactive oxygen species;H2O2:hydrogen peroxide
2.3 不同浓度H2O2处理组细胞中ROS含量及氧化应激相关酶活性比较
对照组未发现ROS荧光,随着处理组H2O2浓度增加,ROS荧光强度明显增强(图3)。对照组及100、200和400 μmol/L H2O2组细胞内源性ROS荧光强度分别为89.43±3.23、147.38±8.33、94.44±7.29和252.34±11.31,总体比较差异有统计学意义(F=25.316,P<0.01),100、200和400 μmol/L H2O2组细胞内源性ROS荧光强度均显著高于对照组,差异均有统计学意义(均P<0.05)。与对照组比较,各组T-AOC、GSH-Px和SOD活性均明显降低,MDA浓度明显升高,差异均有统计学意义(均P<0.05),这种差异随着H2O2浓度的增加而增大,任意2个组间两两比较,差异均有统计学意义(均P<0.05)(表1)。
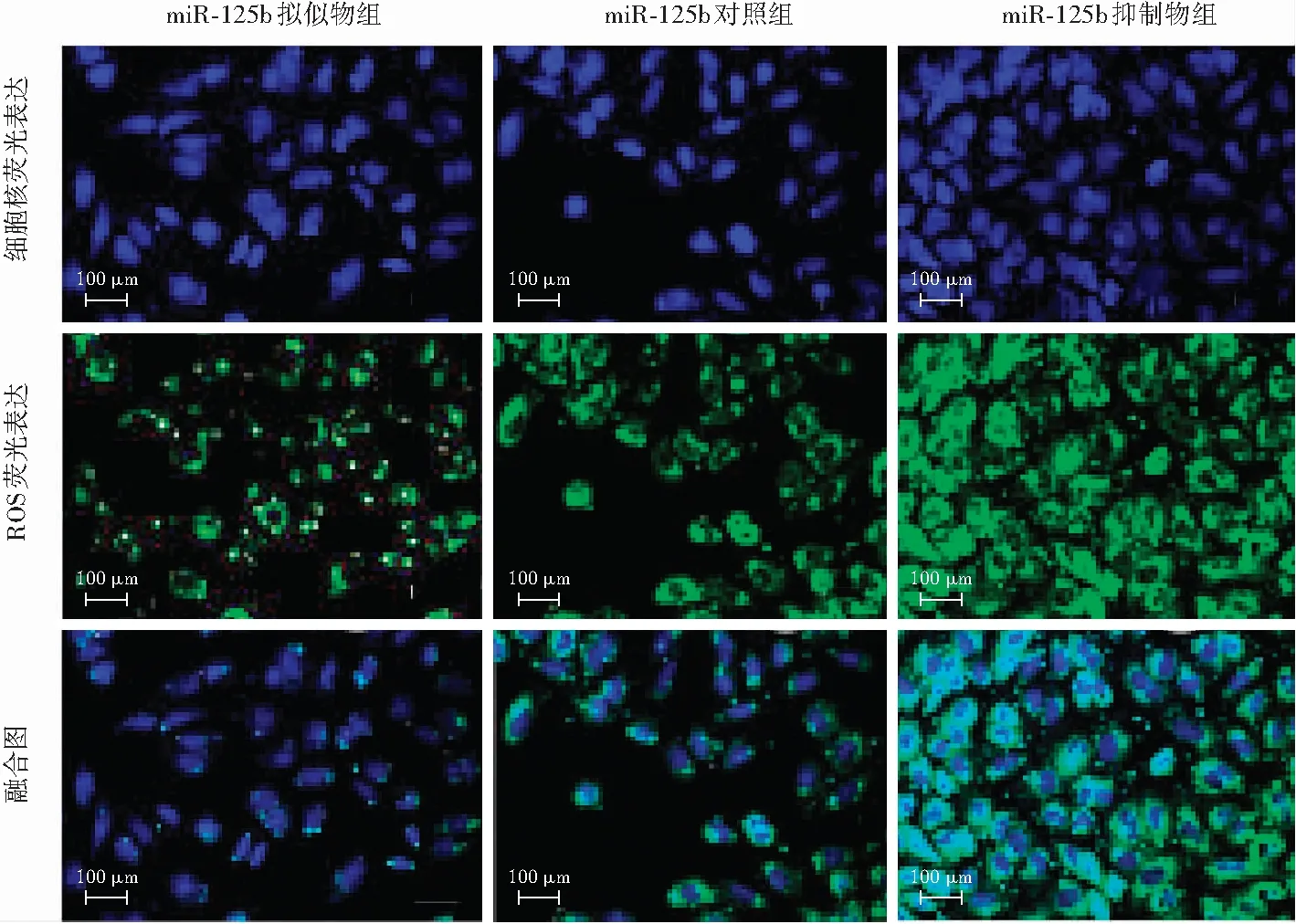
图4 不同转染组细胞中内源性ROS荧光表达(×600,标尺=100 μm) 细胞中ROS反应呈绿色荧光(DCFH-DA),细胞核呈蓝色荧光(DAPI)。不同转染组中miR-125b拟似物组细胞中ROS荧光强度最弱,miR-125b抑制物组ROS荧光最强 ROS:活性氧簇;miR:微小RNAFigure 4 The response intensity of endogenous ROS in different transfected groups(×600,bar=100 μm) The positive response of ROS showed green fluorescence (DCFH-DA),and the nuclei displayed blue fluorescence (DAPI).In different transfected groups,ROS response was the weakest in the miR-125b mimics group and strongest in the miR-125b inhibitor group ROS:reactive oxygen species;miR:micro RNA
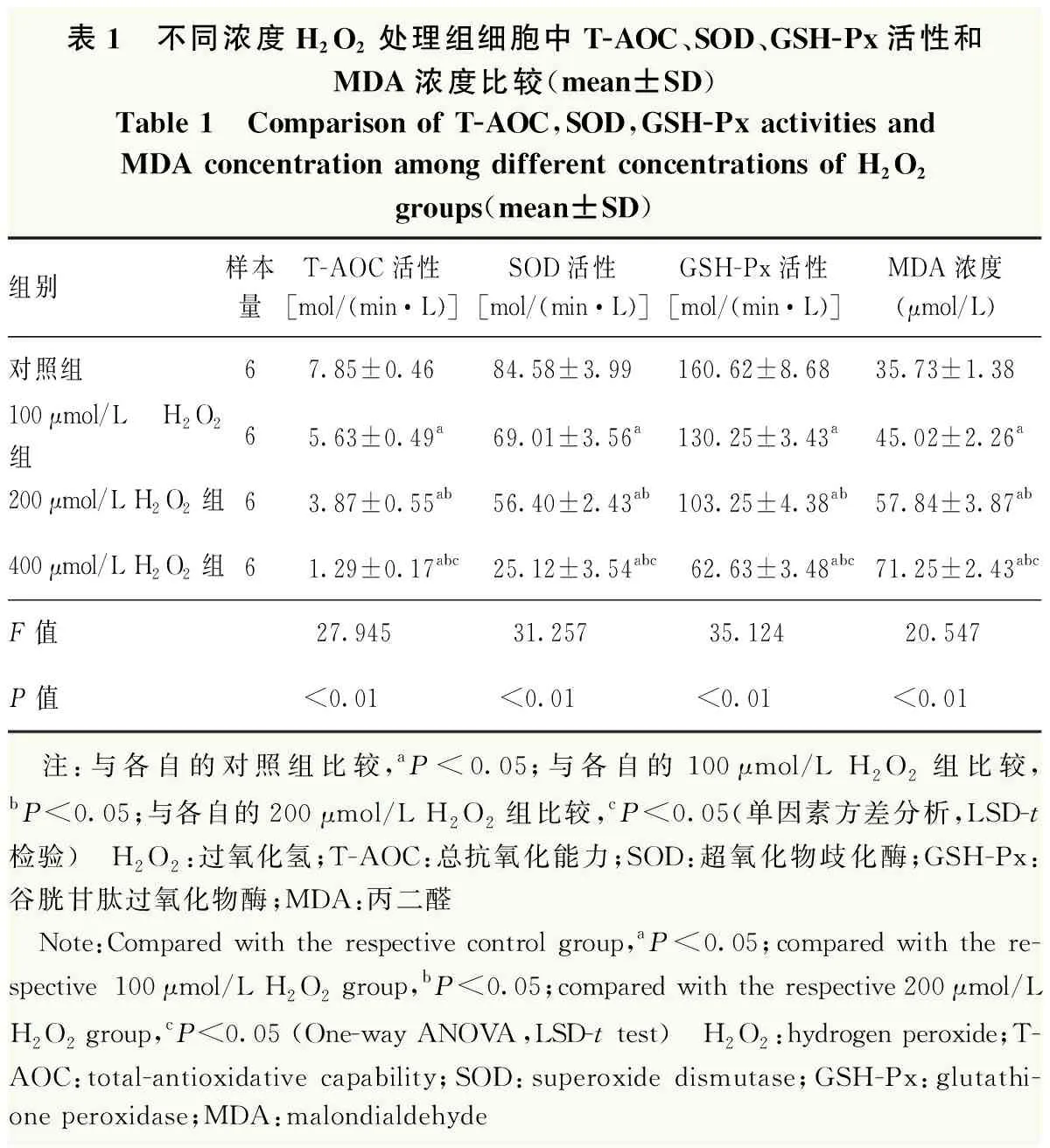
表1 不同浓度H2O2处理组细胞中T-AOC、SOD、GSH-Px活性和MDA浓度比较(mean±SD)Table 1 Comparison of T-AOC,SOD,GSH-Px activities and MDA concentration among different concentrations of H2O2groups(mean±SD)组别样本量T-AOC活性[mol/(min·L)]SOD活性[mol/(min·L)]GSH-Px活性[mol/(min·L)]MDA浓度(μmol/L)对照组67.85±0.4684.58±3.99160.62±8.6835.73±1.38100μmol/L H2O2组65.63±0.49a69.01±3.56a130.25±3.43a45.02±2.26a200μmol/L H2O2组63.87±0.55ab56.40±2.43ab103.25±4.38ab57.84±3.87ab400μmol/L H2O2组61.29±0.17abc25.12±3.54abc62.63±3.48abc71.25±2.43abcF值27.94531.25735.12420.547P值<0.01<0.01<0.01<0.01 注:与各自的对照组比较,aP<0.05;与各自的100μmol/L H2O2组比较,bP<0.05;与各自的200μmol/L H2O2组比较,cP<0.05(单因素方差分析,LSD-t检验) H2O2:过氧化氢;T-AOC:总抗氧化能力;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;MDA:丙二醛 Note:Compared with the respective control group,aP<0.05;compared with the re-spective 100μmol/L H2O2 group,bP<0.05;compared with the respective 200μmol/L H2O2 group,cP<0.05 (One-way ANOVA,LSD-t test) H2O2:hydrogen peroxide;T-AOC:total-antioxidative capability;SOD:superoxide dismutase;GSH-Px:glutathi-one peroxidase;MDA:malondialdehyde
2.4 不同转染组细胞中氧化应激相关指标表达
miR-125b拟似物组ROS表达最弱,miR-125b抑制物组ROS表达最强(图4)。miR-125b拟似物组、miR-125b对照组和miR-125b抑制物组细胞中ROS荧光强度分别为73.23±5.33、189.32±7.33和324.23±10.33,总体比较差异有统计学意义(F=34.138,P<0.01),miR-125b拟似物组ROS荧光强度显著低于miR-125b对照组和miR-125b抑制物组,差异均有统计学意义(均P<0.05);miR-125b拟似物组细胞内T-AOC、SOD和GSH-Px活性均显著高于miR-125b对照组,MDA浓度低于miR-125b对照组,差异均有统计学意义(均P<0.05);与miR-125b对照组比较,miR-125b抑制物组细胞内T-AOC、SOD和GSH-Px活性均明显下降,MDA浓度明显升高,差异均有统计学意义(均P<0.05)(表2)。
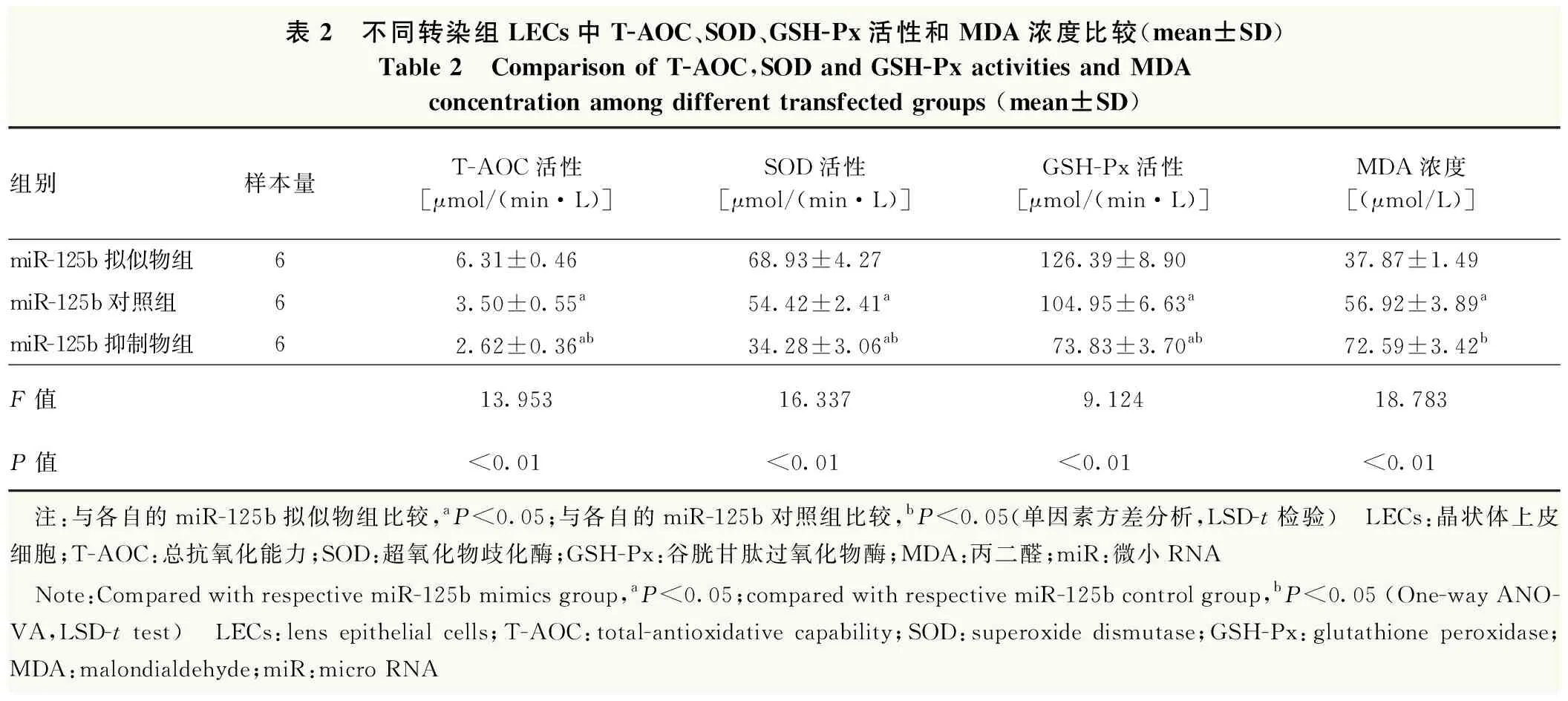
表2 不同转染组LECs中T-AOC、SOD、GSH-Px活性和MDA浓度比较(mean±SD)Table 2 Comparison of T-AOC,SOD and GSH-Px activities and MDA concentration among different transfected groups (mean±SD)组别样本量T-AOC活性[μmol/(min·L)]SOD活性[μmol/(min·L)]GSH-Px活性[μmol/(min·L)]MDA浓度[(μmol/L)]miR-125b拟似物组66.31±0.4668.93±4.27126.39±8.9037.87±1.49miR-125b对照组63.50±0.55a54.42±2.41a104.95±6.63a56.92±3.89amiR-125b抑制物组62.62±0.36ab34.28±3.06ab73.83±3.70ab72.59±3.42bF值13.95316.3379.12418.783P值<0.01<0.01<0.01<0.01 注:与各自的miR-125b拟似物组比较,aP<0.05;与各自的miR-125b对照组比较,bP<0.05(单因素方差分析,LSD-t检验) LECs:晶状体上皮细胞;T-AOC:总抗氧化能力;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;MDA:丙二醛;miR:微小RNA Note:Compared with respective miR-125b mimics group,aP<0.05;compared with respective miR-125b control group,bP<0.05 (One-way ANO-VA,LSD-t test) LECs:lens epithelial cells;T-AOC:total-antioxidative capability;SOD:superoxide dismutase;GSH-Px:glutathione peroxidase;MDA:malondialdehyde;miR:micro RNA
2.5 miR-125b靶基因预测
miR-125b靶基因预测发现,miR-125b与Nrf2保守位点有高分数结合,Nrf2为miR125b的一个潜在作用靶点。双荧光素酶报告系统结果显示,miR-125b拟似物刺激HELE3细胞中Nrf2-3’-UTR-WT报告基因的荧光素酶活性,而miR-125b抑制物抑制Nrf2-3’-UTR-WT报告基因的荧光素酶活性,差异有统计学意义(P<0.05),转染突变载体的细胞内未观察到明显的荧光素酶活性改变,提示Nrf2是miR-125b的直接靶向蛋白。miR-125b拟似物组细胞内Nrf2蛋白相对表达量高于miR-125b对照组,miR-125b抑制物组细胞内Nrf2蛋白相对表达量低于miR-125b对照组和miR-125b拟似物组,差异均有统计学意义(均P<0.05)(表3,图5)。200 μmol/L H2O2刺激后,Nrf2表达发生核转移,miR-125b拟似物组细胞质中Nrf2荧光染色最强,核转移也最显著,细胞质中Keap1的表达微弱;miR-125b抑制物组细胞质内Nrf2荧光较弱,核转移程度最弱,细胞质中Keap1的荧光最强(图6)。
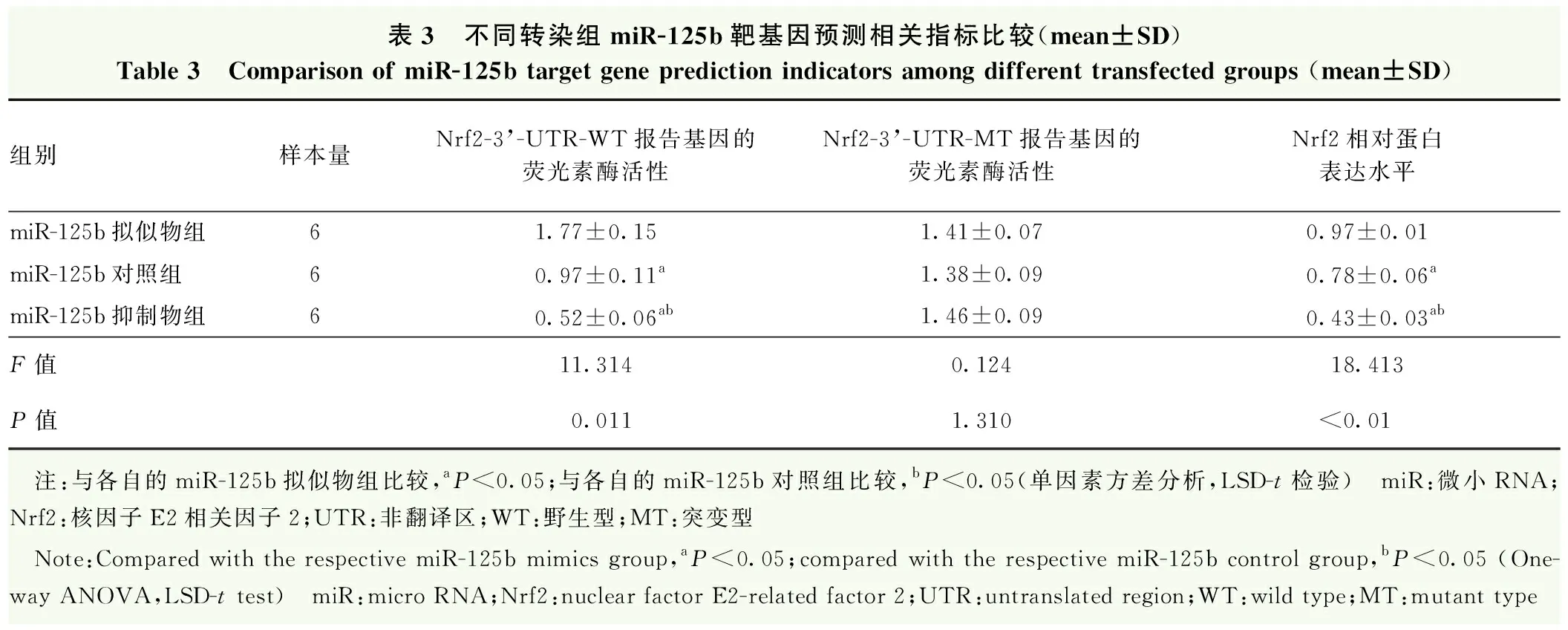
表3 不同转染组miR-125b靶基因预测相关指标比较(mean±SD)Table 3 Comparison of miR-125b target gene prediction indicators among different transfected groups (mean±SD)组别样本量Nrf2-3’-UTR-WT报告基因的荧光素酶活性Nrf2-3’-UTR-MT报告基因的荧光素酶活性Nrf2相对蛋白表达水平miR-125b拟似物组61.77±0.151.41±0.070.97±0.01miR-125b对照组60.97±0.11a1.38±0.090.78±0.06amiR-125b抑制物组60.52±0.06ab1.46±0.090.43±0.03abF值11.3140.12418.413P值0.0111.310<0.01 注:与各自的miR-125b拟似物组比较,aP<0.05;与各自的miR-125b对照组比较,bP<0.05(单因素方差分析,LSD-t检验) miR:微小RNA;Nrf2:核因子E2相关因子2;UTR:非翻译区;WT:野生型;MT:突变型 Note:Compared with the respective miR-125b mimics group,aP<0.05;compared with the respective miR-125b control group,bP<0.05 (One-way ANOVA,LSD-t test) miR:micro RNA;Nrf2:nuclear factor E2-related factor 2;UTR:untranslated region;WT:wild type;MT:mutant type

图5 miR-125b靶基因预测结果 A:生物信息软件检测Nrf2和miR-125b潜在结合位点,双荧光素酶报告基因实验检测Nrf2和miR-125b的直接关系 B:Western blot法检测不同转染组Nrf2蛋白表达 miR-125b抑制物组细胞中Nrf2蛋白表达条带弱于miR-125b对照组和miR-125b拟似物组 miR:微小RNA;Nrf2:核因子E2相关因子2;UTR:非翻译区;WT:野生型;MT:突变型;GAPDH:甘油醛-3-磷酸脱氢酶Figure 5 MiR-125b target gene prediction A:Bioinformatics software detected the binding sites of Nrf2 and miR-125b,and the double luciferase reporter gene assay showed a direct relationship between Nrf2 and miR-125b B:The expression intensity of Nrf2 protein in different transfected groups by Western blot assay The intensity of Nrf2 band was weakened in the miR-125b inhibitor group compared with the miR-125b control group and miR-125b mimics group miR:microRNA;Nrf2:nuclear factor E2-related factor 2;UTR:untranslated region;WT:wild type;MT:mutant type;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
3 讨论
氧化应激损伤指机体内源性或外源性ROS对细胞信号转导途径的综合损伤,或对细胞内核酸、蛋白质及其他重要因子的损伤[2-3,9]。研究发现,多种刺激因子产生的氧自由基介导的氧化损伤是导致白内障发生和发展的重要原因,白内障患者房水中H2O2浓度升高,介导早期氧化应激[10-11]。本研究用不同浓度的H2O2刺激HLEB-3细胞,成功建立氧化应激模型。近年来,miRNA在白内障中的作用越来越受到关注。miR-125b是近年来广泛研究的miRNA之一,与多种细胞的生物学活动密切相关,如多种癌细胞、成骨细胞等[12-15]。Li等[16]研究证实,miR-125b通过靶向p53诱导的核蛋白1促进非小细胞肺癌患者的肿瘤转移;Wu等[17]研究证实miR-125b通过靶向胃癌中的PPP1CA-Rb信号通路来促进细胞迁移和侵袭,导致预后不良;彭俊等[18]报道miR-125b可调控骨髓间充质干细胞成骨能力;也有研究报道miR-125b通过靶向Stat3调节单核细胞中降钙素的生成[19],但其对白内障晶状体细胞生物学行为是否有调控作用尚未见报道。本研究检测miR-125b在白内障晶状体前囊膜组织中的表达,发现miR-125b在发生白内障的晶状体前囊膜组织内的表达增加,经过H2O2刺激的HLEB-3细胞内miR-125b的表达随着H2O2浓度的升高而增加,提示miR-125b可能参与了白内障的发病过程。
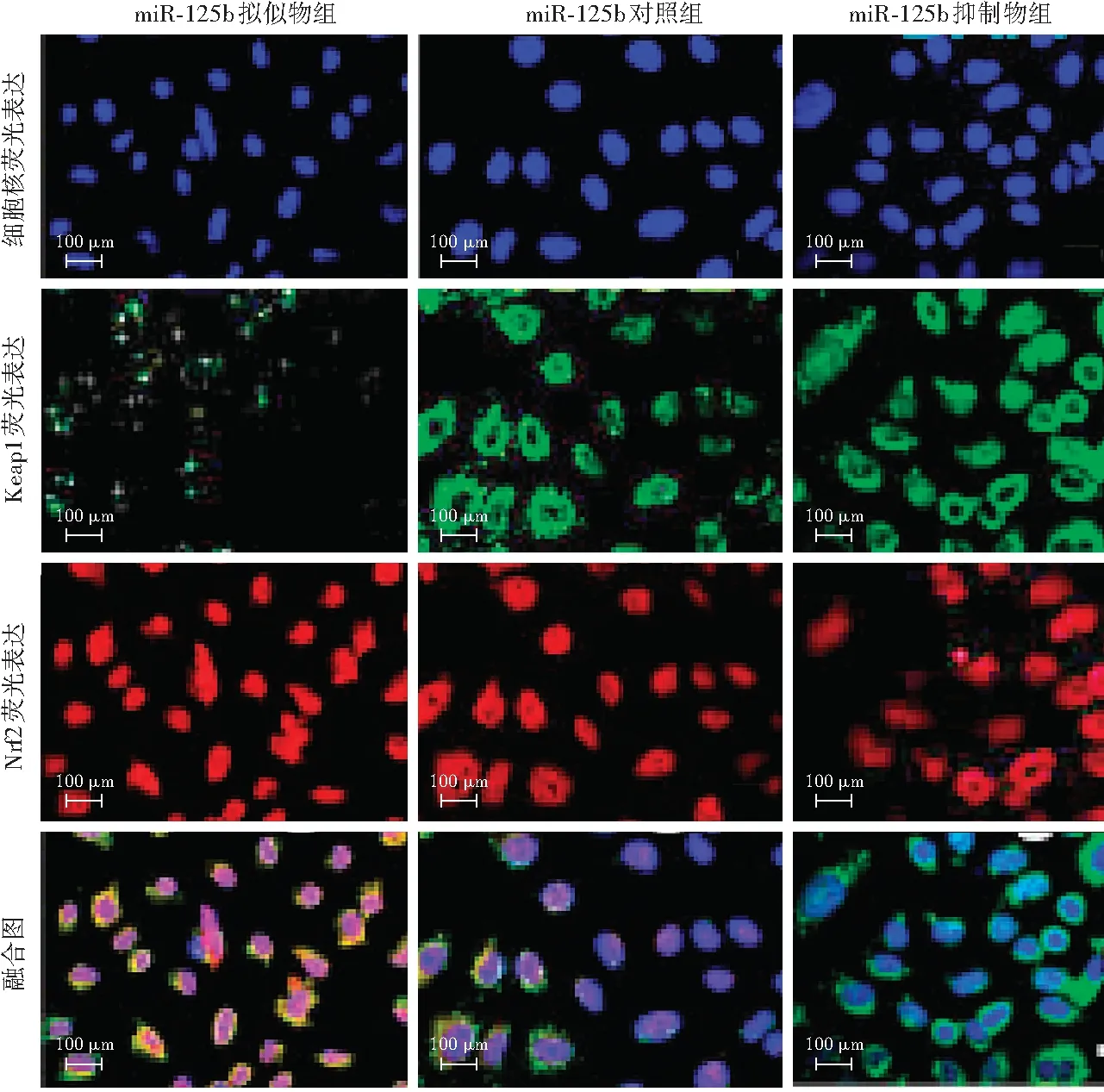
图6 免疫荧光双染色检测不同转染组LECs中Keap1、Nrf2的表达和定位(×600,标尺=100 μm) 免疫荧光双染色显示细胞质中Keap1反应呈绿色荧光,Nrf2反应呈红色荧光,细胞核呈蓝色荧光(DAPI) miR-125b拟似物组细胞质中Keap1荧光强度弱,Nrf2荧光强,存在大量核转移;miR-125b对照组细胞质中Keap1荧光稍强于miR-125b拟似物组,Nrf2荧光强度弱,存在少量核转移;miR-125b抑制物组Keap1荧光强,Nrf2荧光微弱 Keap1:Kelch样环氧氯丙烷相关蛋白-1;Nrf2:核因子E2相关因子2;miR:微小RNAFigure 6 Expression and localization of Keap1 and Nrf2 in lens epithelial cells in different transfected groups by immunofluorescence double staining (×600,bar=100 μm) The Keap1 presented green fluorescence and Nrf2 showed red fluorescence,and the nuclei displayed blue fluorescence.The fluorescence of Keap1 in the cytoplasm was weaker and Nrf2 was stronger in the miR-125b mimics group,indicating more nuclear metastases.In the miR-125b control group,the Keap1 fluorescence was slightly enhanced and Nrf2 was weakened in comparison with the miR-125b mimics group.Keap1 fluorescence was strong and Nrf2 was weakened in the miR-125b inhibitor group Keap1:kelch-like ECH-associated protein-1;Nrf2:nuclear factor E2-related factor 2;miR:micro RNA
生理状态下适量的ROS自由基对维持机体氧化平衡状态有重要意义,氧化应激条件下促氧化剂与抗氧化剂之间失衡,诱导LECs的线粒体损伤,ROS水平升高,导致细胞内脂质过氧化,产生大量MDA,SOD、T-AOC、GSH-Px是细胞内抗氧化酶,其活性降低会直接导致细胞内氧自由基积累[20-21]。本研究发现氧化应激模型细胞内ROS活性、MDA浓度均高于对照组,而SOD、T-AOC、GSH-Px的活性均显著下降,与预测结果一致。miR-125b在多种细胞的氧化应激过程中发挥调节作用。Wei等[7]报道miR-125b-5p在氧化应激下能保护内皮细胞免于凋亡;Liu等[8]研究证实人视网膜色素上皮细胞的氧化应激状态可刺激miR-125b的表达,从而缓解葡萄糖代谢异常。本研究中发现,在200 μmol/L H2O2的刺激下转染miR-125b拟似物组的细胞中SOD、T-AOC、GSH-Px活性较miR-125b对照组增加,ROS活性和MDA浓度降低,转染miR-125b抑制物组细胞中SOD、T-AOC、GSH-Px活性下调,ROS活性和MDA浓度均较高,说明miR-125b可能是通过缓解LECs的氧化应激损伤而参与白内障的发病过程。
Nrf2是调控细胞氧化应激损伤的关键性转录因子,生理状态下Nrf2与Keap1以复合体的形式存在于细胞质内,Nrf2处于非活性状态,当细胞受到氧化损伤信号刺激时,Nrf2被激活进入细胞核内,启动下游HO-1的转录,增强细胞抗氧化能力,该信号通路在细胞的氧化应激、抗凋亡过程中发挥重要作用[22-24]。李佳等[25]研究证实,Nrf2在人LECs中的高表达及核移位能增加抗氧化酶的含量,从而起到自身抗氧化损伤作用。为了进一步研究miR-125b调控LECs氧化应激损伤的作用机制,本研究用miRanda、TargetScan数据库筛选miR-125b下游靶向蛋白,发现miR-125b与Nrf2保守位点有高分数结合,Nrf2为miR-125b的一个潜在作用靶点。同时,在miR-125b拟似物组细胞内,Nrf2的表达高于miR-125b对照组,而Nrf2在miR-125b抑制物组细胞内的表达受到抑制。免疫荧光双染色检测发现,随着转染时间的增加,miR-125b拟似组细胞内Nrf2向细胞核转移,细胞质中Keap1的表达也随之减弱,而Nrf2核转移相对较弱的miR-125b抑制物组细胞质内Keap1的表达较强烈。
综上所述,本研究结果表明miR-125b能缓解年龄相关性白内障LECs氧化应激损伤,这种作用可能是通过靶向刺激Nrf2的表达、调控Keap1/Nrf2信号通路的活性而实现的。
利益冲突所有作者均声明不存在利益冲突
