miR-223-3p靶向NLRP3调控子痫前期胎盘中炎性反应的机制研究*
2021-05-12刘雪琼祝淡抹刘雅雯
刘雪琼,祝淡抹,杨 燕,刘雅雯,卢 丹**
[1.扬州大学临床医学院妇产科,扬州 225001;2.扬州大学医学院(转化医学研究院),扬州 225001;3.江苏省中西医结合老年病防治重点实验室,扬州 225001;4.大连医科大学第一临床学院,大连 116044]
子痫前期(preeclampsia,PE)是一种妊娠期特有的多器官、多系统损伤综合征。PE不仅是孕产妇和围产儿发生胎盘早剥、早产、胎儿宫内生长受限等疾病的主要原因[1],也是母体晚年心血管疾病风险增加的重要危险因素[2],影响全球约5%~8%的妊娠[1]。虽然PE是由多种因素引起的,但胎盘因素是PE发生的先决条件,其中胎盘炎症反应失调在PE的发病机制中起着至关重要的作用[3]。NLRP3炎性小体是介导先天免疫炎性反应的重要介质,参与动脉粥样硬化、2型糖尿病等多种疾病中炎性反应的调控[4]。已有研究表明,胎盘滋养细胞中的NLRP3炎性小体可以被内源性危险信号,如尿酸、三磷酸腺苷、活性氧等激活,促进IL-1β、IL-18的成熟和分泌,参与PE的发生与发展[5-6]。目前PE除了娩出胎盘,尚无有效治疗方法,所以寻找有效治疗PE胎盘炎症的方法迫在眉睫。microRNA-223-3p (miR-223-3p)是粒细胞分化和激活的重要调节因子[7],可通过靶向NLRP3抑制多种炎症性疾病中的炎性反应,如风湿性关节炎和克罗恩病[8-9]。然而,其在PE中的作用尚不清楚。本研究旨在探讨miR-223-3p能否通过靶向NLRP3抑制PE胎盘中的炎性反应,以期为PE的治疗找到一个新的潜在治疗策略。
1 资料与方法
1.1 研究对象 选取2018年12月至2020年1月在江苏省苏北人民医院住院分娩的60例孕妇,其中PE组30例(n=30),正常对照组30例(n=30)。PE诊断标准:妊娠20周后,新出现收缩压≥140mmHg和(或)舒张压≥90mmHg,伴有尿蛋白≥0.3g/24h,或随机尿蛋白≥(+),或虽无尿蛋白,但合并下列任何一项者:血小板减少、肝功能损害、肾功能损害、肺水肿或新发的中枢神经系统异常或视觉障碍。纳入标准:单胎妊娠,硬膜外麻醉剖宫产分娩,既往均无急慢性病史,无高血压、糖尿病、心脏病、内分泌代谢性疾病及肝肾病史,无风湿、类风湿、红斑狼疮等自身免疫相关疾病,无感染、炎症,除外妊娠不良结局(胎儿生长受限,早产)无其他妊娠合并症,无烟酒等不良嗜好。本研究经医院伦理委员会批准。所有来自患者的组织样本和数据信息在参与本研究前均获得了参与者的知情同意。
1.2 方法
1.2.1 样本采集和处理 胎盘娩出后5min内,无菌条件下取胎盘母体面中央近脐带处约1cm×1cm×1cm大小组织3份,同时避开梗死、钙化及出血等非正常区域。无菌生理盐水漂洗3次,其中两份分别放入装有RNA保护液和福尔马林固定液的容器中,4℃保存,另一份放入无菌冻存管,液氮保存,直至下一步使用。
1.2.2 细胞培养和处理 HEK-293T细胞由扬州大学非编码RNA转化医学实验室郁多男教授馈赠。HTR8/SVneo细胞来源于ATCC传代细胞,购自上海明州公司。在37℃、5%CO2、20%O2培养箱中,两种细胞系分别在含10%胎牛血清的DMEM和RPMI 1640培养基中培养。当细胞汇合度达90%时,将细胞进行传代。取对数生长期HTR8/SVneo细胞,按4×105细胞/孔接种于6孔培养板,置培养箱孵育24h后,待细胞生长状态良好,融合度为70%左右时,给予不同浓度LPS(0、50、100、200、500、1000ng/mL)处理细胞24h,诱导HTR8/SVneo细胞炎症模型。
1.2.3 细胞转染和处理 取对数生长期(第3~8代,融合度为80%~90%)的HEK-293T细胞,0.25%胰酶消化收集并计数,按2×105细胞/孔接种到24孔培养板,置培养箱孵育过夜。待细胞融合度为60%~70%且生长状态良好时,利用Lipofectamine 2000(Lipo 2000)进行转染。按转染说明书,提前1h将培养板中旧培养基更换为无血清培养基,按每孔1μg质粒+2μL Lipo 2000的比例,将转染复合物加至培养板孔,在培养箱中培养,6h后更换为完全培养基,48h后在荧光显微镜下观察转染效率,并进行下一步实验。将HTR8/SVneo细胞按4×105细胞/孔接种到6孔培养板,按每孔2.5μg miR-223-3p过表达质粒(或miR-223-3p阴性对照质粒)+5μL Lipo 2000的比例,将转染复合物加至培养板孔,置培养箱培养,转染48h后,加LPS(500ng/mL)处理24h,收集细胞和上清,提取RNA和蛋白供后续实验使用。
1.2.4 实时定量聚合酶链式反应(RT-qPCR) 使用Trizol试剂从胎盘组织(100mg/样本)或细胞中提取总RNA。选取A260/A280比值为1.8~2.0,且RNA完整度好的样品,分别使用PrimeScriptTMRT Master Mix和Mir-XTMmiRNA First-Strand Synthesis Kit试剂盒(Takara),将0.5μg RNA逆转录成cDNA。根据SYBR Green Mastermix试剂盒(Takara)操作说明将反应液混匀,在生物实时PCR系统上进行聚合酶链反应。U6和甘油醛-3-磷酸脱氢酶(GAPDH)作为内部参照。反应条件为初始变性:95℃ 30s,PCR反应:95℃ 5s,60℃ 60s,95℃ 10s,40个循环。引物序列由GenScript生物技术有限公司(江苏,南京)设计并合成,见表1。反应结束后,对结果进行熔解曲线分析,利用2-△△ct方法计算miR-223-3p和NLRP3相关基因相对表达量的倍数变化,公式如下:ΔΔCt =ΔCt实验组-ΔCt对照组,ΔCt=Ct(目标基因)- Ct(内部参照)。
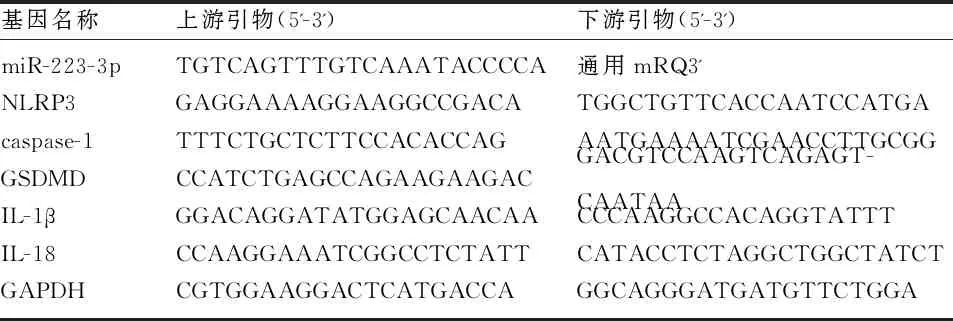
表1 RT-qPCR引物序列
1.2.5 蛋白免疫印迹分析(Western blot) 使用RIPA裂解液(Beyotime)(加PMSF蛋白酶、磷酸酶抑制剂)从胎盘组织和HTR-8/SVneo细胞中提取总蛋白,BCA检测试剂盒(Beyotime)测量蛋白浓度。将每孔30μg蛋白质样品加至10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)槽孔内,进行蛋白质分离。在200mA 90min条件下,将其湿转至PVDF膜。用5%脱脂牛奶室温封闭非特异性结合位点1h,4℃冰箱过夜孵育一抗NLRP3(1∶1000,ab214185,Abcam)、caspase-1(1∶500,ab62698,Abcam)、GSDMD(1∶500,sc-81868,Santa Cruz)、β-actin(1∶1000,AF0003,Beyotime)。第二天,使用TBST洗膜3次,于室温孵育辣根过氧化物酶标记二抗(1∶1000,A0208/A0216,Beyotime)1h。最后在ECL发光液的作用下,使用Bio-Rad凝胶成像系统检测免疫反应信号,采用image-pro-plus 6.0软件分析灰度值,计算相对蛋白水平。
1.2.6 免疫组织化学(IHC) 将胎盘组织包埋成蜡块,切成4μm厚切片,置于载玻片,65℃连续烘烤4h,用二甲苯脱蜡,梯度乙醇和蒸馏水脱水。将载玻片放入盛有0.01mol/L柠檬酸盐修复液(pH=6.0)的高压锅中进行水浴修复。按UItraSensitiveTMSP(小鼠/兔)免疫组化试剂盒(Kit-9720,MXB)说明书操作,其中孵育一抗NLRP3兔多克隆抗体的稀释比为1∶200。在组织上滴加二氨基联苯胺DAB染液显色,在显微镜下控制反应时间,适时终止反应。将载玻片用苏木精核复染,1%盐酸酒精分化,1%氨水返蓝,梯度乙醇脱水,二甲苯透明处理。最后用中性胶封膜,显微镜下读片。棕黄色颗粒沉淀为阳性蛋白表达区域。采用image-pro-plus 6.0软件分析每张图片的显色面积和光密度值,对阳性蛋白染色区域进行定量分析。
1.2.7 双荧光素酶报告基因实验 利用生物信息学网站Targetscan(http://www.targetscan.org/)、miRWalk (http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/)和miRBase(http://www.mirbase.org/index.shtml)预测miR-223-3p和NLRP3 3'-非翻译区(3'UTR)的潜在结合位点序列。合成NLRP3 3'UTR野生型(wt)和突变型(mut)结合位点基因片段,分别将其亚克隆到GV272碱性质粒载体,生成NLRP3-3'UTR-wt和NLRP3-3'UTR-mut荧光素酶载体。利用Lipo 2000将0.5μg萤火虫荧光素酶报告质粒、0.4μg miR-223-3p过表达质粒(或miR-223-3p阴性对照质粒)和0.1μg海肾荧光素酶质粒(内参)共同转染到生存状态良好的HEK-293T细胞中。转染48h后,收集细胞。按双荧光素酶检测试剂盒(Promega)说明书操作,并检测荧光素酶活性。结果用萤火虫和海肾荧光素酶的相对光单位比值表示。所有实验重复3次。
1.2.8 酶联免疫吸附试验 用无菌试管收集培养细胞上清,3000r/min离心20min,用ELISA试剂盒(JYM0083Hu,JYM0092Hu,武汉)检测炎症因子IL-1β、IL-18的分泌水平。测定各孔在450nm波长处的吸光度(OD值),以标准物质浓度为横坐标,OD值为纵坐标,绘制标准曲线。得到线性回归方程,线性回归与期望浓度的相关系数r值均在0.99以上。根据标准曲线计算炎症因子IL-1β、IL-18的浓度。所有实验重复3次。
2 结 果
2.1 研究人群的特征 PE孕妇和正常妊娠孕妇的年龄比较,差异无统计学意义(P>0.05)。PE孕妇的收缩压、舒张压、24h蛋白尿、体质量指数(body mass index,BMI)和尿酸均明显高于正常孕妇,而分娩孕周及新生儿出生体重明显低于正常孕妇,差异均有统计学意义(P<0.05)。见表2。
2.2 NLRP3在胎盘组织中的表达模式 RT-qPCR实验结果显示,与正常妊娠组相比,PE患者胎盘中NLRP3 mRNA表达明显上调,差异有统计学意义(P<0.05)(图1A)。Western blot实验结果显示,PE患者胎盘组织中NLRP3蛋白表达水平较正常对照组上调,差异有统计学意义(P<0.05)(图1B)。IHC结果显示,NLRP3阳性蛋白主要表达于胎盘的合胞体滋养层细胞、基质细胞、内皮细胞,呈淡黄色、棕色或棕褐色外观,且PE患者胎盘组织中NLRP3阳性蛋白表达水平明显高于正常妊娠组,差异有统计学意义(P<0.05)(图1C)。
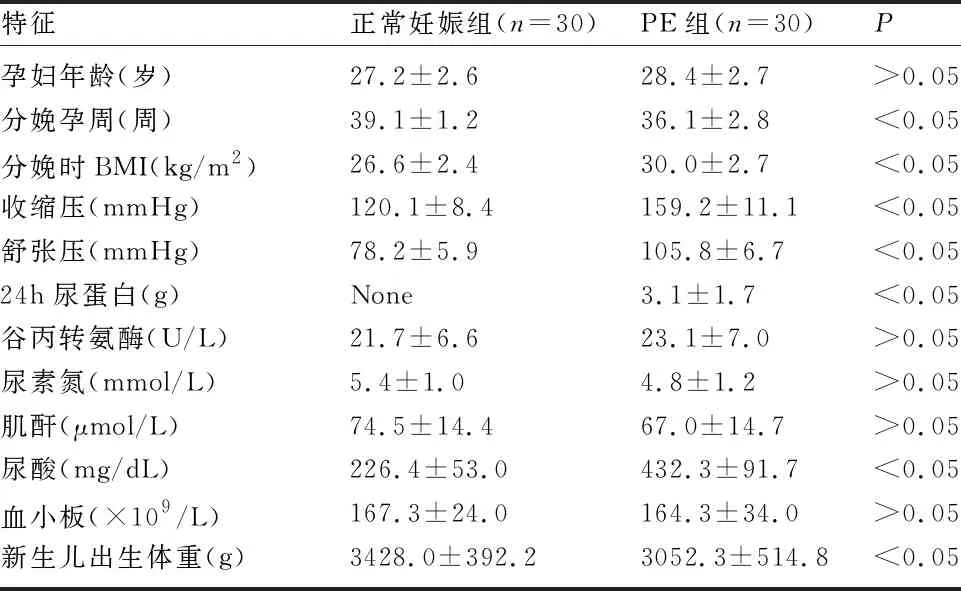
表2 研究人群的临床特征
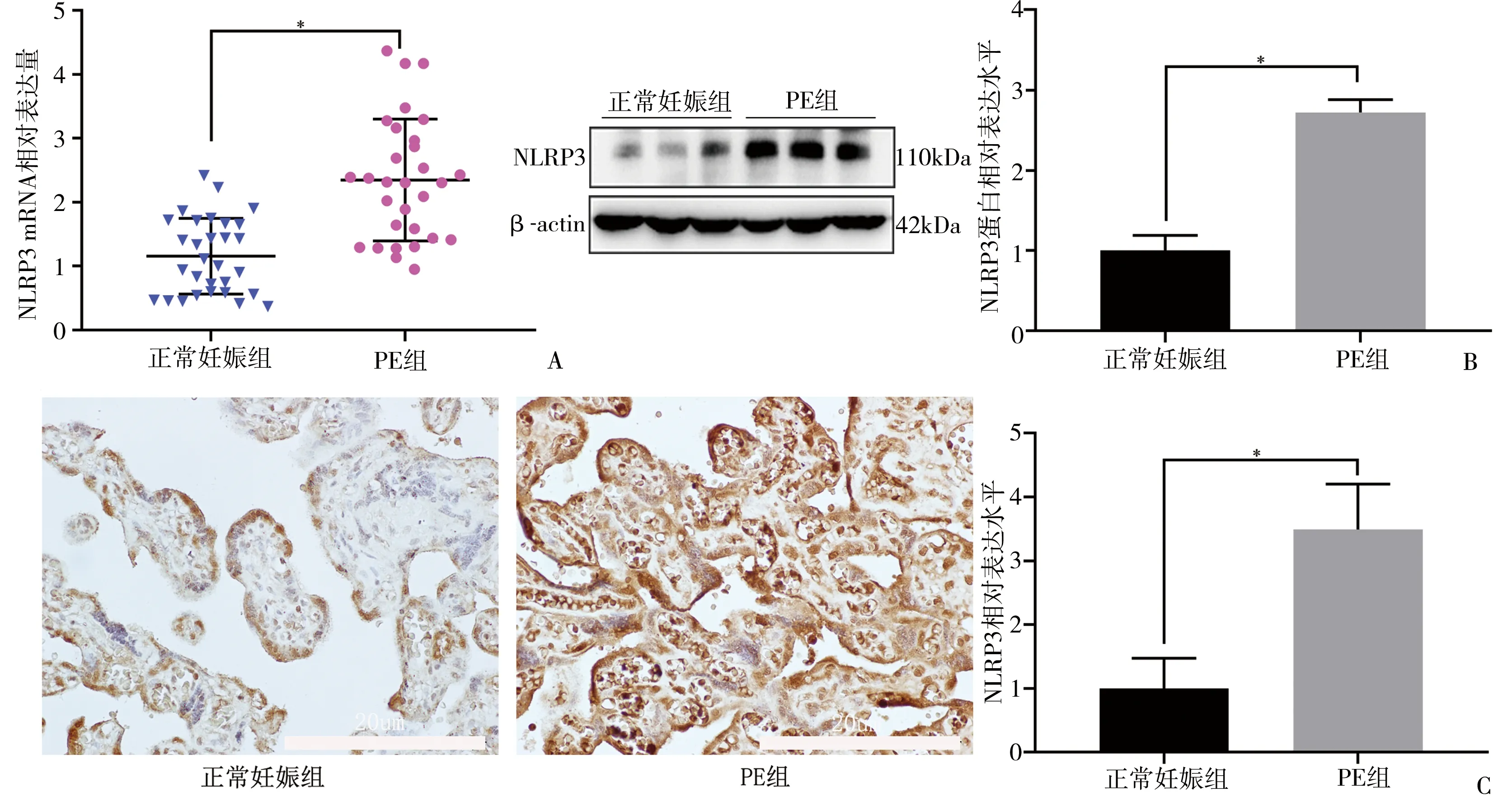
图1 NLRP3在胎盘组织中的表达模式
2.3 NLRP3与miR-223-3p的靶向关系及miR-223-3p在胎盘中的表达模式 生物信息学网站获得miR-223-3p与NLRP3 3'UTR的特异性结合位点序列(图2A)。经典的双荧光素酶报告基因实验结果显示,与转染阴性对照组相比,转染miR-223-3p过表达质粒到HEK-293T细胞中,能与细胞中NLRP3-3'UTR-wt质粒特异性结合,显著降低细胞的荧光素酶活性,差异有统计学意义(P<0.001);而miR-223-3p过表达质粒不能与NLRP3-3'UTR-mut相互作用,细胞的荧光素酶活性无明显变化(图2B)。RT-qPCR检测结果显示,PE胎盘组织中miR-223-3p表达水平较正常组显著下调,差异有统计学意义(P<0.05)(图2C)。
2.4 脂多糖(LPS)刺激HTR8/SVneo细胞构建PE胎盘炎症模型 不同浓度LPS(0、50、100、200、500、1000ng/mL)体外刺激HTR8/SVneo细胞24h后,RT-qPCR检测结果显示,与空白组(LPS为0ng/mL)相比,随着LPS浓度增加,HTR8/SVneo细胞中NLRP3、caspase-1、GSDMD、IL-1β、IL-18 mRNA表达水平均逐渐提高。当LPS为500ng/mL时,上述基因mRNA的表达水平升高最明显,差异有统计学意义(P<0.001)(图3A)。Western blot实验结果显示,NLRP3、caspase-1、GSDMD蛋白表达水平随着LPS浓度的增加明显升高,且LPS为500ng/mL时,升高最显著,差异有统计学意义(P<0.05)(图3B)。ELISA实验结果显示,HTR8/SVneo细胞中IL-1β和IL-18分泌水平逐渐增加,呈LPS浓度依赖型,同样当LPS为500ng/mL时最为显著,差异有统计学意义(P<0.01)(图3C)。
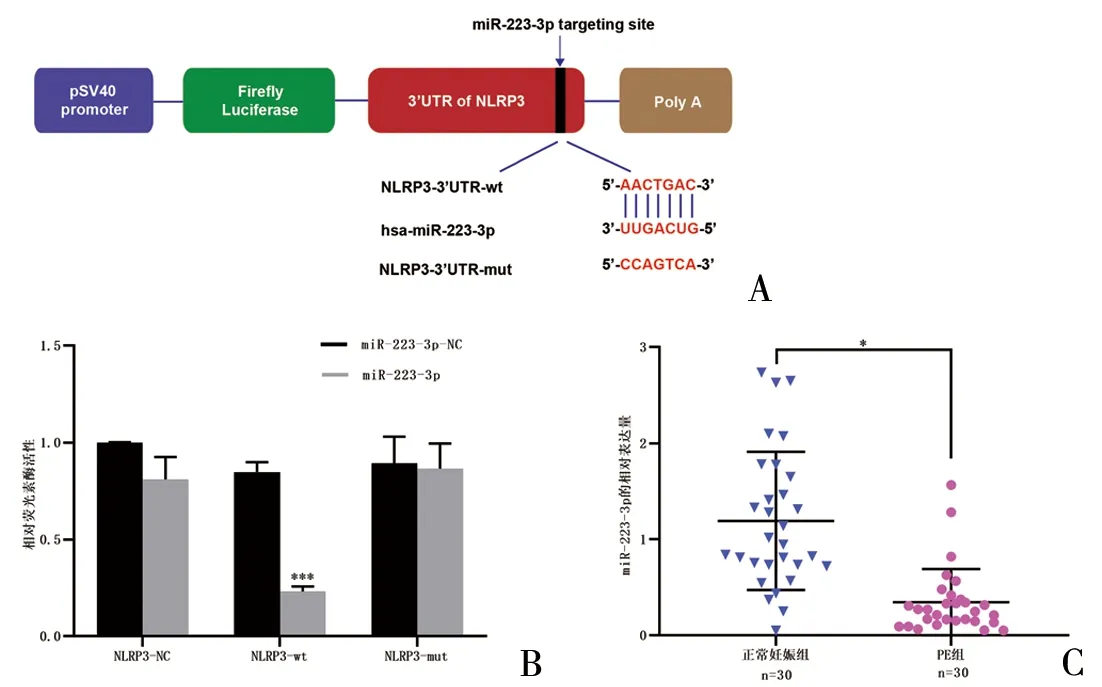
图2 NLRP3与miR-223-3p的靶向关系及miR-223-3p在胎盘中的表达模式
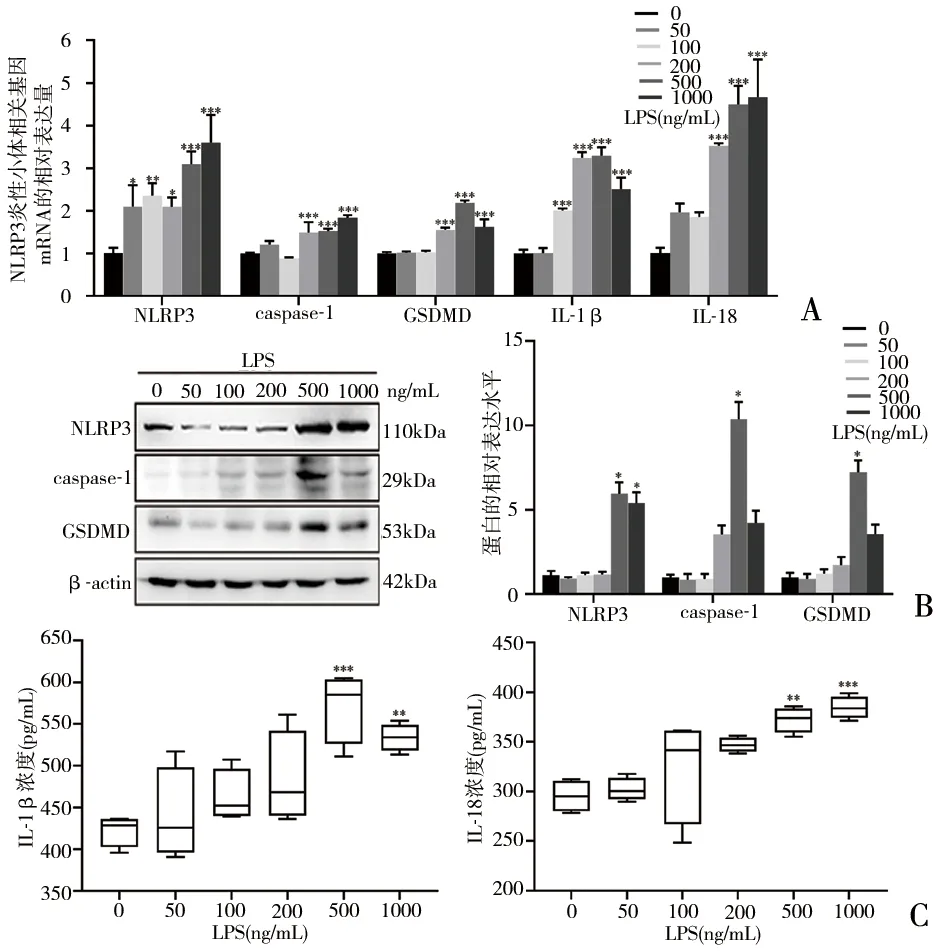
图3 不同浓度LPS体外刺激HTR8/SVneo细胞24h,NLRP3炎性小体相关基因及下游炎性因子的表达变化情况
2.5 PE炎症模型中miR-223-3p过表达对NLRP3的调控作用 RT-qPCR检测结果显示,与Blank组(未做任何处理的HTR8/SVneo细胞)相比,LPS诱导可降低HTR8/SVneo细胞中miR-223-3p表达水平,而转染miR-223-3p过表达质粒后,可显著提高HTR8/SVneo细胞中miR-223-3p表达水平,差异有统计学意义(P<0.001)(图4A)。RT-qPCR检测结果显示,LPS诱导HTR8/SVneo细胞高表达NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA(P<0.05),而转染miR-223-3p过表达质粒后,可明显降低上述基因mRNA表达,差异有统计学意义(P<0.05)(图4B)。Western blot结果显示,LPS可明显提高NLRP3、caspase-1、GSDMD蛋白表达(P<0.05),而转染miR-223-3p过表达质粒可显著抑制上述蛋白表达,差异有统计学意义(P<0.05)(图4C)。ELISA检测结果显示,LPS诱导可显著提高HTR8/SVneo细胞上清液中IL-1β、IL-18浓度(P<0.05),转染miR-223-3p过表达质粒可显著降低上述炎性因子的浓度,差异有统计学意义(P<0.05)(图4D)。
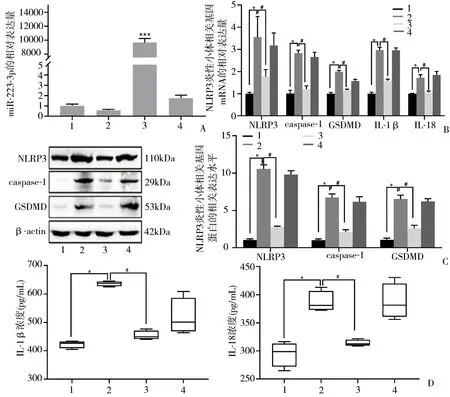
图4 miR-223-3p过表达对LPS诱导的NLRP3炎性小体相关基因及下游炎性因子的调控作用
3 讨 论
妊娠本身是一个轻度炎症反应的过程,但是母胎界面的炎症免疫失调会引起炎症因子的不平衡分泌,导致血管内皮损伤,绒毛外滋养细胞侵袭不足,引起PE的发生[10]。在炎症初期进行积极主动的药物干预可预防过度炎症反应的发生,从而阻止PE及其并发症的发生。目前针对PE尚无理想的治疗措施,因此寻找有效的抗炎抑制剂成为治疗PE的热点问题。
NLRP3炎性小体是由核心蛋白NLRP3、凋亡相关斑点样蛋白(ASC)和前半胱氨酸天冬氨酸特异性蛋白酶-1(pro-caspase-1)组成的细胞质内多蛋白复合物,参与多种炎性相关疾病的发病机制[4]。本文通过多种实验方法证实,核心蛋白NLRP3在PE胎盘中高表达,且主要表达于胎盘的滋养层细胞,这与Weel等[11]先前描述性的研究结果一致。胎盘滋养细胞中NLRP3炎性小体过度激活,不仅可提高胎盘中炎性因子IL-1β的分泌水平,引发母胎界面一系列炎症级联反应[12],还可通过活化的caspase-1溶解细胞上的GSDMD蛋白介导滋养细胞发生裂解死亡,即滋养细胞焦亡[13]。后者一方面阻碍滋养细胞侵袭、分化、发育,使得胎盘浅着床,血管重铸障碍;另一方面释放炎症因子入血,聚集其他免疫细胞,造成炎症反应过度激活和母体血管内皮细胞广泛损伤,进而导致PE的发生。此外,Xu等[14]报道特异性NLRP3基因多态性与PE风险显著增加密切相关。由此可见,母胎界面NLRP3的过度激活在PE的发病机制中起着至关重要的作用。大量体外和动物研究表明,NLRP3抑制剂可有效抑制炎症反应。但目前尚没有针对PE的特异性治疗药物,因此寻找有效的NLRP3抑制剂可能成为治疗PE的潜在靶点。
miR-223是一种与炎症和感染密切相关的microRNA[15],由miR-223-3p和miR-223-5p组成,其中只有前体miR-223的3臂端被认为是成熟和有功能的[16]。大量研究表明,miR-223是NLRP3的关键负调控因子,可通过特异性靶向NLRP3的3'UTR来降低多种疾病中的炎症反应。如miR-223在小鼠中性粒细胞中过表达可降低NLRP3炎性小体的活性,从而导致IL-1β的分泌减少[17];在脑出血后,miR-223可下调NLRP3以抑制炎症反应,减少脑水肿,改善神经功能[18]。有趣的是,microRNAs在新的一项研究中被表明可作为口服药物,在动物胃黏膜中直接被吸收利用,进而发挥转录后调节功能,抑制疾病的发生发展。如Chen等[19]研究发现,吸收植物MIR2911金银花汤可抑制SARS-CoV-2的复制,加速感染患者的负转化。因此,本研究的目的是探讨miR-223-3p能否作为PE炎症的抗炎保护剂,通过靶向NLRP3抑制PE的炎症反应。
本研究通过经典的双荧光素酶报告基因实验证实,NLRP3是miR-223-3p的一个直接靶基因。RT-qPCR实验结果显示,miR-223-3p在胎盘中表达丰富,但是与正常妊娠组相比,miR-223-3p在PE组中显著低表达。LPS是一种革兰氏阴性细菌内毒素,其脂质可诱导NLRP3炎性体介导的免疫应答[20]。超低剂量的LPS可诱导妊娠大鼠特异性持续炎症状态和PE样临床症状,如高血压、蛋白尿、血小板减少等[21]。本研究通过LPS刺激人绒毛外滋养细胞系HTR8/SVneo细胞,建立PE炎性细胞模型。实验结果显示,500ng/mL的LPS诱导24h后,可显著提高HTR8/SVneo细胞中炎性小体组分NLRP3、caspase-1和焦亡相关蛋白GSDMD的表达,以及下游炎性因子IL-1β和IL-18的分泌。而当炎症模型细胞中过表达miR-223-3p后,上述一系列基因的表达水平被明显抑制,表明miR-223-3p对LPS诱导的HTR8/SVneo细胞中NLRP3炎性小体的激活、细胞焦亡和炎性因子的分泌有一定的抑制作用。
综上所述,miR-223-3p可能通过靶向NLRP3抑制PE胎盘中的炎性反应和滋养细胞焦亡,提示miR-223-3p可能是PE胎盘炎症的潜在治疗靶点。然而,本研究仅限于NLRP3和miR-223-3p在胎盘中表达的描述性研究,在体外也只是初步探讨了miR-223-3p过表达对LPS诱导的细胞炎症模型中NLRP3炎性小体相关基因的部分调控机制,对于miR-223-3p与NLRP3炎性小体组配之间内在的紧密联系尚不清楚,这需要在将来的实验中进行更加深入的细胞实验和动物实验研究。此外,一个miRNA可同时靶向调控多个靶基因[22],因此miRNA治疗存在传递准确性和效率的挑战,这也是未来实验中需解决的难题。
