卵巢上皮癌复发后处理的研究进展*
2021-05-12李倩,李力
李 倩,李 力
(广西医科大学附属肿瘤医院妇瘤科暨区域性高发肿瘤早期防治研究教育部重点室验室,南宁 530021)
卵巢癌恶性程度高、复发率高、治疗难度大,已成为严重威胁妇女健康的恶性肿瘤[1]。70%以上卵巢癌为上皮性卵巢癌(epithelial ovarian cancer,EOC),初始治疗后大部分都能获得临床缓解[2],但易复发[3],5年生存率极低。铂敏感复发患者占60%,随着复发次数增多,无铂间隔期逐渐缩短,铂敏感复发最终发展为铂耐药/铂抵抗,复发后治疗已成为临床治疗的难点。近三十年,复发性卵巢癌(recurrent ovarian cancer,ROC)的治疗模式主要为手术+化疗两大模块。靶向药物的维持治疗改变了ROC的治疗策略,使得ROC治疗进入了“精准治疗时代”。目前ROC的治疗转变为手术+化疗+维持治疗的新模式,形成三驾马车的综合治疗模式。
1 卵巢上皮癌复发后的手术治疗
二次肿瘤细胞减灭术(secondary cytoreductive surgery,SCS)在复发性卵巢癌中的作用值得探讨。1983年Berek等[4]首次提出“二次肿瘤细胞减灭术”,此后基本形成共识[5],即铂敏感ROC患者可考虑行SCS。Takahashi等[6]研究显示,与单纯化疗相比,铂敏感ROC患者行SCS联合化疗的中位无进展生存期(median progression-free survival,mPFS)明显延长,但是两者的中位总生存期(median overall survival,mOS)无明显改善。Zang等[7]和Fan等[8]研究表明,铂敏感ROC患者中,实现SCS病灶无肉眼残留(RO切除)患者的预后最好,术中肿瘤残余病灶体积越大,患者预后越差。关于SCS的meta分析[9]也支持SCS在铂敏感ROC中应用。前瞻性大样本DESKTOP III研究[10],相比单纯二线化疗,SCS联合化疗给铂敏感ROC患者带来mPFS获益(19.6个月 vs 14.0个月,P<0.001),其OS最终数据尚未成熟。然而Coleman等[11]GOG-0213研究对SCS的价值提出了质疑,该研究与DESKTOP III研究设计类似,相比非手术组,手术组并未延长患者的mPFS和mOS,SCS联合化疗并未给患者带来生存获益。值得注意的是,该研究存在诸多混淆因素和偏倚:肿瘤体积相对较小、肿瘤负荷较小,患者对铂很敏感,中位无铂间隔期达20.4个月;高达84%的手术患者接受了贝伐珠单抗治疗和维持治疗,这些因素可能抵消了手术的作用。因此,DESKTOP III研究的最终结果OS显得尤为关键,如果证实了GOG-0213中OS的结论,SCS可能被放弃。
综上所述,二次手术在ROC治疗中存有许多争议。并非所有ROC患者都能从SCS中获益,需有效的评分系统筛选适合手术的患者。目前国际上已有的较为系统和成熟的评分系统有2个:(1)德国合作组在DESKTOP-I研究背景中提出AGO评分[12],初次手术没有病灶残留(R0)、复发时ECOG体能评分≤1以及CT没有腹水的情况为AGO阳性,其他情况为AGO阴性。(2)复旦中山团队提出的手术切除率预估模型iMODELSCR风险评分系统,见表1[13]。

表1 iMODELSCR风险评分系统

表2 ECOG评分
NCCN指南[14]推荐化疗结束后6~12个月复发患者,充分术前评估,对于孤立、局限病灶可完整切除达到RO且无腹水可考虑二次手术。目前正在开展的有关复发性卵巢癌二次手术临床研究有德国DESKTOP III研究(AOG评分)、中国SGOG的SOC-1研究(iMODEL风险评分),SCS价值亟待获得前瞻性随机对照的临床研究证实。
2 卵巢上皮癌复发后的全身化疗药物的使用
2.1 铂敏感ROC的化疗 对于铂敏感ROC患者的治疗,首先是术前评估是否适合行满意SCS(RO切除),再次是以铂类为基础的联合化疗±贝伐珠单抗(Bevacizumab,Bev)。已证实的有效方案包括:卡铂/紫杉醇/贝伐珠单抗[15]、卡铂/吉西他滨/贝伐珠单抗[16]、卡铂/紫杉醇[17]、卡铂/多西紫杉醇[18]、卡铂/吉西他滨[19]、卡铂/脂质体阿霉素[20]、顺铂/吉西他滨[21]、卡铂/白蛋白结合型紫杉醇(紫杉醇过敏者)。基于大型临床研究,NCCN指南[14]推荐抗血管生成药物贝伐珠单抗联合化疗用于铂敏感ROC患者。对于不能耐受联合治疗的铂类敏感型ROC患者,首选单药是卡铂、顺铂或奥沙利铂[22]。
2.2 铂耐药ROC的化疗 铂耐药/铂抵抗卵巢癌是目前临床中最棘手的问题。患者的治疗原则是以控制症状为主,减少不良反应和保证生活质量[23]。治疗手段是通过非铂类化疗药物、靶向药物等延长无铂治疗间隔恢复铂敏感性。非铂类单药化疗的客观缓解率(overall response rate,ORR)大致相近,包括紫杉醇周疗21%[24]、吉西他滨19%[25]、脂质体阿霉素26%[26]、拓扑替康20%[27]、口服依托泊苷19.2%。其他可能有效的药物包括异环磷酰胺12%、六甲蜜胺14%。可见,非铂单药化疗的ORR约20%。其中紫杉醇周疗和吉西他滨是基于随机对照试验基础上的标准治疗方案[28-29]。紫杉醇周疗方案对比紫杉醇三周疗的方案,前者的应答率和PFS优于后者[30]。脂质体阿霉素与拓扑替康进行了比较,前者显示出更好的毒性和更好的活性[31]。
3 卵巢上皮癌复发后靶向治疗
近几年,复发性卵巢癌靶向药物维持治疗相关研究取得很大进展,越来越多高效、低毒的分子靶向药物应用于临床,复发性卵巢癌患者进入了“靶向治疗新时代”。目前靶向药物有两类,一类是抗血管生成药物,另一类是二磷酸腺苷核糖多聚酶抑制剂(PARPi)。
3.1 抗血管生成药物 血管生成抑制剂通过阻断对肿瘤内新血管形成起到关键作用的促血管生成因子及其受体,进而达到抑制肿瘤生长、转移的作用。抗血管生成药物代表药为Bev。表3中OCEANS研究表明,相比传统的含铂双药化疗,化疗期间联合贝伐珠单抗,结束化疗后继续贝伐珠单抗维持治疗直至疾病进展的治疗模式改善了铂敏感ROC患者的mPFS和ORR,但PFS获益并未转化为mOS获益。GOG-0213研究与OCEANS研究类似,研究数据同样证明了抗血管药物联合含铂双药化疗给铂敏感ROC患者的mPFS和mOS带来一定程度的延长。AURELIA研究表明,在铂耐药ROC患者中,接受非铂单药(紫杉醇、拓扑替康或脂质体多柔比星)化疗或单药联合贝伐珠单抗化疗,相比单药化疗组,联合组延长了患者mPFS,但mOS并未得到改善。
总体而言,贝伐珠单抗的III期临床研究给铂敏感复发、铂耐药复发的患者带来生存获益。然而,这些临床试验是针对高度选择的患者和不同于现实临床实践环境的标准化条件而设计的,需真实世界的证据来进一步表明贝伐珠单抗的有效性和安全性。
3.2 PARPi单药靶向治疗 研究表明,PARP酶活性受抑制,同时BRCA基因突变会导致同源重组修复缺陷(homologous recombination repair,HRD),从而导致肿瘤细胞死亡[34-35]。从作用机理而言,HRD阳性的肿瘤细胞对铂类药物或PARPi更敏感,通过基因检测生物标记物来指导卵巢癌的靶向治疗。此外,除了关键性BRCA基因,其他HRR相关基因如PALB2、CDK12、RAD51等发生突变都会引起HRR,导致基因组不稳定[36]。目前,已获FDA批准用于复发性卵巢癌临床的PARPi主要有奥拉帕利、尼拉帕尼和鲁卡帕尼。
表4中多项大型临床研究证实,对于铂敏感复发性卵巢癌患者,二次减瘤术后化疗或直接化疗获得完全缓解(complete response,CR)或部分缓解(partial response,PR)后,均可从PARPi单药二线维持治疗中获益,实验组显著优于对照组。无论BRAC基因或HRD状态,PARPi均可为铂敏感ROC患者带来获益。其中,BRAC基因突变患者获益最明显,而HRD阳性受益优于HRD阴性,ROC患者可根据生物标记物指导治疗决策。由于尚无头对头的研究数据,不宜直接比较PARPi之间疗效。值得注意的是,维持治疗的前提条件是铂敏感复发患者含铂化疗达到CR/PR,而对于铂耐药复发患者达CR/PR后的维持治疗尚无循证学证据。此外,PARPi在携带BRCA突变/HRD患者中疗效更显著,而贝伐珠单抗则无相关的生物标记物以判断其敏感性,有待相关研究探索。
表5中研究表明PARPi单药在多线后铂耐药ROC中显示出良好的疗效,尤其是在BRCA基因突变型患者中ORR能超过传统非铂单药化疗的ORR(约20%左右),PARPi已批准用于后线卵巢癌单药治疗。而PARPi单药在BRCA野生型铂耐药ROC治疗中数据有限,这部分患者值得进一步研究。这些研究都是单臂研究,缺乏PARPi单药与临床标准治疗方案相比用于铂耐药ROC治疗的随机临床研究数据,两者疗效优劣有待进一步证实。

表3 贝伐珠单抗在ROC治疗中的疗效
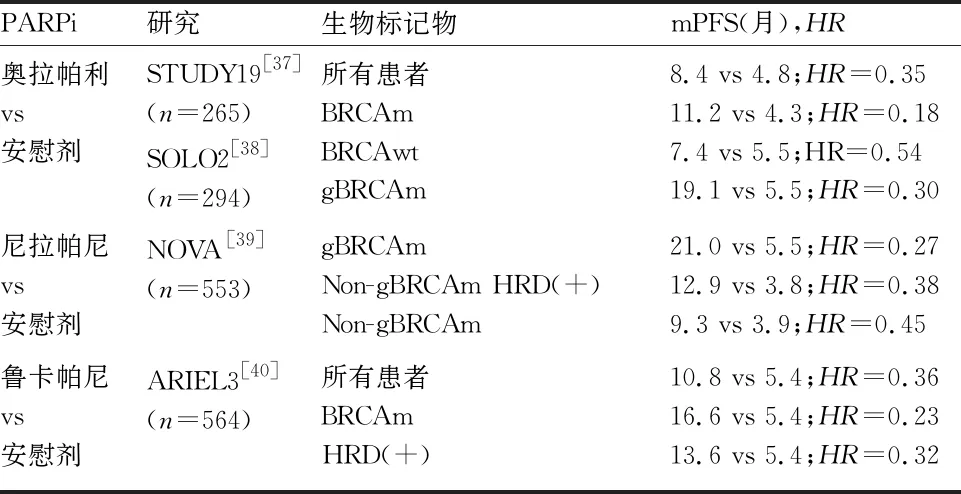
表4 PARPi单药在铂敏感ROC中的疗效

表5 PARPi单药在铂耐药ROC中的疗效
总之,基于上述大型临床研究,2020第1版NCCN指南[44]指出铂敏感复发后治疗达CR/PR,有3种选择,即可接受维持治疗,可参加临床试验,可观察。关于维持治疗,化疗时已用贝伐珠单抗者,可继续使用贝伐珠单抗,若考虑使用PARPi,需停用贝伐珠单抗;化疗时未用贝伐珠单抗者,可采用PARPi维持治疗。
3.3 去化疗模式 对于铂敏感复发卵巢癌的标准治疗是满意的再次减瘤术+含铂联合化疗+靶向药物维持治疗,提示患者在复发后,化疗结束达CR/PR后才能接受维持治疗,而临床上,部分患者不能耐受反复的化疗。因此,有部分学者提出去化疗的概念,以靶向药物替代化疗,在相同疗效下减少治疗的毒副作用,延长无铂使用的间歇,为铂再次使用创造条件。Mirza等[45]AVANOVA2研究显示,无论HRD状态,相比单药尼拉帕尼,尼拉帕尼联合贝伐珠单抗作为无化疗方案治疗铂敏感ROC患者可显著延长PFS(11.9个月vs 5.5个月,HR=0.35,95%CI为0.21~0.57,P<0.0001)。该研究结论有待III期临床试验证实。Penson等[46]SOLO3研究也采用了去化疗模式,该研究以非铂单药化疗(脂质体阿霉素、紫杉醇、吉西他滨和拓扑替康)作为对照,显示出单纯奥拉帕利对携带BRCAm的铂敏感ROC患者的显著疗效。对于临床上难以耐受化疗毒副作用的患者,可考虑选择PARP抑制剂单药。这两项研究设计均存在缺陷:(1)在铂敏感ROC患者中未设立含铂化疗+PARPi维持治疗对照组,尚且不能说明靶向药物去化疗模式是否优于已证实的标准治疗模式。(2)去化疗方案纳入均是铂敏感复发患者,没有涉及铂耐药患者,后者的研究更加重要。
目前,对于铂敏感复发卵巢癌患者,尚无直接证据证实靶向治疗能替代化疗,手术和化疗仍是复发性卵巢癌治疗的基础。免疫检查点抑制剂/PRAR抑制剂联合抗血管生成的无化疗方案是安全的、可耐受的,并可作为临床疗效的证据。期待更多高级别证据的临床试验结果,使得无化疗方案治疗复发性卵巢癌成为可能。
随着卵巢癌全程管理理念的发展,ROC患者维持治疗阶段相关不良反应(AEs)的管理显得至关重要。贝伐珠单抗主要AEs有高血压、蛋白尿、胃肠穿孔等。PARP抑制剂AEs主要包括血液学毒性和非血液学毒性,最常见的有恶心、呕吐、乏力和贫血等。对于1~2级AEs通常不需中断PARPi治疗。对于≥3级的严重AEs需减量甚至停用PARPi。对于体重<77kg患者,200mg剂量尼拉帕尼相比300mg剂量可降低ROC患者血小板减少的发生率[47]。当患者出现难以纠正的贫血、血小板减少时,可考虑PARP抑制剂诱发的造血系统肿瘤,应立即停用PARPi[48]。总体而言,AEs仍是可控可防。
4 免疫治疗
分子靶向治疗方兴未艾,免疫治疗又为ROC治疗开辟了新的方向。免疫治疗进展主要包括免疫单药治疗或免疫治疗联合PARPi。免疫检查点抑制剂作用靶点包括抗程序性细胞死亡蛋白-1(PD-1)、抗程序性细胞死亡配体-1(PD-L1)等。
Matulonis等[49]KEYNOTE-100研究显示,帕博利珠单抗单药用于ROC患者表现出了一定的活性,总人群中的ORR为8%,而传统的化疗药物治疗铂耐药ROC患者ORR约为20%。由此可见,单用免疫治疗ROC患者的疗效不佳。此外,该研究发现PD-L1 CPS≥10可作为疗效预测因子。而既往治疗线数和铂敏感程度与疗效无关。已有研究表明,单药PARPi对BRCA突变型且铂耐药ROC疗效甚好,ORR达25%~30%[50-51],对BRCA突变型且铂抵抗ROC的ORR有14%[41,52],而对BRCA野生型且铂耐药ROC的ORR仅有5%[53-54]。单药PD-1/PD-L1抑制剂在铂耐药ROC中ORR仅为10%[49]。早期临床试验提示PD-1抗体联合PARPi具有协同效应。总体来看,PD-L1抑制剂单药疗效甚微,免疫抑制剂联合PARP抑制剂治疗ROC将是一个新的研究方向。
TOPACIO研究[55]数据显示,在入组的62例铂耐药ROC患者中,PARP抑制剂尼拉帕尼联合抗PD-1单抗帕博利珠单抗治疗显示出疗效。该研究总体人群的ORR约为18%,该研究针对46例生物标记物选择患者的分析发现,联合疗法在BRCAm患者中的ORR约为29%(2/7),BRCAwt患者ORR约为26%(9/34),HRD(+)患者ORR约为27%(4/15),HRD(-)患者ORR约为29%(7/24),可见患者的疗效与生物标记物的状态无关,各亚型患者均可获益。该联合疗法比已有研究报道的单药尼拉帕尼或单药帕博利珠单抗治疗的活性要高。此项研究属于单臂试验,未设置非铂单药化疗对照组且样本量偏小易导致数据存在偏倚,需更大样本量的前瞻性试验进一步证实。
综上所述,PARP抑制剂联合免疫检查点抑制剂抗PD-L1抗体在铂耐药ROC患者中显示出显著疗效,联合用药疗效优于单药,联合用药治疗ROC将是未来的研究方向,需要更多大样本前瞻性研究进一步验证。
5 结语和展望
随着新药物的研发应用,卵巢癌的治疗将更加规范化、个体化和精准化。靶向药物维持治疗显著延长了卵巢癌患者复发时间,卵巢癌进入长期可控制的综合性慢病管理。Ⅱ期临床研究证实了PARP抑制剂联合抗血管生成药物的疗效,大规模的PARP抑制剂联合抗血管生成药和免疫治疗药物的Ⅲ期临床研究正在进行,这将为临床治疗提供更多思路。
