饲料中蛋白质水平对澳洲淡水龙虾生长、肉质及免疫力的影响
2021-05-12张宝龙曲木赵子续唐子鹏侯树旺翟胜利
张宝龙,曲木,赵子续,唐子鹏,侯树旺,翟胜利
(天津现代晨辉科技集团有限公司 天津市水族动物功能性饲料企业重点实验室,天津 301800)
澳洲淡水龙虾(Cherax quadricarinatus)是一种原产于澳大利亚外形酷似龙虾、个体较大的淡水养殖经济品种,因其营养丰富、肉质细腻滑脆、味道鲜美香甜、风味独特等优势成为目前世界上的名贵经济虾种之一[1]。王广军等人[2]发现澳洲淡水龙虾的出肉率及肌肉中所含的氨基酸及Ca、Fe等元素显著高于克氏原螯虾。目前,澳洲淡水龙虾在我国的养殖范围已经逐步扩大,在其养殖成本中,饲料占据将近50%。饲料中适当的蛋白含量对水产动物可以起到一定的促进作用,盲目升高蛋白含量会造成饲料成本的上升,对养殖动物的生长起抑制作用,同时也会加大养殖水体的环境负担;而饲料蛋白质含量过低,会使水产动物生长缓慢、抗病力差,进而延误生产时机[3]。因此,确定澳洲淡水龙虾饲料中适宜的蛋白水平对研制低成本、高营养澳洲淡水龙虾饲料具有一定的参考意义。
1 材料与方法
1.1 试剂与仪器
本试验所用指标测定试剂盒均购自南京建成生物工程研究所。
GZX-9070MBE电热恒温鼓风干燥箱,上海博迅实业有限公司;HH-2水浴锅,上海力辰仪器科技有限公司;HKL-220环模颗粒机,滕州三浓机械厂;JP-020超声波清洗器,深圳市洁盟清洗设备有限公司;JW-3021HR低温高速离心机,安徽嘉文仪器装备有限公司;WH-2微型旋涡混合仪,上海沪西分析仪器厂有限公司;FSH-2A可调高速均质机,青岛致仕工业技术有限公司;UV-1800紫外分光光度计,翱艺仪器(上海)有限公司;BSM电子分析天平,上海卓精电子科技有限公司;SKY全波长酶标仪,Thermo。
1.2 饲料配方
以全虾粉10.00%、豆粕23.00%、啤酒酵母4.00%、花生粕8.00%、豆油1.50%、鱼油1.50%、大豆卵磷脂0.50%、胆固醇0.50%、膨润土1.00%、乳酸钙2.00%、粘合剂0.50%、氯化胆碱0.50%、1.00%虾用预混料1.00%、4.00%虾用预混料4.00%为不变量,通过改变鱼粉、面粉、苜蓿草粉、细麸皮、米糠的含量来配置蛋白含量(CP%)分别为29.48%、30.50%、32.61%、34.64%、36.70%、38.75%、40.80%的饲料配方(表1),用制粒机制成配合饲料,在阴凉干燥处风干后,测定其营养成分。
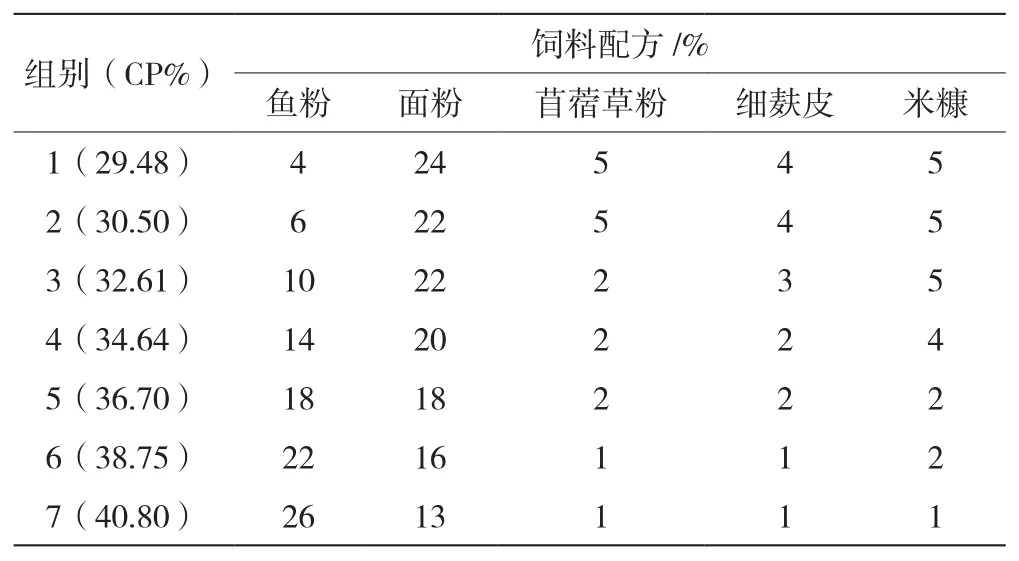
表1 不同蛋白含量的饲料配方及饲料营养成分
1.3 试验材料与养殖管理
试验所用虾购自苏州傲龙生态水产养殖有限公司,每个处理3个平行,每个平行放置70尾虾,试验虾养殖于水泥池中(水泥池面积2 m×2 m)。试验初期,称其总重,选择20尾虾测定其腹长、全长、体长、体宽、体重、螯足长等指标。每天记录投喂量用于生长指标计算。每隔3 d测定1次水质,养殖过程中水体氨氮含量≤0.1 mg/L,亚硝酸盐含量≤0.2 mg/L,溶解氧含量为10 mg/L,pH为8.4,总硬度为120 mg/L。
1.4 指标测定
1.4.1 样品采集
养殖试验结束后,每个池子分别取15尾虾,取其血浆,保存于2 mL离心管中,之后取其肝胰脏、肌肉组织,将组织(g)、0.85%生理盐水(mL)按1∶4的比例用匀浆机(FSH-2A)匀浆,之后在4 ℃、4 000 r/min条件下离心15 min,然后取上清制成20%匀浆液,保存于-20 ℃冰箱中待测。
1.4.2 指标测定
1.4.2.1 生长指标测定
分别于养殖初始和养殖56 d用数显游标卡尺和直尺测定龙虾的腹长、全长、体长、体宽及螯足长,并根据公式(1)~(4)计算增重率(WGR)、特定生长率(SGR)、饵料系数(FCR)以及蛋白质效率(PER)。

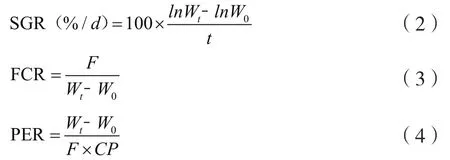
式(1)~(4)中,Wt为最终体重,g;W0为初始体重,g;t为试验天数,d;F为饲料摄入量干重,g;CP为饲料粗蛋白质含量,%。
1.4.2.2 肉质测定
(1)肌肉滴水损失率测定
取澳洲淡水龙虾肌肉,干纱布擦干表面水分,称重记录,放于10 mL离心管中,离心管底部放有适当的吸水纸,在4 ℃、4 000 r/min条件下离心20 min后取出,擦干背肌表面水分,称重记录,并根据公式(5)计算滴水损失率(DL)。

(2)肌肉蒸煮损失率测定
取澳洲淡水龙虾肌肉,干纱布擦干表面水分,称重记录,装入密封袋中,放入70 ℃的恒温水浴锅中蒸煮15 min,取出冷却至室温,擦干背部肌肉表面水分,称重记录,根据公式(6)计算蒸煮损失率(CL)。

(3)水分
剪取澳洲淡水龙虾肌肉1 g左右,用吸水纸吸干表面水分,将肌肉放入水分皿中,于60 ℃电热鼓风干燥箱中烘干至恒重,根据公式(7)计算水分含量。

式(7)中,M1为烘干前水分皿及肌肉总质量,g;M2为烘干后水分皿及肌肉总质量,g;M0:水分皿质量,g。
(4)总氨基酸含量测定
肌肉总氨基酸含量采用南京建成生物工程研究所的试剂盒测定。
1.4.2.3 免疫指标测定
养殖试验结束后,测定澳洲淡水龙虾血浆及组织中酸性磷酸酶(Acid Phosphatase,ACP)、过氧化氢酶(Catalase,CAT)、谷草转氨酶(Glutamic Oxalacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-Pyruvic Transaminase,GPT)、谷胱甘肽过氧化物酶(Glutathion Peroxidase,GSH-PX)、谷胱甘肽-S转移酶(Glutathione S-Transferase,GSHST)、超氧化物歧化酶(Superoxide Dismutase,SOD)的酶活以及丙二醛(Malondialdehyde,MDA)含量、总抗氧化能力(Total Antioxidant Capacity,T-AOC)。血浆室温融化后直接测定,组织根据试剂盒需要在20%匀浆液基础上进行稀释。
2 结果与分析
2.1 饲料蛋白水平对生长性能的影响
由表2可知,澳洲淡水龙虾的增重率及特定生长率在饲料蛋白质含量为34.64%时最高且显著高于其他各组(P<0.05);蛋白质效率随饲料蛋白质水平的提高呈先上升后下降的趋势,最大值仍出现在34.64%水平组,与29.48%、32.61%两组差异不显著(P>0.05);饵料系数变化趋势与其他生长指标相反,呈先下降后上升趋势,最低值出现在34.64%水平组,与29.48%、32.61%、40.80%三组无显著差异(P>0.05)。
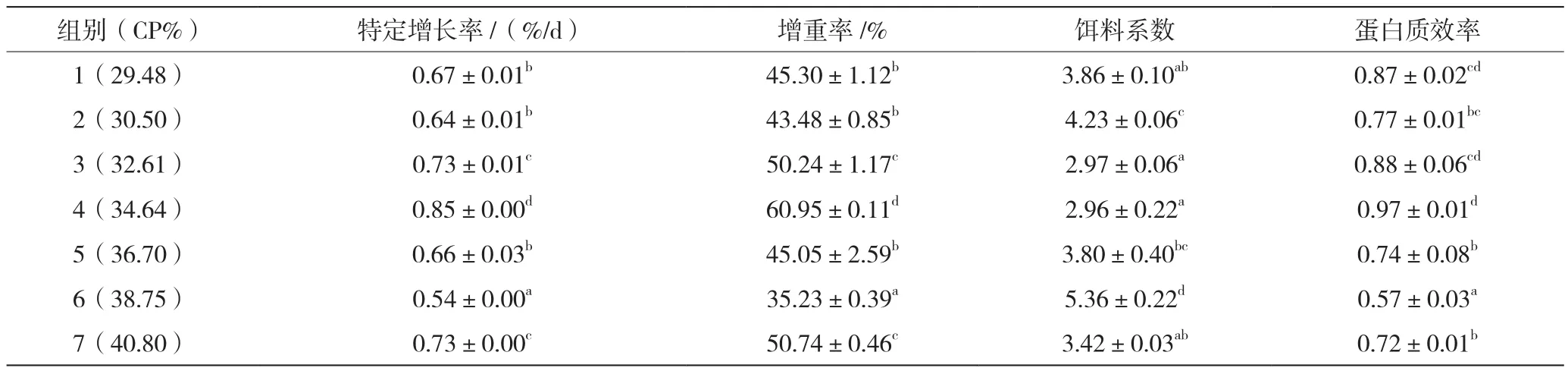
表2 饲料蛋白水平对澳洲淡水龙虾生长性能的影响
由表3可知,不同饲料蛋白质水平下,澳洲淡水龙虾的体长及腰宽无显著变化(P>0.05);全长、螯长最大值均出现在34.64%蛋白组,分别显著高于30.50%、38.75%蛋白组(P<0.05),但与其他各组无显著差异(P>0.05);腹长最大值出现在34.64%蛋白组,显著高于30.50%、38.75%蛋白组(P<0.05);澳洲淡水龙虾体重在饲料蛋白含量为34.64%时最高,且显著高于其他蛋白组(P<0.05)。

表3 饲料蛋白水平对澳洲淡水龙虾形体指标的影响
2.2 饲料蛋白水平对肌肉成分及出肉率的影响
由下表知:饲料蛋白水平对澳洲淡水龙虾肌肉蒸煮损失率无显著影响(P>0.05),最低值出现在34.64%蛋白组,且在同组,肌肉滴水损失率也达到最低,显著低于29.48%蛋白组(P<0.05)。肌肉水分在34.64%蛋白组最低,与30.50%、36.70%、38.75%蛋白组差异不显著(P>0.05),但显著低于其他组(P<0.05);出肉率及肌肉中总氨基酸含量最大值均出现在34.64%蛋白组,与32.61%蛋白组没有显著差异(P>0.05)。
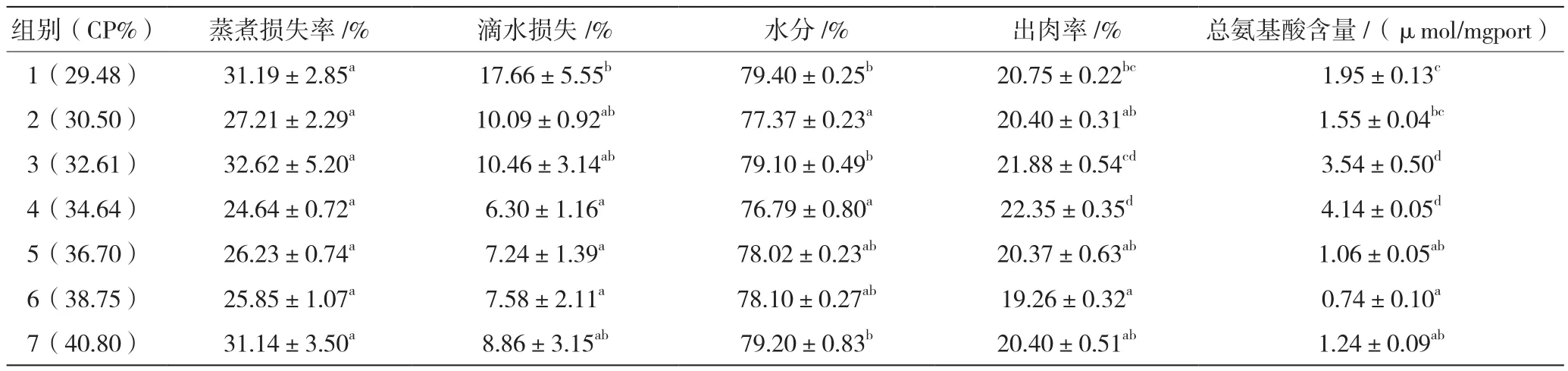
表4 饲料蛋白水平对淡水澳洲龙虾肉质及出肉率的影响
2.3 饲料蛋白水平对组织和血浆中免疫力的影响
2.3.1 ACP活性
由表5可知,澳洲淡水龙虾组织及血浆中ACP活性最小值均出现在34.64%蛋白组。肌肉中34.64%蛋白组与29.48%、30.50%、32.61%蛋白组无显著差异(P>0.05),但显著低于其他组(P<0.05);肝脏中34.64%蛋白组显著低于其他各组(P<0.05);血浆中34.64%蛋白组与29.48%、32.61%蛋白组差异不显著(P>0.05)。

表5 饲料蛋白水平对澳洲淡水龙虾组织和血浆中ACP活性的影响
2.3.2 CAT活性
由表6可知,澳洲淡水龙虾组织及血浆中CAT活性随饲料蛋白质含量的上升呈先升高再降低趋势,最大值出现在34.64%蛋白组。肌肉中34.64%蛋白组与32.61%蛋白组差异不显著(P>0.05),但显著高于其他组(P<0.05);肝脏、血浆中34.64%蛋白组显著高于其他组(P<0.05)。

表6 饲料蛋白水平对澳洲淡水龙虾组织和血浆中CAT活性的影响
2.3.3 GOT、GPT活性
由表7可知,澳洲淡水龙虾组织及血浆中GOT、GPT活性最小值均出现在34.64%蛋白组。肝脏中34.64%蛋白组GOT、GPT活性均显著低于36.70%、38.75%蛋白组(P<0.05),但与其他组无显著差异(P>0.05)。血浆中34.64%蛋白组GOT活性与29.48%、30.50%、32.61%蛋白组差异不显著(P>0.05),GPT活性与29.48%、36.70%、38.75%蛋白质组无显著差异(P>0.05),但显著低于其他各组(P<0.05)。

表7 饲料蛋白水平对澳洲淡水龙虾组织和血浆中GOT、GPT活性的影响
2.3.4 GSH-PX活性
由表8可知,34.64%蛋白组澳洲淡水龙虾肌肉及肝脏中GSH-PX与32.61%蛋白组差异不显著(P>0.05);血浆中34.64%蛋白组与32.61%、29.48%蛋白组差异不显著(P>0.05),但显著高于其他组(P<0.05)。
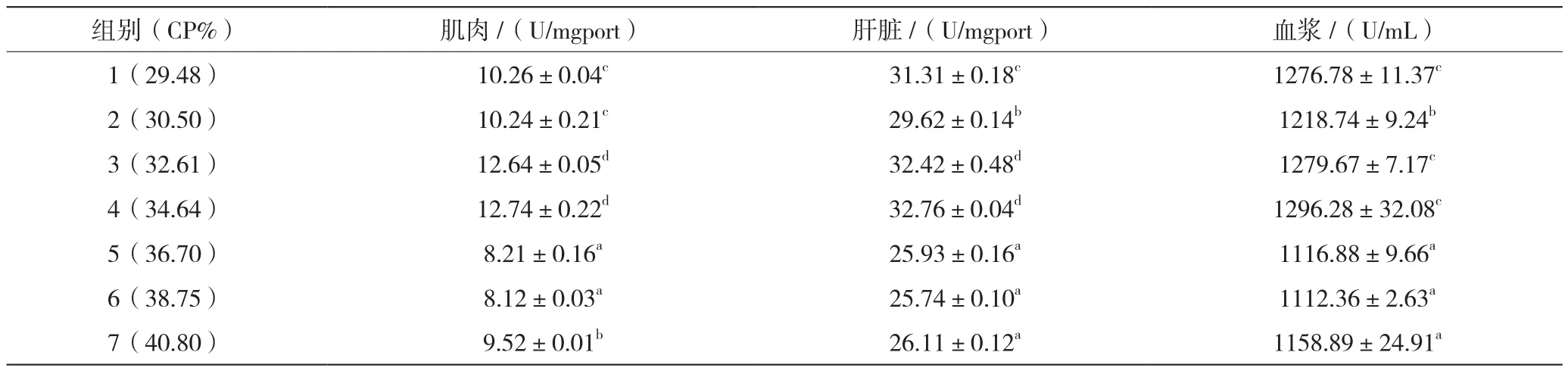
表8 饲料蛋白水平对澳洲淡水龙虾组织和血浆中GSH-PX活性的影响
2.3.5 GSH-ST活性
由表9可知,澳洲淡水龙虾组织和血浆中GSH-ST最大值出现在34.64%蛋白组。肌肉及肝脏中34.64%蛋白组与36.70%蛋白组差异不显著(P>0.05),但显著高于其他组(P<0.05)。饲料蛋白水平的变化对血浆中GSH-ST活性无显著影响(P>0.05)。

表9 饲料蛋白水平对澳洲淡水龙虾组织和血浆中GSH-ST活性的影响
2.3.6 MDA含量
由表10可知,澳洲淡水龙虾组织和血浆中MDA最小值出现在34.64%蛋白组。肌肉中34.64%蛋白组显著低于其他组(P<0.05)。肝脏中34.64%蛋白组与32.61%蛋白组差异不显著(P>0.05),但显著低于其他组(P<0.05)。血浆中34.64%蛋白组显著低于其他组(P<0.05)。

表10 饲料蛋白水平对澳洲淡水龙虾组织和血浆中MDA含量的影响
2.3.7 SOD活性
由表11可知,澳洲淡水龙虾肌肉中34.64%蛋白组SOD活性显著高于其他各组(P<0.05);肝脏中34.64%蛋白组与29.48%、32.61%蛋白组无显著差异(P>0.05);血浆中34.64%蛋白组显著高于36.70%、38.75%组(P<0.05),与其他饲料组差异不显著(P>0.05)。
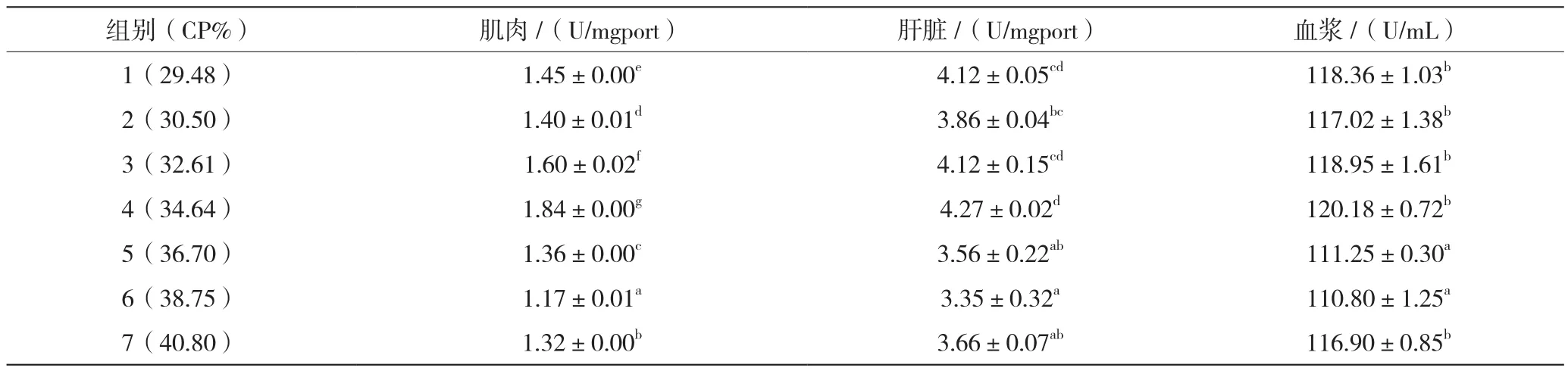
表11 饲料蛋白水平对澳洲淡水龙虾组织和血浆中SOD活性的影响
2.3.8 T-AOC含量
由表12可知,澳洲淡水龙虾肌肉、肝脏及血浆中T-AOC最大值均出现在34.64%蛋白组,32.61%蛋白组无显著差异(P>0.05),但显著高于其他饲料组组(P<0.05)。

表12 饲料蛋白水平对澳洲淡水龙虾组织和血浆中T-AOC的影响
2.4 讨论
2.4.1 饲料蛋白水平对澳洲淡水龙虾生长性能的影响
生长性能是衡量经济水产动物可获得价值的重要指标,本试验测定了澳洲淡水龙虾生长指标及体长、体宽等形体指标,发现饲料蛋白水平会显著影响其生长,当蛋白含量为34.64%时生长指标达到最佳,这与张佳润等人[4]和姜松等人[5]对斑节对虾及苟妮娜等人[6]对淡水养殖凡纳滨对虾的研究结果一致。刘永涛等[7]研究发现在稻田养虾模式下用添加复方黄芪多糖蛋白质含量≥26%的饲料投喂克氏原螯虾可得到较好的促生长效果。卢耀鹏等[8]研究发现红螯螯虾幼虾饲料最适宜的蛋白质水平为36.98%。索帅等[9]研究发现脊尾白虾饲料蛋白水平为39%、脂肪水平为5%时相对增重率较高,且饵料系数最低,这与本试验结果略有不同,可能是因为虾的规格不同导致,幼虾时期需要较高的蛋白含量来供给自身营养需求,但饲料蛋白水平的升高会提升虾的生长性能这点结论是一致的。
2.4.2 饲料蛋白水平对澳洲淡水龙虾肉质的影响
滴水损失率、蒸煮损失率及总氨基酸含量是衡量可食动物肉质是否鲜嫩、风味好坏的重要指标,出肉率可用来衡量其经济价值。凌俊等[10]认为饲料的蛋白水平对克氏原螯虾的出肉率没有显著性影响,倪静静等[11]比较了不同的饲料对克氏原螯虾肉质的影响,结果发现不同的饲料对其出肉率和滴水损失率有显著影响,但对蒸煮损失率没有显著影响。本试验结果表明,饲料蛋白含量为34.64%时澳洲淡水龙虾的蒸煮损失率、滴水损失率和肌肉水分显著降低,出肉率最高,这与吴东等[12]研究结果相似。
2.4.3 饲料蛋白水平对澳洲淡水龙虾免疫力的影响
本试验测定了澳洲淡水龙虾SOD、CAT、MDA、T-AOC、GOT、GPT、ACP、GSH-PX、GSH-ST 九个免疫相关指标,结果表明饲料蛋白水平在34.64%时各组织及血浆中SOD、CAT、T-AOC、GSH-PX、GSH-ST活性显著升高,而MDA含量及GOT、GPT、ACP活性有所降低。范陈伟等[13]对脊尾白虾的研究结果表明,在水泥池养殖条件下饲喂34%蛋白水平饲料的白虾GOT活力最低而SOD的活力显著升高,范斌[14]研究发现日本沼虾的SOD、CAT活性随所投喂的饲料蛋白含量的升高而上升,最适蛋白水平为48%。这与本研究结果基本相同,但目前针对饲料蛋白水平对虾类免疫力影响的研究较少,其更多作用机理仍需进一步研究。
3 结论
综合澳洲淡水龙虾生长、肉质及免疫相关指标,水泥池养殖澳洲淡水龙虾(养殖密度为17.5尾/m2)时,饲料中最适宜的蛋白水平为34.64%。
