黄粉虫及其肠道微生物降解PVC塑料的研究
2021-05-12杨爱玉徐健全
杨爱玉,徐健全
(江西现代职业技术学院,江西南昌 330095)
石油化工生产的塑料废物污染是世界环境难题[1],大部分塑料一次性使用后即被丢弃。塑料产品物理和化学结构稳定,其在自然环境里可能数十年甚至数百年不会被分解[2-3],并形成“白色污染”威胁生态环境[4-6]。目前,处理废弃塑料的主要方法有填埋法、焚烧法、化学处理法等。采用传统生活垃圾填埋技术治理白色污染,由于非降解塑料为惰性结构,掩埋地下很难被生物降解,不仅影响土壤结构,还具有污染地下水、投资大、运行费用高、占地面积大等缺点;而废弃塑料焚烧法虽然彻底,但是对大气造成了严重污染;塑料的化学分解技术是在溶剂和催化剂存在的条件下,使高分子聚合物分解为单体进行回收利用,其费用高并会产生二次污染[7]。
黄粉虫幼虫目前用于动物饲料、食品加工、医药保健品以及抗菌蛋白等,此外在环保中发挥一定作用。Yang等人[8-9]的研究发现,100只黄粉虫幼虫每天可以吃掉34~39 mg的泡沫塑料,并将塑料转变为供其生长所需的脂肪和CO2。在此过程中,幼虫体内的肠道微生物发挥了主导作用。Yang等人[9]从其肠道内分离出的一株微小杆菌在60 d内可降解7.4%±0.4%的塑料,Gilan等人[10]分离出能够降解聚苯乙烯塑料的菌株C208,其降解率可达8%。利用黄粉虫肠道微生物对白色污染进行治理的生物降解法,是利用由生长在塑料表面或内部的微生物新陈代谢作用,其降解过程能耗低,降解产物为生物体自然代谢产物,不会造成二次污染,可以有效避免传统的填埋法、焚烧法、化学处理法等的缺点,是一种绿色环保的“白色污染”处理工艺。本研究通过喂食黄粉虫PVC塑料及对其肠道微生物进行选择性培养,探究黄粉虫对PVC塑料的降解能力及其肠道中能代谢PVC塑料的微生物,为进一步利用生物法降解PVC塑料作初步尝试。
1 材料与方法
1.1 样品来源
黄粉虫(Tenebrio molitor)幼虫购于千花伴花鸟市场,幼虫体长20~25 mm。PVC塑料膜为塑洋牌,临沂市奔多包装有限公司。
1.2 试剂和仪器
蛋白胨、酵母膏、琼脂、NaCl、KH2PO4、ZnSO4·7H2O、K2HPO4、FeSO4·7H2O、MgSO4·7H2O、MnSO4·H2O、NH4NO3,化学纯,天津致远化学试剂有限公司。
H2P-250恒温震荡培养箱,上海精宏;UV-1700紫外-可见分光光度计,上海美析;AUW120D精密电子天平,岛津;YX280A灭菌锅,上海三申;SW-CJ-2D无菌操作台,上海尚净。
1.3 培养基及培养条件
LB培养基:蛋白胨10.0 g、酵母膏5.0 g、NaCl 10.0 g,蒸馏水定容至1 L,pH值调至7.0。
以PVC为唯一碳源的选择培养基:KH2PO40.700 g、ZnSO4·7H2O 0.002 g、K2HPO40.700 g、FeSO4·7H2O 0.002 g、MgSO4·7H2O 0.700 g、MnSO4·H2O 0.001 g、NH4NO31.00 g,PVC塑料膜片,蒸馏水定容至1 L,pH值调至7.0。
培养条件:所有用品在105 kPa灭菌30 min,固体培养基在25 ℃恒温培养,液体培养基于25 ℃震荡培养,转速100 r/min。
1.4 黄粉虫的饲养
在室温(25±2)℃条件下饲养黄粉虫,挑选体态相似的黄粉虫作为一组,同时做2组平行,以干面条为食物饲养4 d,使其恢复至最佳生理状态,之后以PVC膜为唯一食物饲养12 d,期间每隔4 d喂食少量蔬菜叶作为水分补充,每2 d对PVC塑料膜和虫体进行称重并记录。另取若干黄粉虫喂食麦麸作为对照。
1.5 黄粉虫肠道微生物的分离和纯化
按照文献[11]的方法,取PVC塑料膜饲养12 d后的黄粉虫幼虫,在超净工作台上将虫体浸泡在75%医用酒精里1 min,用SAB缓冲液反复漂洗至白色,无菌蒸馏水冲洗3次,用无菌解剖器具取出肠道,置于装有10 mL灭菌水和玻璃珠的三角瓶中,充分震荡10 min。
取震荡后的肠道内容物溶液1 mL,加入装有100 mL LB液体培养基的三角瓶中,在25 ℃、100 r/min条件下进行富集培养。3 d后,将富集培养好的菌液,以1%的接种量接入以PVC为唯一碳源的选择培养基进行选择培养,期间每3 d用紫外-可见分光光度计在600 nm(OD600)波长下测定一次菌体生长情况,51 d后测定PVC塑料膜重量。
在菌体生长达到稳定期时,取1 mL培养液加入无菌蒸馏水进行梯度稀释,取稀释度为10-4、10-5、10-6的培养液0.1 mL,均匀涂布于LB固体平板上,在25 ℃恒温培养。待平板上长出单菌落后,挑选不同形态的菌落转接至斜面保存。
2 结果与分析
2.1 黄粉虫取食PVC塑料膜情况
以PVC塑料膜为唯一食物喂食黄粉虫的过程中,黄粉虫能从塑料膜边缘对塑料膜进行取食,黄粉虫取食塑料膜后生长良好,且有部分黄粉虫化蛹。如图1所示,12 d后,3个实验组中,PVC塑料膜边缘有明显被啮噬的痕迹,薄膜面积减少明显(图1a),质量逐渐降低(图1b);虫体质量也逐渐降低(图1c)。如表1所示,3个实验组12 d塑料膜分别减重71.7%、28.8%、42.1%,虫体分别减重10.7%、33.9%、27.3%,塑料膜降解速率分别为0.667 mg/(d·g虫体 )、0.303 mg/(d·g虫体 )、0.504 mg/(d·g虫体 );因此,塑料啮食率越高,虫体重量减少越小,这可能是因为虫体通过啮食塑料可以在一定程度上补充生长所需的能量。

图1 黄粉虫啮食塑料膜过程中PVC质量及虫体质量变化情况
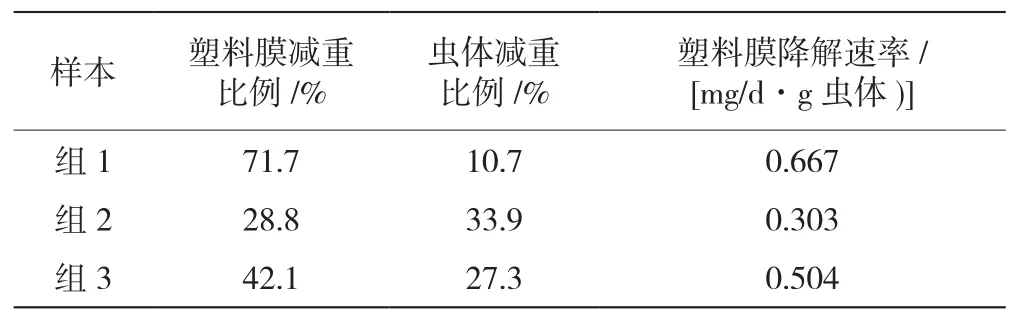
表1 塑料膜减重比例与黄粉虫生长情况
在实验中观察到,啮食塑料膜较多的1号实验组化蛹率较高,可能是因为黄粉虫在即将化蛹前需取食更多的食物,以为化蛹做好能量储备。在饲养过程中,黄粉虫有相互啮食的情况,黄粉虫单头重量有所升高,但去除死亡的黄粉虫后,其总体质量呈现下降趋势。这说明,黄粉虫虽然能取食PVC塑料,但PVC塑料不能提供黄粉虫生长发育所需的全部营养。
如图2所示,以PVC塑料膜为唯一食物的黄粉虫粪便在外观上与以麦麸为食物的黄粉虫的粪便明显不同,前者粪便颜色偏暗,呈棕黑色,后者粪便颜色偏亮,呈棕黄色,说明黄粉虫能对取食的塑料由肠道微生物进行降解消化,但降解的产物与正常取食麦麸后的降解产物不同。

图2 取食PVC塑料与取食麦麸的黄粉虫粪便对比
2.2 肠道细菌的分离及鉴定
如图3所示,培养前9 d左右,由于培养基中含有少量LB培养基,因此混合菌利用少量的LB培养基继续进行繁殖,菌体浓度有所增加,第9 d菌体浓度达到阶段性高峰;从第9 d开始,由于少量的LB培养基消耗殆尽,混合菌种还未完全适应以PVC膜为唯一碳源的生长条件,菌体浓度开始下降,第15 d时,菌体浓度降至最低;从15 d开始,混合菌种开始适应PVC膜为唯一碳源的生长条件,菌体浓度开始缓慢上升;第39 d时,菌种完全适应PVC膜为唯一碳源的生长条件,开始进入对数生长期,第45 d菌体浓度达到最高值;之后,随着无机盐培养基逐渐消耗,菌种生长条件开始恶化,菌体进入衰亡期,菌体浓度开始下降。培养51 d后,PVC塑料膜重量从4 930 mg减少到4 782 mg,降解效率达到2.9 mg/d,失重率为3%。

图3 以PVC塑料膜为唯一碳源的无机培养基中菌体浓度变化
如图4所示,培养51 d后的菌体稀释10-5后在平板上长出2种共22个单菌落,可以计算出原无机培养基中菌体浓度为2.2×107个/mL。分离出的两种单菌落一种表面光滑、乳白色、不透明、边缘平整、质地湿润,命名为JXXDPVC-1;另一种表面光滑、乳白色、边缘叶状、质地湿润,命名为JXXDPVC-2。

图4 10-5稀释度平板生长出的单菌落
3 结论
研究发现,12 d连续喂食PVC塑料膜,黄粉虫能正常存活,部分幼虫完成变态发育,PVC塑料膜最大减重71.7%,降解速率达到0.667 mg/(d·g虫体)。黄粉虫幼虫肠道中富集了能降解PVC塑料膜的菌种,在有氧条件下从其肠道中分离筛选出能降解PVC塑料膜的2株菌种JXXDPVC-1和JXXDPVC-2,其对PVC塑料膜的降解效率达到2.9 mg/d。本研究只在有氧条件下对黄粉虫肠道内微生物进行分离,在厌氧条件下是否也有微生物参与PVC塑料膜的降解还需进一步研究。此外,对于分离出来的微生物其单菌种降解PVC塑料的能力尚未进行实验,如何能通过优化降解条件使PVC塑料膜的降解速率最大化还有待进一步研究。
