KRAS突变非小细胞肺癌患者临床病理特征及预后分析
2021-05-12陈会会李慧赵晓光赵璐张国俊
陈会会,李慧,赵晓光,赵璐,张国俊
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
肺癌在全球范围内仍是癌症发病率和死亡率居高不下的主要原因[1],5年生存率不超过15%,据估计,到2035年,全球肺癌死亡人数将从2012年的160万增加到2035年的300万,约增加86%[2]。肺癌的病理类型包括非小细胞肺癌(non-small cell lung cancer,NSCLC)(83%)和小细胞肺癌(13%)以及大约3%病理类型不明确的肺癌,治疗方法有手术、化疗、放疗、靶向治疗、免疫治疗等[3]。近年,靶向治疗和免疫治疗迅速发展,如厄洛替尼、吉非替尼、阿法替尼和奥西替尼被开发用于靶向EGFR;克唑替尼、阿来替尼被开发为靶向ALK(克唑替尼也靶向ROS1)[4],EGFR、ALK等癌基因将肺癌的治疗模式从病理为导向转向分子为导向的精准治疗模式,给患者带来更多获益,然而,目前KRAS突变的NSCLC尚无靶向药,晚期患者的治疗主要以化疗为主。因此,本研究重点探讨KRAS突变型NSCLC的临床病理特征及其对化疗效果的影响,以明确KRAS突变是否是晚期NSCLC的预后因素。
1 资料与方法
1.1 一般资料应用电子病历系统回顾性收集2018年1月至2019年1月郑州大学第一附属医院经病理确诊的409例NSCLC患者的临床资料。临床资料包括性别、年龄、体力状况、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、吸烟史、肿瘤家族史、病理类型(腺癌/非腺癌)、临床分期(TNM分期)、是否脑转移、是否骨转移、PD-1表达、PD-L1表达情况及治疗方案;电子病历或电话随访至2020年12月。
纳入标准:(1)2018年1月至2019年1月经病理确诊的NSCLC患者;(2)接受二代基因测序进行基因检测,且检测结果明确的患者。排除标准:(1)病理类型不是NSCLC者;(2)临床资料记录不完善者;(3)肺部为转移性肿瘤者。
根据第8版TNM分期系统进行临床分期;每年吸烟量<30包定义为不吸烟,≥30包定义为吸烟;ECOG评分在0~1分记为评分较低,2~4分记为评分较高;记死亡为终点事件,总生存期(overall survival,OS)为从肺癌病理确诊之日起至发生终点事件,如随访结束患者尚未发生终点事件,记为删失数据。
1.2 统计学方法应用SPSS 23.0统计软件处理数据,应用χ2检验分析二分类变量之间的差异;应用Kaplan-Meier曲线估计生存分布,log-rank检验计算各组间生存差异,检验水准α=0.05。
2 结果
2.1 临床病理资料409例NSCLC患者中,KRAS突变型55例,野生型354例,突变率为13.4%(55/409)。55例KRAS突变型NSCLC中,32例Ⅲ~Ⅳ期患者接受化疗方案治疗,8例未治疗,8例患者接受手术治疗,其余7例患者接受化疗联合放疗方案治疗;354例KRAS野生型NSCLC中,80例Ⅲ~Ⅳ期患者接受化疗方案治疗,198例患者接受一线靶向治疗,60例患者手术治疗,其余16例患者未治疗。KRAS突变型NSCLC患者年龄41~84岁,平均(63.0±11.1)岁,野生型患者年龄32~89岁,平均(60.4±10.4)岁。与野生型相比,KRAS突变型更多发生于男性、有吸烟史、ECOG评分较高、病理类型为腺癌者,且KRAS突变者PD-L1阳性表达率更高,差异有统计学意义(P<0.05),而在年龄、有无肿瘤家族史、TNM分期、有无脑转移、骨转移、PD-1是否表达方面差异无统计学意义(P>0.05)。见表1。
2.2 55例KRAS基因亚型分布55例KRAS突变NSCLC患者中,6例合并TP53突变,合并BRAF或MET或ALK基因突变各1例,未见合并EGFR基因突变。大部分突变位点位于2号外显子,约占92.8%,极少数突变位点位于3号外显子,其余为拷贝数扩增。最常见的突变位点是2号外显子12密码子,约占83.6%(46/55),突变率居前3位的依次是2号外显子G12D(25.5%)、2号外显子G12C(21.8%)、2号外显子G12V(16.4%),其他突变位点包括2号外显子G12A、Gly12Val、Gly13Phe、G12S、G13D,3号外显子Q61L、Q61H等。
2.3 KRAS突变NSCLC患者生存分析KRAS突变型Ⅲ~Ⅳ期NSCLC患者32例化疗,中位OS为12.0个月,95% CI为9.6~14.4个月,KRAS野生型Ⅲ~Ⅳ期NSCLC患者80例化疗,中位OS为18.1个月,95% CI为15.4~20.8个月,KRAS突变型组Ⅲ~Ⅳ期化疗患者中位OS低于KRAS野生型组Ⅲ~Ⅳ期化疗患者(12.0个月比18.1个月),差异有统计学意义(χ2=7.675,P=0.006)。见图1。KRAS突变型Ⅲ~Ⅳ期NSCLC患者8例未治疗,中位OS为4.0个月,95% CI为2.5~5.5个月,KRAS突变型未治疗组患者中位OS低于KRAS突变型化疗组(4.0个月比12.0个月),差异有统计学意义(χ2=15.103,P<0.001)。见图2。

表1 409例NSCLC患者临床病理特征
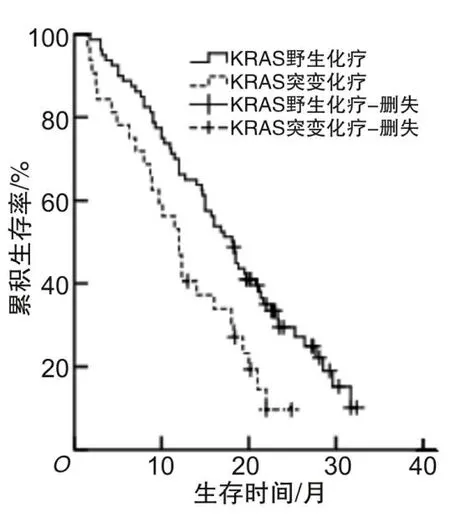
图1 KRAS突变状态对晚期NSCLC化疗患者OS的影响
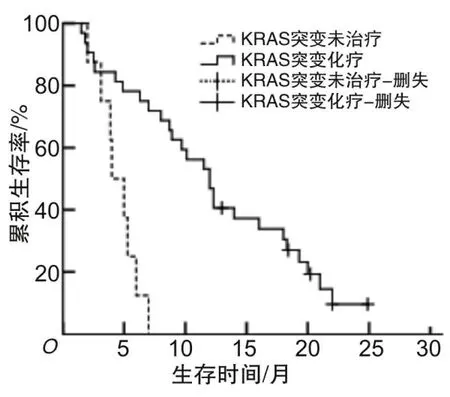
图2 治疗方式对KRAS突变晚期NSCLC患者OS的影响
3 讨论
癌症发生的主要原因是细胞基因组中影响控制细胞生长和分化的基因表达或功能改变,在人类肿瘤中常见的一个基因家族是RAS基因家族。KRAS是RAS癌基因家族成员之一,广泛存在于肺癌、结直肠癌、胰腺癌等[5]。在晚期NSCLC中,KRAS突变是一个明确的致癌驱动因素,KRAS基因12、13或61位点的突变会导致氨基酸替换,并导致RAS信号通路的组成性激活,这可能进一步与多种效应因子相互作用,包括丝裂原活化蛋白激酶、磷酸肌醇3-激酶、信号传导和转录级联激活因子[6],失去正常调控细胞周期的功能,从而导致肿瘤的发生。二代基因测序又称高通量测序,能一次对几十万到几百万条DNA分子进行序列读取,可提供丰富的遗传学信息,对肿瘤突变基因检测具有重要的价值。目前已知KRAS可与MET、ALK、BRAF、EGFR等多种基因共同突变,且介导MET14突变对克唑替尼治疗的原发性或获得性耐药[7]。
关于KRAS突变的数据大多源于欧美国家,为总结国内KRAS突变的NSCLC患者的临床病理特征,本研究纳入河南省409例NSCLC患者,其中KRAS突变者55例,突变率约为13.4%,稍低于西方国家NSCLC患者的突变率(20%~25%)[8]。本研究发现在NSCLC中,KRAS突变最常见于12密码子,约占83.6%,低于高宁等[9]的研究结果(占突变总数的92%),最常见的突变亚型为2号外显子G12D(25.5%)、G12C(21.8%)、G12V(16.4%),与Wood等[10]纳入的2 034例KRAS突变NSCLC研究有差异[2号外显子G12C(46.5%)点突变,其次是G12V(23.5%)和G12D(18.6%)]。
本研究显示,与KRAS野生型相比,KRAS突变更多发生于肺腺癌、有吸烟史、ECOG评分较高、男性患者,且KRAS突变者的PD-L1阳性表达率更高。与KRAS野生型患者相比,KRAS突变的患者更有可能是吸烟者,这一现象与既往的研究[11]一致。在一项包括106例肺腺癌患者的研究中,KRAS突变在40例患者中被检测出来,并且吸烟者比不吸烟者明显更常见[12]。KRAS突变者PD-L1阳性表达率较高,可能是由于KRAS突变表达许多可能触发抗肿瘤免疫反应的新抗原[13],肿瘤细胞必须通过异常激活免疫检查点来补偿高的免疫可见性,从而抵消早期免疫反应的细胞毒作用[14]。因此,如果临床发现KRAS突变的NSCLC患者,建议行免疫组化检测PD-L1的表达情况,以明确是否可行免疫治疗。本研究发现KRAS突变更多发生于肺腺癌,与既往报道[15]一致,其原因可能是KRAS发生突变时可使呼吸道黏膜的干细胞分化成分泌型细胞,进而转变成腺癌细胞[15]。
关于KRAS突变在结直肠癌中的预后意义已有大量数据[16],但其对肺癌的预后作用尚不明确。本研究表明KRAS突变是晚期NSCLC的不利预后因素,但与KRAS突变未治疗的NSCLC患者相比,化疗可以提高其OS。一项包括77例KRAS突变的晚期非鳞NSCLC的研究显示,KRAS突变提示晚期非鳞NSCLC预后差[17],这与本研究相符。KRAS突变的晚期NSCLC化疗患者中位OS低于KRAS野生型晚期NSCLC化疗患者,这一结果与Yang等[11]在一项包括26例化疗的KRAS突变NSCLC患者研究结果一致。然而,也有部分研究与本研究结果不同,在一项根据KRAS突变状态分析的晚期NSCLC接受一线含铂双药化疗患者的生存结局研究中,KRAS突变与较低的OS无相关性[18]。本研究是回顾性研究,患者的化疗方案不完全一致,尚需进一步前瞻性研究,评估KRAS突变是否是晚期NSCLC患者的预后因素。
综上,与KRAS野生型相比,突变型更多发生于男性、有吸烟史、ECOG评分较高、病理类型为腺癌的NSCLC患者,且KRAS突变的NSCLC患者PD-L1阳性表达率更高;KRAS突变型晚期NSCLC对化疗反应较差,是晚期NSCLC患者的不利预后因素,而化疗可以提高KRAS突变晚期NSCLC患者的OS。在临床工作中,对KRAS突变的晚期NSCLC患者应积极行化疗方案治疗,并行PD-L1检测,明确是否可行免疫治疗。
