大枣不同加工部位含糖量测定及脱糖大枣的研究思路*
2021-05-12马宝珠刘世军
马宝珠 ,刘世军 △,李 慧 ,刘 永
1 陕西中医药大学/陕西省中药资源产业化协同创新中心,陕西 咸阳 712083;2 陕西省中药基础与新药研究重点实验室;3 陕西省风湿与肿瘤类中药制剂工程技术研究中心
大枣为鼠李科植物枣(Ziziphus jujubaMill.)的干燥成熟果实[1],是我国传统的滋补保健食品,其价值与功效毋庸置疑。众所周知,大枣中含有较高的糖分,然而随着糖尿病患者的增加,民众对糖分的摄入有了警觉。大枣中含有的糖类主要有单糖、低聚糖、多糖。单糖主要为具有还原性的葡萄糖和果糖,比例大约为1∶1.2。葡萄糖是生命体内新陈代谢不可少的营养物质,它氧化释放出的热量是人类生命活动所需能量的重要来源,但糖尿病患者却应尽可能少食或不食葡萄糖。那么,大枣不同加工部位中总糖、还原糖、低聚糖和多糖究竟是多少?本实验将大枣分成浸膏、枣渣、粗多糖,分别测其含糖量,不仅可以准确得出大枣不同加工部位中糖的含量,还可以为糖尿患者合理食用大枣提供一定的参考。
1 仪器与试剂
1.1 仪器101-3 型电热鼓风干燥箱(北京科伟永兴仪器有限公司);N-1210B 旋转蒸发仪(上海爱朗仪器有限公司);FW400AD 型高速万能粉碎机(天津鑫博得仪器有限公司);KQ-300DE 型数控超生波清洗器(昆山市超声仪器有限公司);岛津UV-2600 紫外可见分光光度计;CPA225D 型电子分析天平[赛多利斯科学仪器(北京)有限公司]。
1.2 试剂3,5-二硝基水杨酸(化学纯,上海科丰实业有限公司),葡萄糖(天津市大茂化学试剂厂),酒石酸钾钠(天津市天力化学试剂有限公司),氢氧化钠(天津市天力化学试剂有限公司),硫酸(成都市科隆化学品有限公司),苯酚(天津市天力化学试剂有限公司),亚硫酸钠(天津市天力化学试剂有限公司),95%乙醇(安徽安特食品股份有限公司),以上均为分析纯。
2 方法与结果
通过苯酚-硫酸法及3,5-二硝基水扬酸法对大枣浸膏、枣渣、粗多糖中的总糖和还原糖进行测定[1-2]。大枣中的糖分为单糖、低聚糖和多糖。单糖的组成主要为果糖和葡萄糖,均为还原性糖。林勤保等[3]通过气质联用分析发现,大枣单糖组分中果糖的相对含量为50.06%,葡萄糖的相对含量为 41.05%。安晓南[4]采用LC-MS 法对大枣中两种含量较高的低聚糖进行了初步定性分析,发现分别为蔗果三糖和蔗果四糖,均为功能性低聚糖,
而且没有还原性。由于大枣低聚糖的成分研究尚不够深入,只能根据现有的研究成果将大枣中的低聚糖归为非还原性糖。大枣多糖也不具有还原性。故可以认为大枣中还原性糖含量为单糖含量,总糖与还原糖含量之差在一定程度上反映了大枣多糖和低聚糖含量。
2.1 样品的制备将大枣去核干燥处理,得4.132 kg大枣,在电磁炉上用12倍水煎煮3次,每次 3 h[5],提取液过滤,备用。枣渣烘干,粉碎,即为样品枣渣,共1070.07 g。将大枣水提液浓缩,放冷后用95%药用乙醇沉淀,使含醇量达80%,净置24 h,分离上清液,将沉淀烘干,粉碎,即为样品粗多糖,共383.5 g;将上清液通过旋转蒸发仪回收乙醇,浓缩至无醇味,最后得到1640 mL(固含为1118.48 g)浸膏。
2.2 3,5-二硝基水杨酸液的制备A 液:称取6.3 g 3,5-二硝基水杨酸(3.5-dinitrosalicylic acid,DNS),21.0 g 氢氧化钠充分溶解于400 mL 煮沸后再放冷的纯化水中。B 液:称取182.0 g 酒石酸钾钠溶解于400 mL 煮沸过的温水中,再加入5.0 g苯酚,5.0 g亚硫酸钠,搅拌溶解。将A 液与冷却后的B 液混合均匀,定容至1000 mL的棕色容量瓶中,于4℃冰箱中放置至少7天后使用[2]。
2.3 葡萄糖标准溶液的制备精密称取105℃干燥至恒重的葡萄糖1.002 14 g,置于1000 mL 容量瓶中,加纯化水溶解并定容,得1.002 14 mg/mL葡萄糖标准溶液,于4℃冰箱中放置备用。
2.4 6%苯酚溶液的制备精密称取苯酚80 g 于100 mL 容量瓶中,加纯化水溶解并定容,得80%苯酚溶液,于4℃冰箱备用。6%苯酚溶液由80%苯酚溶液现用现配。
2.5 标准曲线的绘制
2.5.1 总糖测定标准曲线 取葡萄糖标准溶液稀释至0.1 mg/mL。精密移取0.2、0.4、0.6、0.8、1.0、1.2 mL于10 mL试管中,分别补纯化水至2 mL,精密加入6%苯酚(现配)1.0 mL,摇匀后立刻加入5.0 mL 浓硫酸,常温放置 30 min 后冷却 5 min,于490 nm 处用紫外可见分光光度计测其吸光度值。以2 mL 纯化水代替葡萄糖标准溶液作空白对照。以浓度为横坐标、吸光度为纵坐标绘制出标准曲线,见图1。
回归方程:y=16.834x-0.0425,相关系数:R2=0.9986。

图1 总糖测定中葡萄糖标准曲线
2.5.2 还原糖测定标准曲线 精密移取葡萄糖标准溶液 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL 于25 mL 容量瓶中,补纯化水至2 mL。摇匀后加入DNS 5.0 mL,沸水浴5 min 后,立即放入冰水中冷却20 min,最后定容至刻度线,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替葡萄糖标准溶液作空白对照[6]。以浓度为横坐标、吸光度为纵坐标绘制出标准曲线,见图2。
回归方程:y=32.075x-0.0837,相关系数:R2=0.9987。

图2 还原糖测定中葡萄糖标准曲线
2.6 条件优化
2.6.1 显色条件 通过阅读文献发现,苯酚-硫酸法显色条件大都一致,而还原糖的显色条件差异较大,故本实验主要针对大枣中还原糖的最佳测定条件进行考察。
2.6.2 最大吸收波长的选择 取2 只25 mL 容量瓶,加入1 mL葡萄糖标准溶液和1 mL纯化水,再加入5 mL DNS溶液,摇匀后立即沸水浴3 min。取出,冰水浴20 min,再加纯化水定容,摇匀,于450~600 nm波长范围内用紫外可见分光光度计进行光谱扫描,测其吸光度。以2 mL 纯化水代替葡萄糖标准溶液作空白对照。扫描结果见图3。由图可知,波长为493 nm时有最大吸光度,故本实验还原糖测定时选用的波长为493 nm。

图3 光谱扫描图
2.6.3 显色剂用量的选择 取7 只25 mL 容量瓶,分别加入1 mL葡萄糖标准溶液和1 mL纯化水,在分别依次加入2、3、4、5、6、7 mL 的DNS 溶液,摇匀后立即沸水浴3 min。取出,冰水浴20 min,再加纯化水定容,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替葡萄糖标准溶液作空白对照。结果见图4。由图可知,DNS用量为4~7 mL时,吸光度趋于稳定,DNS用量为5 mL时,吸光度最大,故选择加入显色剂的用量为5 mL。
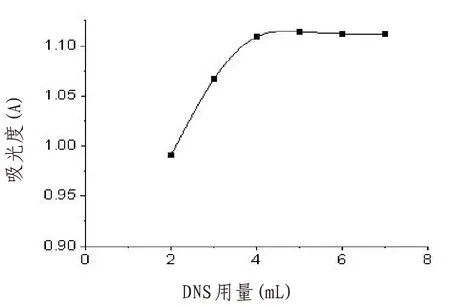
图4 显色剂用量对吸光度的影响
2.6.4 显色反应时间的选择 取6 只25 mL 容量瓶,分别加入1 mL葡萄糖标准溶液和1 mL纯化水,再分别加入5 mLDNS溶液,摇匀后分别置于沸水浴中煮沸3、4、5、6、7 min显色,取出,冰水浴20 min,再加纯化水定容,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替葡萄糖标准溶液作空白对照。结果见图5。由图可知,显色反应时间为5 min时测定的吸光度最大,故选择显色反应时间为5 min。
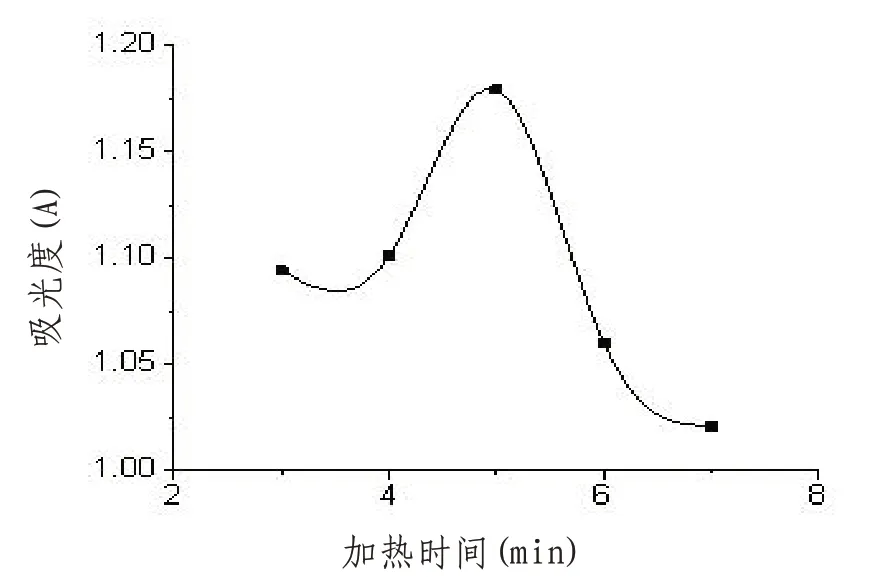
图5 显色反应时间对吸光度的影响
2.7 方法学考察
2.7.1 精密度实验 取7 只25 mL 容量瓶,分别精密移取0.5 mL 葡萄糖标准溶液和1 mL 纯化水,按照还原糖标准曲线测定方法测定吸光度值,测得吸光度分别为0.577、0.563、0.569、0.582、0.578、0.580,RSD=1.16%。结果表明,吸光度无明显变化,说明该方法精密度良好。
2.7.2 稳定性实验 取2 只25 mL 容量瓶,分别精密移取0.5 mL 葡萄糖标准溶液和1 mL 纯化水,分别加入5 mL DNS 溶液,摇匀后置于沸水中水浴5 min 显色,取出,冰水浴20 min,再加纯化水定容,摇匀,于493 nm处用紫外可见分光光度计每隔5 min测一次吸光度,连续30 min考察稳定性。以2 mL纯化水代替葡萄糖标准溶液作空白对照。测得吸光度分别为0.558、0.560、0.571、0.578、0.553、0.569,RSD=1.51%。结果表明,吸光度值30 min内无明显变化,说明此方法稳定性良好。
2.7.3 还原糖加样回收实验 精密移取已知还原糖含量为0.375 mg/mL 的粗多糖溶液0.5 mL 为样品,按还原糖量的80%、100%、120%精密加入0.5 mL 葡萄糖标准溶液,按照还原糖标准曲线制备方法测定吸光度值,计算回收率,结果见表1。结果显示,还原糖平均加样回收率为101.6%,RSD为4.6%,符合要求。见表1。
2.8 样品测定取适量大枣浸膏、枣渣、粗多糖稀释至合适的倍数,采用已建立的方法测定总糖和还原糖。目前大枣中低聚糖和多糖含量无法直接有效测定,总糖量与还原糖量在一定程度上反映了低聚糖和多糖含量。本实验采用苯酚-硫酸法测定总糖含量,采用DNS 法测定还原糖含量,两者之差可以初步认定为低聚糖和多糖含量。
干燥后的大枣果肉共4132 g,则此大枣的含糖量为52.14%,其中还原糖含量为36.90%,占总糖的70.78%;低聚糖和多糖含量为15.24%,占总糖含量的29.22%。大枣通过煎煮,水提液的含糖量占总含糖量的70.76%。在粗多糖中,低聚糖和多糖的收率为7.04%,纯度为11.57%,所以使用95%乙醇醇沉大枣浸膏使含醇量达80%,仅一次分离提取多糖和低聚糖的效果并不理想,并且还有一部分多糖和低聚糖存在于枣渣中,并未煎煮出来。大枣浸膏、枣渣和粗多糖的含糖量测定见表2。
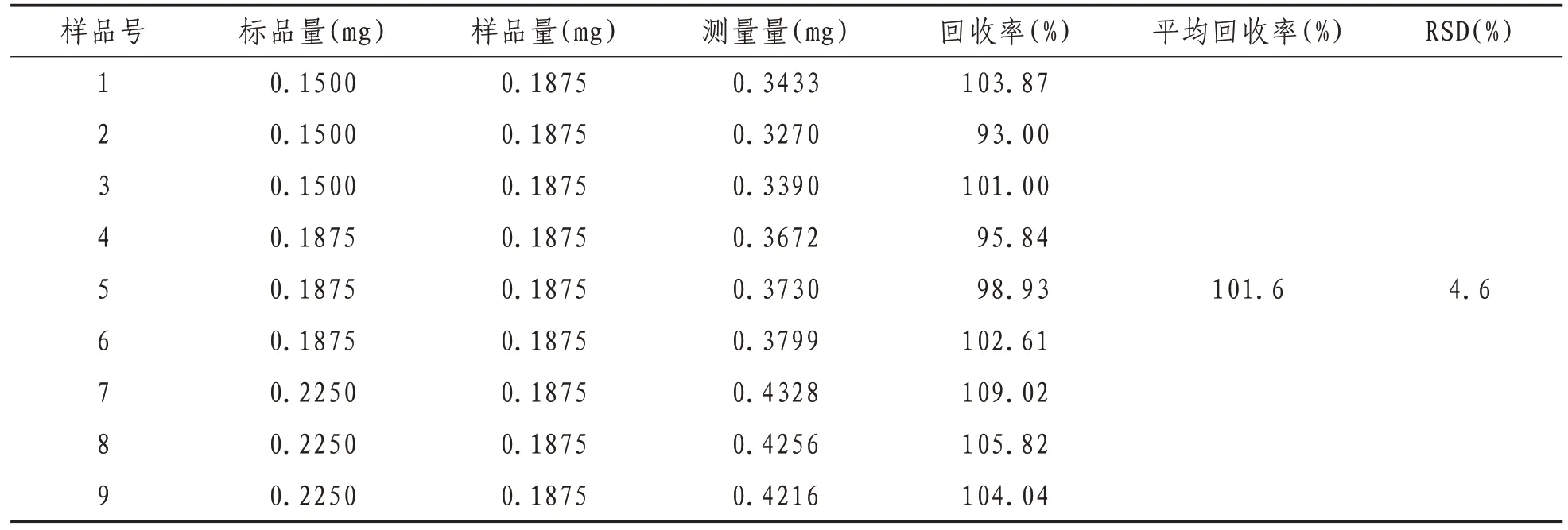
表1 还原糖加样回收实验

表2 大枣浸膏、枣渣和粗多糖的含糖量测定
3 讨论
在大枣所含糖分中,还原糖(主要为葡萄糖和果糖)占总糖含量的70.78%。这也是糖尿病患者不可食用过多大枣的主要原因。然而大枣中的还原糖差不多二分之一为果糖。长期临床观察表明,果糖对控制糖尿病的病情有一定效果[7-8]。果糖广泛存在于各种水果中,机体吸收后,由于果糖激酶的活性不依赖胰岛素调控,可在无胰岛素参与的情况下,直接转化为糖原,故对血糖的影响小[9]。
低聚糖和多糖,这两类糖对人体还是非常友好的,包括糖尿病患者。大枣中两种含量较高的低聚糖均为功能性低聚糖,具有低热量、抗龋齿、抗肿瘤、防治糖尿病、防止腹泻和便秘等生理作用[10]。大枣多糖具有保肝、抗氧化、抗衰老、抗疲劳、降血脂、调节血糖和提高免疫力等多种作用[11-12]。大枣中这两类糖占总糖含量的29.22%,占大枣含量的15.24%。
将大枣中不同种类的糖进行研究分析,有望开发出适合于糖尿病患者的脱糖大枣,满足糖尿病人群食用大枣的需求。同时使大枣资源最大化利用,延长大枣产业链条,提高大枣附加值,为大枣资源的可持续发展奠定基础。
