紫杉醇脂质体联合卡培他滨方案治疗局部进展期胃癌的疗效及循环肿瘤细胞对疗效的预测价值
2021-05-12苏静张冬张晓彤
苏静,张冬,张晓彤
三门峡市中心医院肿瘤内科,河南 三门峡 472000
胃癌是起源于胃肠黏膜上皮的消化道恶性肿瘤,具有较高的发病率及病死率,多发于中老年人,男性发病率显著高于女性,中国胃癌发病率居恶性肿瘤首位,病死率高达47.8%,且近年来发病呈年轻化趋势,严重威胁患者身心健康[1]。早期胃癌缺乏典型的临床表现,多数患者就诊时已为进展期胃癌,耽误最佳手术治疗时机,系统化疗是其理想的治疗手段[2]。紫杉醇类药物和卡培他滨是广泛应用于胃癌治疗的临床药物,紫杉醇脂质体作为紫杉醇衍生物,是一种广谱抗癌药物,治疗晚期胃癌具有突出疗效。研究显示,紫杉醇脂质体治疗胃癌疗效较好,过敏反应及不良反应较少,耐受性好[3]。卡培他滨是新一代靶向口服抗肿瘤药物,能够模拟氟尿嘧啶持续静脉滴注。文献表明,紫杉醇脂质体联合卡培他滨方案治疗晚期或进展期胃癌疗效肯定[4]。循环肿瘤细胞(circulating tu-mor cell,CTC)是由恶性肿瘤原发部位脱落并经过血管或淋巴系统进行血液循环的细胞,能够反映肿瘤负荷,且可替代组织样本进行病理诊断、预后判断等[5]。多项关于乳腺癌、肺癌等实体瘤的临床研究表明,CTC能够评估化疗疗效、复发风险及预后情况[6-8]。基于上述基本理论及既往文献报道,本研究分析80例进展期胃癌患者,旨在探讨紫杉醇脂质体联合卡培他滨方案治疗进展期胃癌的临床疗效及CTC评估疗效的价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年1月至2015年1月三门峡市中心医院收治的进展期胃癌患者的病历资料。纳入标准:经胃镜或病理诊断证实为进展期胃癌;CT、MRI等影像学检查提示存在局部或远处转移;不具备手术指征;初次采用紫杉醇脂质体联合卡培他滨化疗方案,且接受至少3个周期化疗;既往未接受系统性化疗或接受化疗后至少1年出现疾病进展;生化指标、血常规等符合化疗标准;临床分期为ⅢB~Ⅳ期;生存期≥3个月;卡氏功能状态(Karnofsky performance status,KPS)评分[9]≥60分;病历资料完整。排除标准:存在化疗禁忌证;严重感染;合并其他部位恶性肿瘤;妊娠期或哺乳期妇女;心、肝、肾等重要器官功能障碍或功能不全;无法完成随访。根据纳入、排除标准,共纳入80例进展期胃癌患者,男性55例,女性25例;年龄22~68岁,平均(52.19±8.92)岁;肿瘤分型:腺癌62例,鳞状细胞癌12例,腺鳞癌6例;TNM分期:ⅢB期58例,Ⅳ期22例;肿瘤部位:胃中部45例,胃下部35例。
1.2 方法
1.2.1 治疗方法 患者进行化疗前12 h,予以地塞米松静脉滴注5 mg;给药前0.5 h,肌内注射苯海拉明20 mg,静脉滴注西咪替丁300 mg。化疗方案:第1天,予以紫杉醇脂质体静脉滴注,160 mg/m2,静脉滴注3 h;第1~14天,予以卡培他滨口服,1000 mg/m2。21天为1个周期,所有患者均接受至少3个周期治疗。
1.2.2 CTC检测方法 所有患者均于清晨空腹采集肘静脉血3~5 ml,通过离心、混合、显色等步骤封片,采用免疫磁珠阴性分离和免疫细胞化学染色法检测外周血中的CTC。阳性标准:①形态学标准,细胞呈长柱形、圆形或椭圆形,长径超过10 μm,通过光镜可见完整细胞核和细胞形态。②光镜标准,光镜下可见完整细胞膜,染色阳性,细胞质呈褐色或蓝黑色,细胞长径超过10 μm,核质比异常。由2名工作人员共同于光镜下观察细胞显色情况,若意见不统一,则由第3个人协同判定。
1.2.3 肿瘤标志物检测方法 所有患者行静脉采血3~5 ml,以3000 r/min(离心半径15 cm)离心10 min后收集血清,置于-20℃低温保存,采用酶联免疫吸附法检测癌胚抗原(carcinoembryonic antigen,CEA)、肿瘤相关物质(tumor associated material,TAM)水平。
1.2.4 疗效评价标准 依据实体瘤疗效评价标准[10]进行疗效评价:完全缓解(CR),临床症状基本消失,病灶完全消失,至少维持4周;部分缓解(PR),临床症状部分缓解,病灶缩小超过30%;疾病稳定(SD),病情稳定,病灶无显著变化;疾病进展(PD),临床症状无明显改善或加重,病灶增大超过20%或出现新病灶。总有效率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。
1.2.5 研究方法 化疗3个周期,所有患者进行胃镜、CT或MRI、肿瘤标志物等检查,进行全面的疗效评估;进行血尿常规、肝肾功能、凝血功能等常规检查。依据美国国家癌症研究所制定的不良反应评价标准4.0版(National Cancer Institute Common Terminology Criteria for Adverse Events version 4.0,NCI CTCAE 4.0)[11]将不良反应分为1~5级,其中1~2级为轻度,3~4级为重度,5级为死亡,统计不良反应发生情况。
依据化疗前CTC检测结果将胃癌患者分为阳性组和阴性组,比较两组患者化疗前后CEA、TAM水平及无进展生存时间(progression-free survival,PFS)、总生存时间(overall survival,OS)。
1.3 随访
所有患者均进行为期5年的随访,采用电话随访、门诊随访、走访等形式,每个月进行1次,以患者死亡或随访截止时间为随访终点,分析患者生存情况。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;采用Kaplan-Meier法绘制生存曲线,Log-rank法比较生存情况;以P<0.05为差异有统计学意义。
2 结果
2.1 疗效评价
80例胃癌患者经紫杉醇脂质体联合卡培他滨化疗后,均获得疗效评价,其中CR 11例,PR 32例,SD 26例,PD 11例,总有效率为53.75%(43/80),疾病控制率为86.25%(69/80)。
2.2 不良反应发生情况
紫杉醇脂质体联合卡培他滨的常见药物不良反应为白细胞减少、血小板降低、贫血、肝肾功能不全及手足综合征等。80例胃癌患者化疗后,白细胞减少发生率最高,其次是血小板降低;其中白细胞减少发生率为30.00%,1~2级占25.00%,3~4级占5.00%;血小板降低发生率为27.50%,1~2级占20.00%,3~4级占7.50%;贫血、肝肾功能不全、手足综合征发生率分别为15.00%、5.00%、15.00%。(表1)
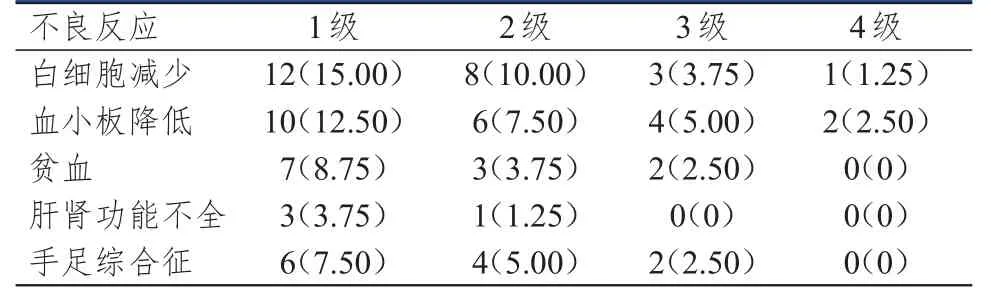
表1 紫杉醇脂质体联合卡培他滨治疗胃癌的不良反应发生情况[n(%)]
2.3 CTC阳性组和阴性组肿瘤标志物水平的比较
经CTC检测,80例胃癌患者分为阳性组45例(56.25%)及阴性组35例(43.75%)。化疗前及化疗后,阳性组患者CEA、TAM水平均高于阴性组(P<0.05),且两组患者化疗后CEA、TAM水平均较化疗前下降(P<0.05)。(表2)
表2 化疗前后CTC阳性组和阴性组患者肿瘤标志物水平的比较(±s)

表2 化疗前后CTC阳性组和阴性组患者肿瘤标志物水平的比较(±s)
注:*与本组化疗前比较,P<0.05
CEA(ng/ml)化疗前38.52±4.21 32.61±3.94 6.404 0.000化疗后25.69±4.06*20.15±4.22*5.951 0.000 TAM(U/ml)化疗前130.26±15.42 121.05±16.37 2.580 0.012化疗后114.67±13.97*105.23±14.88*2.914 0.005组别阳性组(n=45)阴性组(n=35)t值P值
2.4 CTC阳性组和阴性组生存情况的比较
截至随访终点,CTC阳性组患者中位PFS为18个月,中位OS为20个月;CTC阴性组患者中位PFS为24个月,中位OS为26个月;CTC阳性组患者中位PFS、中位OS均短于阴性组,差异均有统计学意义(χ2=4.767、5.468,P<0.05)。CTC阳性组患者5年生存率为24.44%(11/45),CTC阴性组患者5年生存率为40.00%(14/35)。(图1、图2)
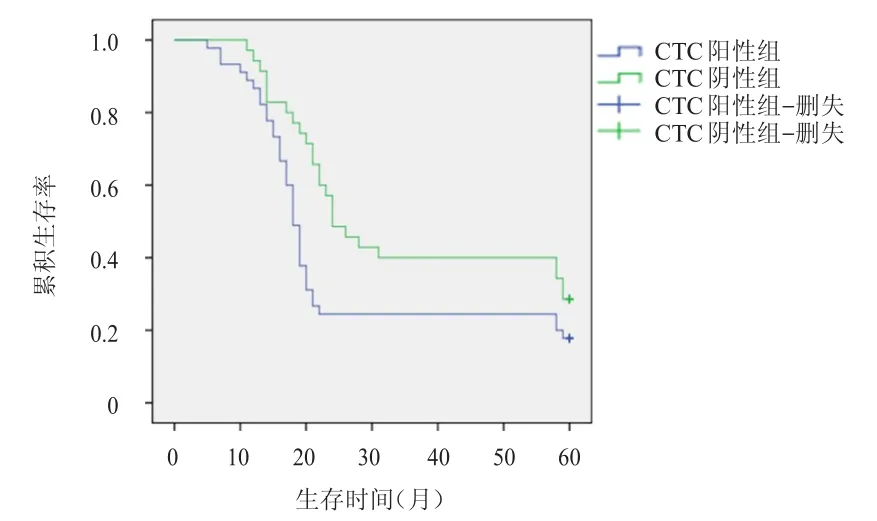
图1 CTC阳性组(n=45)与阴性组(n=35)患者的PFS曲线
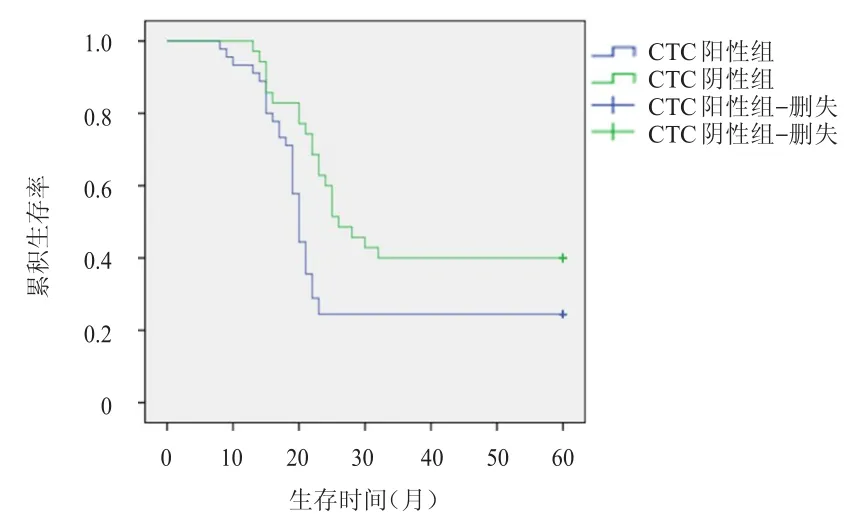
图2 CTC阳性组(n=45)与阴性组(n=35)患者的OS曲线
3 讨论
胃癌是全球第四位常见恶性肿瘤,胃癌相关死因居第二位[12]。早期胃癌无典型症状,当出现明显临床表现时已处于进展期或晚期。研究表明,约60%的胃癌患者确诊时已是局部晚期或已发生远处转移,失去手术切除机会,生存率较低[13],因此针对进展期或晚期胃癌的化疗仍是临床研究的重难点。由于进展期胃癌患者经过多重化疗后对常规化疗方案易产生一定耐药性,故而临床尚无较为有效的标准化疗方案。
紫杉醇是一种紫杉醇类化合物,主要通过在肿瘤细胞分裂时与细胞微蛋白结合而促进微管稳定及聚合,阻断细胞分裂,发挥抑制肿瘤增殖生长的作用[14]。紫杉醇是一种广谱抗肿瘤药物,可应用于肺癌、乳腺癌、卵巢癌等多种恶性肿瘤。由于其独特的抗肿瘤作用机制,使其不会与多种药物产生交叉耐药性,疗效已得到诸多研究证实[15-17],成为近年来倍受关注的抗肿瘤药物之一。文献指出,紫杉醇单药治疗晚期胃癌的有效率为17.5%~24.0%,且无论患者是否接受过化疗或者化疗失败,其均能显示良好的活性。卡培他滨是一种口服氟尿嘧啶抗肿瘤药物,在肿瘤细胞内最终转化为5-氟尿嘧啶,其以口服形式进入机体能够被胃肠道吸收,并经过肝脏转化为脱氧氟胞苷,而后经酶作用激活成为具有细胞毒作用的5-氟尿嘧啶[18]。由于肿瘤组织中5-氟尿嘧啶浓度较高,全身5-氟尿嘧啶浓度较低,因此卡培他滨对于肿瘤组织具有高度的靶向选择性,不仅能够提高抗肿瘤效果,还可减少不良反应。临床表明,单药卡培他滨口服治疗胃癌的疗效为24%~28%,且联合其他抗肿瘤药物治疗晚期胃癌能够显著提高疗效,而体外研究证实,紫杉醇药物联合卡培他滨在抗肿瘤方面具有较好的协同作用[19]。
基于上述药物的药理作用及既往文献报道,本研究回顾性分析80例采用紫杉醇脂质体联合卡培他滨治疗的晚期胃癌患者,结果显示,80例患者均获得疗效评价,总有效率为53.75%,疾病控制率为86.25%。多西他赛+顺铂+氟尿嘧啶(DCF)方案是传统临床治疗晚期进展期胃癌的首选方案,研究证实,DCF方案在欧洲临床试验研究中的有效率为30%~40%,但三药联合导致不良反应较大,患者不耐受,限制其临床应用。由此可见,相较于传统DCF方案,紫杉醇脂质体联合卡培他滨治疗晚期胃癌的疗效更加显著。CEA是一种胚胎性致癌抗原,如今已广泛应用于消化道肿瘤的筛查,而TAM是新型广谱肿瘤标志物,在健康人机体中水平极低,在胃癌等肿瘤患者血清中明显升高,可作为肿瘤发生、发展的重要标志物。本研究中胃癌患者经化疗后,CEA、TAM水平均较化疗前下降,提示了紫杉醇脂质体联合卡培他滨化疗方案的有效性,能够降低肿瘤标志物水平。不良反应方面,本研究中主要不良反应为白细胞减少、血小板降低、贫血、肝肾功能不全及手足综合征等,其中白细胞减少发生率为30.00%,1~2级占25.00%,3~4级占5.00%,血小板降低发生率为27.50%,1~2级占20.00%,3~4级占7.50%,说明化疗方案的不良反应大多较轻微,患者可耐受。Lu等[20]报道指出,予以紫杉醇脂质体联合卡培他滨方案治疗的试验组患者3~4级白细胞减少不良反应发生率为17.6%,略高于本研究结果,认为可能与样本量、统计学分析偏倚等因素相关。紫杉醇脂质体联合卡培他滨方案中两种药物的作用靶点相互协同,且不良反应无增加,因此具有较好的疗效及安全性。
既往研究表明,CTC是肿瘤远处转移发生的前提和转移灶形成的重要条件,能够作为评估乳腺癌、前列腺癌等实体瘤患者PFS、OS、疗效及复发风险预测的重要指标[21]。本研究结果显示,CTC与胃癌患者病情、化疗疗效及预后均密切相关,化疗前,阳性组患者CEA、TAM水平均明显高于阴性组,提示CTC阳性患者肿瘤标志物水平更高,而化疗后两组患者CEA、TAM水平均下降,且阳性组患者CEA、TAM水平均高于阴性组,说明CTC可对疗效起到预测作用,与国外相关研究结果基本相符。比较两组生存情况可知,CTC阳性组中位PFS、中位OS均短于阴性组,且5年生存率低于阴性组,说明CTC与患者预后相关,进一步证实了CTC对胃癌化疗疗效及患者预后的预估作用,认为可能原因为CTC能够预测肿瘤细胞的远处转移,从而对抗肿瘤效果进行评估。既往国外相关动物模型研究指出,CTC数量与新发转移病灶相关,CTC数量越多,患者面临远处转移负荷越重,预估发生转移的病灶数量也越多[22],因此认为CTC数量与预后密切相关。
综上所述,紫杉醇脂质体联合卡培他滨治疗进展期胃癌疗效肯定,安全性较高,患者耐受性较好。CTC能够提示患者化疗疗效及预后情况,但本研究仍存在不足,样本量较少,且为回顾性分析,因此结论尚需要进一步论证。
