基于动态对比增强MRI影像组学模型预测乳腺癌新辅助化疗后非病理完全缓解
2021-05-11宋德领崔书君马永青张玉姣郭亚哲朱月香
宋德领,崔书君,杨 飞,马永青,张玉姣,郭亚哲,朱月香
(1.河北北方学院研究生院,河北 张家口 075000;2.河北北方学院附属第一医院影像科,河北 张家口 075000)

图1 患者女,52岁,左侧乳腺浸润性导管癌Ⅱ级 A.原始DCE-MRI; B.勾画病灶ROI示意图(红色区域)
乳腺癌是基因变异导致的高度异质性疾病,已成为全球女性死亡率最高的恶性肿瘤。新辅助化疗(neoadjuvant chemotherapy, NAC)可降低术前肿瘤分期,使更多患者可接受保乳手术治疗,在无进展生存期、总生存期和局部病灶区域控制方面可达到与辅助化学治疗(简称化疗)相似的结果[1];但仍有部分患者不能获益于NAC,导致后续化疗方案改变及长期生存率降低[2-3]。目前已有影像组学用于鉴别良恶性肿瘤、肿瘤分子亚型及预测基因突变等研究报道[4-7]。本研究观察基于4个周期NAC后动态对比增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)影像组学模型预测乳腺癌非病理完全缓解(non-pathological complete response, non-pCR)的价值。
1 资料与方法
1.1 一般资料 收集2016年1月—2020年8月144例乳腺癌患者,均为女性,年龄38~74岁,平均(54.4±9.7)岁。纳入标准:①于NAC前、后接受活组织检查并获得病理分期,且证实为Ⅱ~Ⅲ期原发性乳腺癌;②完成4个周期NAC,且之前未接受其他方案;③于4个周期NAC后接受乳腺MRI。按照7∶3比例将患者分入训练组(n=99)和验证组(n=45)。
1.2 仪器与方法 采用Philips Ingina 3.0 T超导型MR仪行乳腺MRI,配备四通道乳腺专用相控线圈。患者取俯卧位,头先进,使双乳自然、对称悬垂于线圈内。采集乳腺常规图像后行DCE-MRI,采集脂肪抑制乳腺容积内插梯度回波序列T1WI,TR 2.1 ms,TE 4.5 ms,层厚1.5 mm,层数150层,矩阵512×512,FOV 30 cm×30 cm,翻转角12°,NEX 2;扫描一期蒙片确认病灶位置,以流率2 ml/s经肘静脉注射钆对比剂(0.2 mmol/kg体质量)后行无间隔动态增强扫描,共扫描11期。
1.3 数据处理及筛选纹理参数 采用MaZda软件(The Technical University of Lodz, Institute of Electronics, http: //www.eletel. p.lodz.pl/mazda/)分析 DCE-MRI。由2名分别具有4年和6年胸部影像学诊断经验的主治医师采用盲法于第2期[4]轴位增强图像显示病灶最大层面上手动勾画病灶ROI(图1),由1名具有10年胸部影像学诊断经验的副主任医师逐一确认后,提取病灶纹理参数,包括灰度直方图(histogram)、灰度共生矩阵(the gray-level cooccurrence matrix, GLCM)、游程长度矩阵(grey level run length matrix, GLRLM)和小波变换(wavelet parameters)等,每个参数测2次,取其平均值为最后结果。利用标准分数对特征参数进行处理,计算其平均值()x和标准差(s),以公式yij=(xij-x)/s标准化数据,xij为实际参数值,yij为标准化参数值,对经标准化后为负数的参数取绝对值进行分析。
1.4 筛选影像组学特征与建立标签 采用R 3.6.2统计分析软件,对病理完全缓解(pathological complete response, pCR)和non-pCR分别以0和1作为诊断标签,以最小绝对收缩与选择算子(least absolute shrinkage and selection operator, LASSO)算法对提取的特征参数进行筛选,通过调整权重参数λ将部分特征的系数抑制为零,以筛选最优特征,并以十折交叉验证法筛选特征参数的系数(图2)。依据选出特征及相应特征系数构建影像组学标签,计算每例患者的影像组学分值。
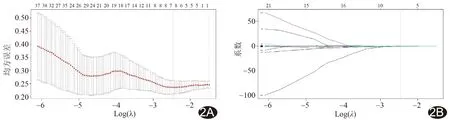
图2 采用LASSO算法筛选影像组学特征 A.通过调整不同参数(λ)使模型二项式偏差达至最小,以筛选最优特征[左侧垂直虚线表示取最佳λ值时Log(λ)对应的最小偏差值,右侧虚线代表最佳λ值所对应的函数值,图片顶端为纳入的特征数目]; B.筛选最优特征系数收敛图(图中垂直线对应筛选出具有非零系数的特征)
1.5 病理资料 根据Miller-Payne分级系统评价NAC前后肿瘤细胞凋亡状况,评估NAC疗效:1级为癌细胞组织形态、数量无明显改变;2级为癌细胞总体数量减少≤30%;3级为癌细胞总体数量减少>30%~90%;4级为癌细胞总体数量减少>90%,病灶内仅存在少量残余癌细胞;5级为恶性细胞全部清除,仅残存部分导管原位癌细胞。将3~5级归为pCR,1~2级归为non-pCR。记录病理分期、雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)和细胞增殖核抗原(nuclear-associated antigen, Ki-67)表达状况。
1.6 统计学分析 采用R 3.6.2统计分析软件。以组内相关系数(intraclass correlation coefficients,ICC)评价2名医师测量参数结果的一致性,ICC为0.75~1.0表示一致性较好。采用±s表示计量资料,以独立样本t检验进行比较;采用频数表示计数资料,以χ2检验进行比较。针对差异有统计学意义的参数,以多因素Logistic回归构建联合影像组学分值的预测乳腺癌NAC后non-pCR的联合模型,采用Hosmer-Lemeshow检验评价训练组和验证组模型的拟合优度,P>0.05表示模型拟合效果好;以受试者工作特征(receiver operating characteristic, ROC)曲线法评价模型的诊断效能。P<0.05为差异有统计学意义。
2 结果
训练组36例pCR、63例non-pCR,验证组分别为15例和30例。2名医师提取DCE-MRI特征参数的一致性较高(ICC=0.763~0.921,P均<0.05)。
2.1 临床病理资料比较 pCR与non-pCR患者间,PR、HER2及Ki-67表达在训练组和验证组中差异均有统计学意义(P均<0.05);患者年龄、病理分期及ER表达差异均无统计学意义(P均>0.05),见表1、2。
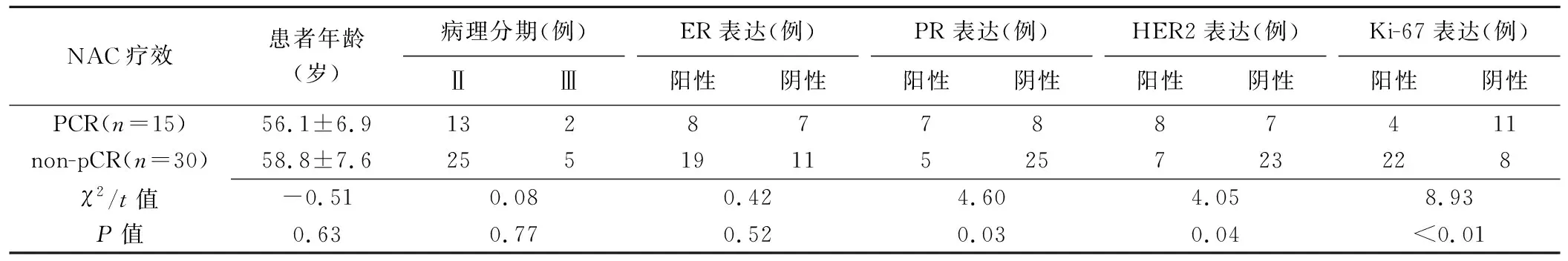
表1 验证组pCR与non-pCR患者临床病理资料比较

表2 训练组pCR与non-pCR患者临床病理资料比较
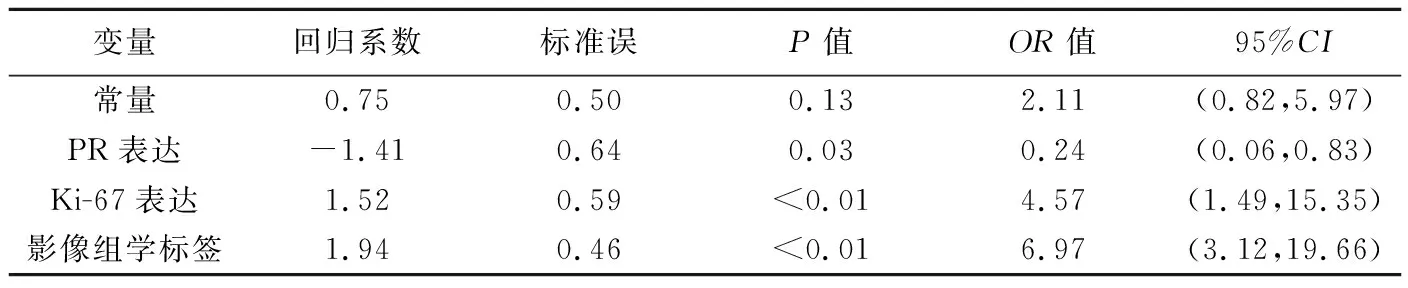
表3 根据训练组影像组学标签联合病理因素构建Logistic回归方程

图3 基于DCE-MRI影像组学联合预测模型预测乳腺癌NAC后non-pCR的ROC曲线 A.训练组; B验证组
2.2 预测模型诊断效能 共提取306个DCE-MRI特征参数,在λ=0.08处筛选出8个最优特征参数用于建立影像组学标签,即1.689+1.1 Contrast×0.001+1.1 Correlation×(-1.121)+2.2 Correlation×(-0.001)+5.0 Contrast×0.001+0.5 Inverse Difference Moment×(-0.257)+5.5 Entropy×(-0.288)+135 Grey Level Nonuniform×(-0.001)+45 Long Run Emphasis×(0.023)。
将PR、HER2和Ki-67表达及影像组学分值纳入多因素Logistic回归分析(表3),由于方差膨胀因子>10,HER2未能纳入联合预测模型。Hosmer-Lemeshow检验结果显示模型在训练组和验证组中均拟合良好(P=0.19、0.34)。ROC曲线结果显示,影像组学标签预测训练组和验证组乳腺癌NAC后non-pCR的曲线下面积(area under the curve, AUC)分别为0.85和0.84(P均<0.05);联合预测模型预测训练组乳腺癌NAC后non-pCR的AUC为0.90[95%CI为(0.82,0.95)],敏感度和特异度分别为88.89%和83.33%;预测验证组的AUC为0.89[(95%CI为(0.76,0.96)],敏感度和特异度分别为83.33%和86.67%,见图3。
3 讨论
乳腺癌HER2缺失常提示其分化较差、对化疗药物不敏感,且与Ki-67表达呈正相关[8]。本研究以筛选出的8个乳腺癌DCE-MRI最优特征参数构建预测NAC后non-pCR的影像组学标签,用于训练组和验证组预测NAC后non-pCR的AUC分别为0.85和0.84,提示临床病理因素等个体化因素对NAC疗效存在影响[9]。本研究结果显示pCR与non-pCR患者间PR、HER2和Ki-67表达差异均有统计学意义,以影像组学标签联合PR和Ki-67构建的联合预测模型预测训练组NAC后non-pCR的AUC为0.90,验证组的AUC为0.89,均高于影像组学标签,表明模型的泛化能力较好,而纳入临床病理特征对提高模型的诊断效能具有积极作用,与既往基于超声影像组学特征预测乳腺癌NAC疗效的研究结果[10]类似。
本研究筛选的最优影像组学特征包含6个GLCM和2个GLRLM参数。GLCM参数主要通过不同空间位置的像素反映ROI内不同方向灰度级变化幅度,常用统计量有熵、能量、对比度、相关性、逆差距和聚类等[11]。肿瘤生长和转移往往依赖于肿瘤血管内皮细胞,促血管生长因子数量越多,血管空间关系和结构分布越复杂。non-pCR肿瘤异质性较高,细胞生长活跃且对化疗不敏感的亚细胞群体数量高于pCR,NAC后仍存在未被杀死的肿瘤细胞和不规则分布的囊变、坏死组织,且肿瘤血管密度下降不明显或出现新生血管,DCE-MRI表现为分布不均匀的中、高混杂信号。pCR肿瘤细胞大量减少或消失,血管长度、分叉节点降低,仅存少量纤维组织,DCE-MRI表现为分布较均匀的中、低信号。影像组学标签中包含6个GLCM参数,提示肿瘤异质性程度与图像纹理相似度、对比度和复杂程度有关,同时反映细胞分子间相互作用导致微环境改变与DCE-MRI纹理分布具有高度相关性[12]。TERUEL等[13]发现乳腺癌NAC后DCE-MRI的和方差和熵值越大,肿瘤异质性越高,肿瘤血管内皮细胞对化疗药物越不敏感。GLRLM用于描述图像内灰度级在不同方向上游行的长度,往往包含更重要的图像特征和相位特征。本研究中,影像组学标签包含2个GLRLM参数,表明肿瘤内部的光滑度和粗糙度亦为预测NAC疗效的关键因素。
综上所述,基于乳腺癌4个周期NAC后DCE-MRI影像组学模型预测NAC non-pCR具有一定价值,有助于制定治疗方案。本研究的局限性:①样本量较少,结果存在偏倚;②提取影像组学特征仅限于病灶最大层面,提取3D特征参数或可获得更丰富的病灶细节特征[14],有待进一步观察。
