多功能复合纳米材料Fe-Cur-KB靶向β淀粉样蛋白:构建与体外MR成像
2021-05-11王培军
罗 静,王培军
(同济大学附属同济医院医学影像科,上海 200065)
阿尔茨海默病(Alzheimer disease, AD)隐匿发病、进行性发展,其病理主要改变为脑内β淀粉样蛋白(amyloid β-protein, Aβ)沉积形成的老年色素沉着(senile pigmentation, SP)和Tau蛋白过度磷酸化形成的神经细胞内神经原纤维缠结(neurofibrillary tangle, NFT)[1]。目前AD带来的社会问题日趋严峻[2],临床迫切需要能够早期诊断的检查方法。多种成像探针现已问世[3-4],其中基于Aβ的核医学探针如11C-PiB、18F-Flutemetamol及18F-Florbetaben等已用于临床,但因其存在电离辐射、半衰期较短及成本较高等问题,临床推广受限。本课题组前期成功构建的新型靶向Aβ的KB探针为18F-Florbetaben衍生物,通过保留18F-Florbetaben主体双苯环结构并对其进行修饰,获得了可透过血脑屏障(blood brain barrier, BBB)与Aβ结合且无电离辐射的新型探针。本研究拟构建结合KB探针、以聚乙二醇(polyethylene glycol, PEG)修饰的磁性四氧化三铁及靶向药物姜黄素(curcumin, Cur)的复合纳米材料,通过体外实验观察其用于早期诊断AD的可行性。
1 材料与方法
1.1 实验材料与动物 KB探针[E-1-(4-(4-甲胺基-苯乙烯基-苯氧基)-3,6,9,12,15,18,21,24-八氧杂庚酸-27-酸](宁波康贝生化有限公司),二硬脂酰基磷脂酰乙醇胺-甲氧基-聚乙二醇 2000(distearoyl phosphatidylethanolamine-methoxy PEG 2000, DSPE-mPEG 2000)、二硬脂酰基磷脂酰乙醇胺-PEG-氨基(distearoyl phosphatidylethanolamine-PEG-NH2, DSPE-PEG-NH2)、Cur粉末、2-吗啉乙磺酸[2-(4-Morpholino)ethanesulfonic acid, MES]、水溶性碳二亚胺[1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydroc, EDC](南京东纳生物科技有限公司),兔源抗Aβ抗体(4G8、6E10)(Covance),碱性磷酸酶标记的山羊抗兔IgG二抗(Sigma Aldrich)及马-达二氏犬肾(Madin-Darby canine kidney, MDCK)细胞(中国科学院上海生命科学研究院)等。
无特定病原体(specific pathogen free, SPF)级APP/PS1雄性转基因小鼠10只,3月龄,体质量(25±5)g,购于南方模式生物科技股份有限公司,许可证编号:SCXK(沪)2017-0010,饲养于18~22℃、相对湿度60%~80%、12 h昼夜交替环境,自由采食、饮水。本研究通过院伦理委员会批准[伦理编号:2019-DW-(005)号]。
1.2 构建磁性纳米材料
1.2.1 制备Fe-Cur纳米颗粒 精确称取30 mg DSPE-mPEG 2000 及10 mg DSPE-PEG-NH2固体粉末,加入2 ml氯仿超声溶解;向上述溶液中加入3.5 mg Fe(以氯仿配制成浓度为7 mg/ml的溶液,500 μl),超声混匀后加入1 mg Cur粉末(以氯仿配制成浓度为2 mg/ml溶液,500 μl),超声混匀;移入茄形瓶中,加入3 ml去离子水,超声混匀;将茄形瓶置入旋转蒸发装置,以70℃水浴旋转蒸发至氯仿完全挥发;将茄形瓶置于磁铁上,吸附不稳定产物;以针管吸取1 ml样品,以0.22 μm滤膜过滤;最后以MES(15 mmol/L, pH 5.5)溶解。
1.2.2 制备KB修饰的Fe-Cur-KB纳米材料 取KB分子(以二甲基亚砜配制成浓度50 mg/ml溶液,10 μl)加入990 μl MES(15 mmol/l,PH 5.5)中,超声溶解,并取0.6 ml加入制备完成的Fe-Cur中,超声分散,室温孵育30 min;加入0.6 mg EDC(以MES配制成浓度10 mg/ml溶液,60 μl),室温避光过夜振荡孵育;采用100 KD超滤管,以纯水超滤2次,并浓缩至3 ml,使Fe浓度为1 mg/ml。
1.3 表征及稳定性测试 以X线透射电子显微镜观察Fe-Cur-KB磁性纳米材料的形态,Nano ZS90纳米激光粒度分析仪检测其水动力粒径和Zeta电位;将Cur及KB分别稀释为不同浓度(Cur:3、2、1、0.5 μg/ml;KB:33.33、6.67、3.33、1.33 μg/ml)溶液,利用紫外分光光度计测量其吸光度,绘制Cur及小分子KB的标准曲线,以10%乙腈溶液进行破乳、磁分离,之后收集上清测试载药量。向规格为35 mm的细胞培养皿中加入2 ml含血清不完全最小必需培养基(minimum essential medium, MEM)/F-12,随后依次加入10、50、100、200 μl Fe-Cur-KB原液,每个浓度重复2次,每日定时观察培养皿底部有无沉淀,连续观察7日。
1.4 细胞毒性实验 在MEM+10%胎牛血清培养基中维持MDCK细胞,待贴壁融合达80%~90%时将细胞消化、离心,加入培养基,稀释成浓度5×104/ml细胞悬液,混匀后加入96孔板,每孔100 μl;次日更换新的培养基,并依次加入10 μl浓度分别为0.90、0.50、0.20、0.10、0.05、0.02、0.01 mg/ml的Fe-Cur-KB磁性纳米材料,每个浓度设置3个复孔作为加药组,另取3个复孔加入10 μl培养基作为未加药组;于第3日更换新的培养基,并加入10 μl细胞计数试剂盒(cell counting kit-8, CCK-8)溶液,于培养箱中稳定30 min后,采用紫外分光光度计测量450 nm光密度(optical density, OD),计算细胞存活率(%)=(OD加药-OD空白)/(OD未加药-OD空白)×100%。OD加药为加入不同浓度材料的3个复孔OD均值;OD未加药为第2日加入10 μl培养基的3个复孔OD均值;OD空白为未加入任何物质的空白3个复孔OD均值。
1.5 BBB模拟实验 将MDCK细胞以每孔5×104个密度接种至12孔Transwell小室膜A室,每孔补液至500 μl;B室仅加入1 500 μl培养液,次日换液(图1)。接种后每日记录Transwell小室内细胞跨上皮电阻(transepithelial electrical resistance, TEER),绘制电阻-时间曲线图;待电阻稳定后弃去A、B室培养基,并用预先加热至37℃的磷酸盐缓冲液(phosphate buffer solution, PBS)洗涤2次,每次平衡10 min后弃去PBS,最后向A室加入500 μl培养基及100 μl Fe-Cur-KB作为实验组,并以600 μl培养基为对照组;B室均加入1 500 μl培养基,置于恒温培养箱中培养24 h,收集100 μl加药组和未加药组B室液体,置于酶标仪下测量OD。
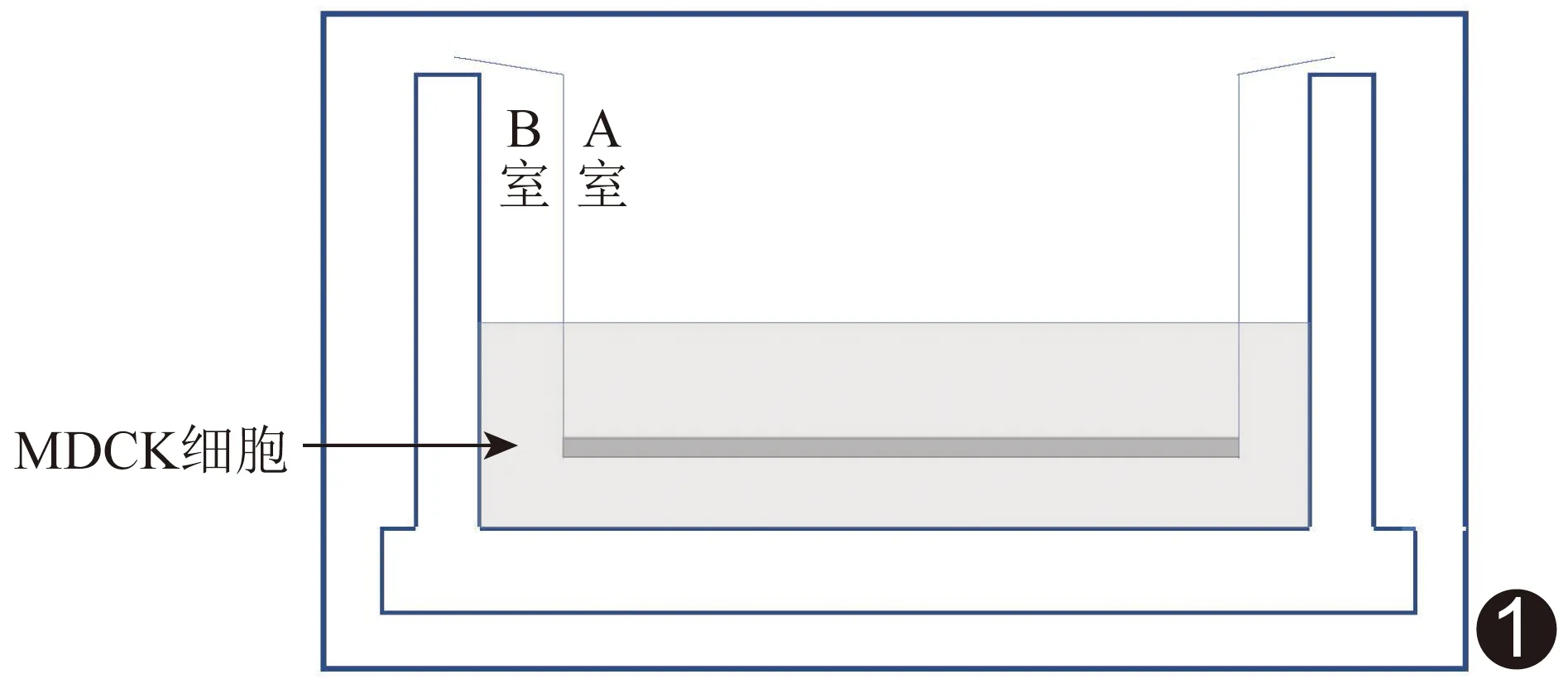
图1 Transwell小室模拟BBB实验示意图
1.6 体外成像实验 配置不同浓度(0.90、0.50、0.20、0.10、0.05、0.01 mg/ml)Fe-Cur-KB磁性纳米材料溶液,以MFG-1000体外磁场发生仪检测其成像情况。以Siemens Magnetom Verio 3.0T MR扫描仪、头颈线圈采集图像,参数:TR 600 ms,TE 15 ms,层厚2 mm,FOV 150 mm×150 mm。
1.7 靶向结合力实验 饲养APP/PS1模型鼠至6月龄,心脏灌流后制作冠状位脑切片,滴加兔源抗Aβ一抗(4G8、6E10),孵育过夜;次日以碱性磷酸酶标记的山羊抗兔IgG二抗孵育切片2 h,抗体稀释比均为1∶50;于暗室中以红色碱性磷酸酶底物工作液显色30 min,双蒸水清洗,以吸水纸吸干表面水渍,加入100 μl Fe-Cur-KB纳米溶液孵育过夜;第3日行普鲁士蓝染色,梯度脱水并封片后于光镜下观察Aβ斑块与纳米颗粒的共定位。
1.8 统计学分析 采用SPSS 20.0统计分析软件。以±s表示计量资料,行两独立样本t检验,比较2组B室溶液OD值差异。以单因素方差分析比较不同处理组细胞存活率。P<0.05为差异具有统计学意义。
2 结果
2.1 Fe-Cur-KB磁性纳米材料 成功构建出Fe-Cur-KB磁性纳米材料,合成示意图见图2。Fe-Cur-KB样品的水动力粒径和Zeta电位结果见表1。以溶剂蒸发法制备的磁性纳米颗粒粒径为26.93 nm,信号强、粒径较为均一,聚合物分散性指数(polymer dispersity index, PDI)较小,分散性较好。Cur颗粒表面携带负电荷,Fe-Cur-KB的Zeta电位约-17.3 mV(图3)。Cur及KB的标准曲线显示Cur载药量为0.3%,小分子KB载药量为5.7%。材料在电镜下呈约8~10 nm球形,形态均一,呈串珠状排列(图4),且稳定性较好。

表1 Fe-Cur和Fe-Cur-KB颗粒水动力粒径及Zeta电位
2.2 细胞毒性实验 0.90、0.50、0.20、0.10、0.05、0.02、0.01 mg/ml纳米溶液孵育下MDCK细胞存活率分别为98.34%、101.98%、101.03%、102.44%、95.64%、106.74%、95.14%,单因素方差分析显示组间细胞存活率差异无统计学意义(F=1.894,P>0.05)。
2.3 BBB模拟实验 模拟BBB实验第3日,TEER稳定>400 Ω/cm2,成功构建BBB模型(图5);第5日实验组B室液体OD值(3.11±0.02)明显高于对照组(2.84±0.12,t=4.028,P<0.05),纳米材料可成功通过BBB。
2.4 体外成像 不同浓度Fe-Cur-KB磁性纳米材料在体外磁场发生仪下的T2WI信号呈阶梯状,成像效果优异(图6)。
2.5 靶向结合力 通过一抗、二抗的特异性结合及携带红色碱性磷酸酶的底物显色液的显色,Aβ斑块呈红色;Fe-Cur-KB磁性纳米颗粒因携带铁核心,普鲁士蓝染色后呈蓝色。光镜下可见红色和蓝色重叠,即Aβ斑块与Fe-Cur-KB纳米颗粒存在共定位,颗粒可特异性结合Aβ斑块(图7)。

图2 Fe-Cur-KB磁性纳米材料合成示意图 A.KB探针分子式; B.Cur分子式; C.Fe-Cur-KB结构示意图(红色星为Cur,蓝色圈为修饰分子KB,黄色圆为磷脂分子疏水端,黑色圆为四氧化三铁核心颗粒)

图3 Fe-Cur(A)和Fe-Cur-KB(B)的Zeta电位图

图4 透射电镜图示Fe-Cur-KB磁性纳米粒子 A.4×105倍; B.5×105倍

图5 TEER变化趋势图

图6 不同浓度Fe-Cur-KB的体外MR成像
3 讨论
目前AD发病机制仍未完全明确,现有遗传学、病理学、细胞生物学证据均有力支持“Aβ中心理论”,即Aβ生成与清除障碍失衡所致Aβ沉积是AD发病的中心环节[5]。Aβ沉积引发其他因子参与完成AD临床或病理改变,诱导细胞内微管相关蛋白Tau蛋白高度磷酸化而形成NFT,导致微管失去正常结构,神经元骨架瓦解,进而造成突触神经元丢失[6-7]。
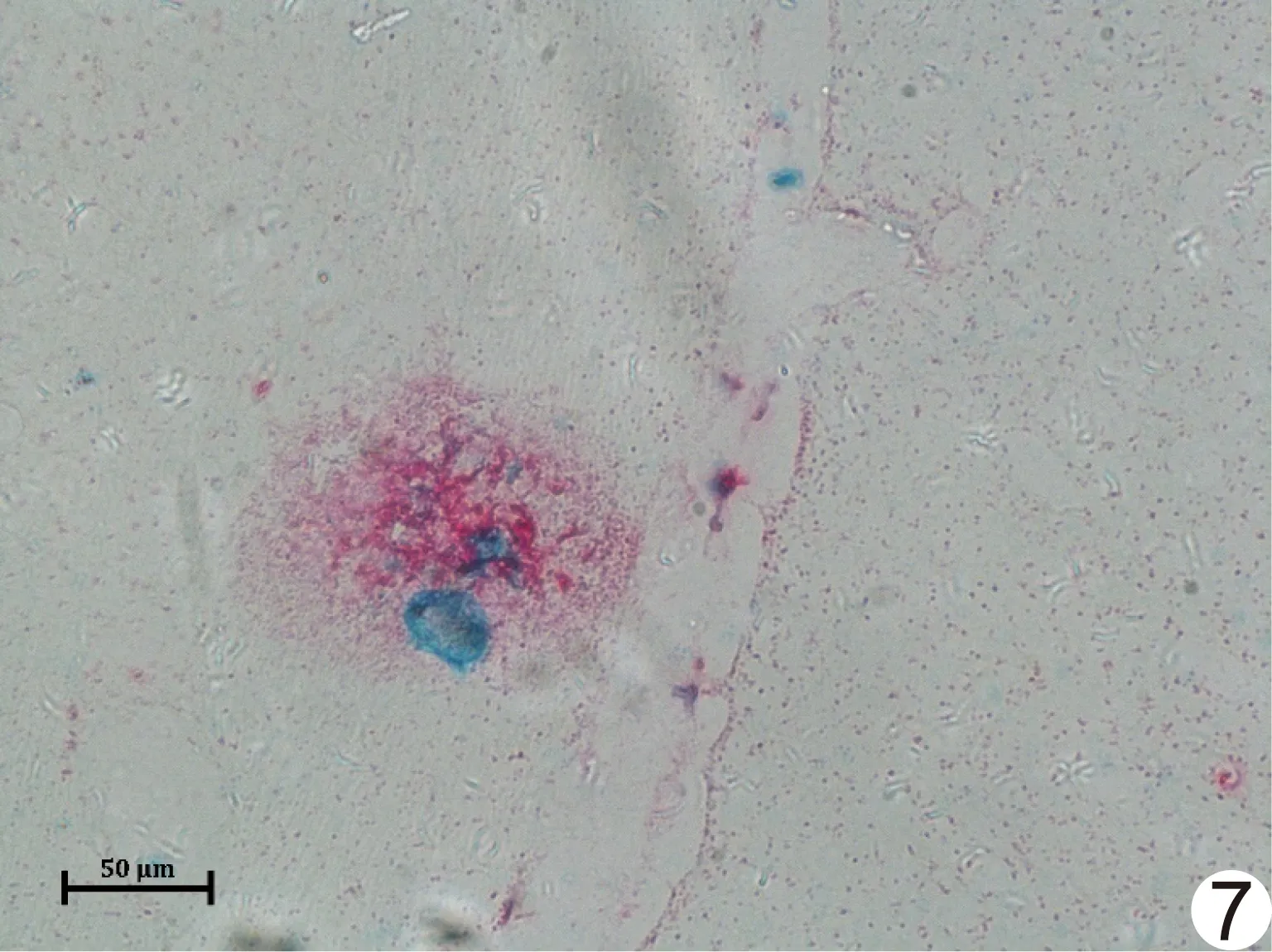
图7 APP/PS1转基因小鼠大脑切片免疫组织化学染色图(×200) (红色为Aβ斑块;蓝色为Fe-Cur-KB纳米颗粒染色)
当前确诊AD的方法仅有脑组织活检或尸检,以非侵入手段诊断AD则主要依赖各种量表评估认知,但常用简明精神状态量表及画钟测试等均存在语言偏倚或评分方法未能达成共识等问题[8]。以PET为代表的核医学技术可利用特异性结合Aβ的探针进行成像,实现AD病理特征在体可视化,其关键在于探针上可特异性识别并结合病理标记物的功能基团。Aβ聚合物之间存在β折叠,具有高度共轭芳香环且结构较为平面的1,3-硫氮杂茚和1,2-二苯乙烯可插入其中,形成能够特异性识别并结合Aβ的功能基团,即PET成像中显示淀粉斑块的核心结构[9]。但PET空间分辨率低,无法显示<2 mm的斑块,难以早期诊断AD。MR空间分辨率高于PET,且无电离辐射,是早期诊断AD的理想影像学手段之一。
传统MR对比剂无靶向性及特异性,且无法通过BBB。AD带来轻微BBB破坏,但渗漏的对比剂不足以引起MRI信号变化及显示AD病理变化。本研究采用溶剂蒸发法将Cur负载在PEG和四氧化三铁间的脂质环境下,使其稳定存在于复合材料中,依赖其表面羧基和PEG化四氧化三铁颗粒上的氨基,KB小分子通过EDC实现化学耦联,形成稳定的共价键(酰胺键),由此成功构建出安全性较好的Fe-Cur-KB磁性纳米材料;与传统对比剂相比,其最大优势在于具有通过BBB与Aβ靶向结合的能力,可在大脑中与Aβ特异性结合并形成信号差异,通过与周围正常组织对比,即可实现早期诊断AD。
Cur提取自姜黄根茎,是天然黄色素,可抗感染、抗氧化、降低淀粉负荷并阻止Aβ聚集[10]。既往研究[11]显示天然来源的Cur十分安全,即使摄入量达到4 g/d、持续半年,也未出现慢性不良反应。目前对于建立AD细胞模型方法存在较大争议,通常采用单一因素诱导细胞,与AD发病机制的复杂性不符。此外,Cur能否提高AD模型鼠的学习记忆能力尚需通过行为学实验进一步评估[12-13]。
总之,本研究构建的Fe-Cur-KB磁性纳米材料在体外表现出良好的生物相容性和稳定性,具有透过BBB并与Aβ靶向结合及MR成像能力,有望用于MR早期诊断AD。
