miR-574-3p在结直肠癌中的表达和作用机制研究
2021-05-11程雪婷罗和生万一圆陈小丽黄晓东
程雪婷, 罗和生, 占 婷, 万一圆, 陈小丽, 黄晓东
1.武汉大学中南医院消化内科,湖北 武汉 430071;2.武汉大学人民医院消化内科;3.武汉市第三医院(武汉大学附属同仁医院)消化内科
结直肠癌是一种对人体健康危害极大的恶性肿瘤。据统计,2015年我国城乡居民的大肠癌发病率在所有肿瘤中居第3位,死亡率居第5位[1]。微小RNA(microRNA,miRNA)是一类长18~25个核苷酸的单链非编码RNA,通过直接与mRNA的3’非编码区(3’-untranslated region,3’UTR)特定区域结合调控基因表达。miRNA在许多肿瘤中发挥癌基因或抑癌基因的作用。许多研究表明,miR-574-3p可参与调节肿瘤细胞的增殖[2]、凋亡[3]、迁移、侵袭[4]、肿瘤放化疗耐药[5]等生物学行为。Jin等[6]发现,过表达miR-574-3p可以抑制食管癌细胞的增殖、侵袭。Xin等[7]发现,circRNA_100782可以与miR-574-3p结合来调节Rb基因的表达从而影响胃癌细胞的增殖和侵袭能力。Della等[8]在对结直肠癌患者的石蜡包埋材料进行miRNA芯片分析发现,miR-574-3p在肿瘤组织标本中的表达显著低于配对的正常组织。然而,目前尚不清楚miR-574-3p是否参与结直肠癌的发生、发展。本研究通过检测结直肠癌患者组织和结直肠癌细胞系中miR-574-3p的表达情况,探索它在结直肠癌发生、发展中的作用。
1 材料与方法
1.1 临床标本收集收集人结直肠癌组织及对应癌旁组织11对,癌旁组织距离癌灶边界≥5 cm。样本来源于2019年4月至2019年12月武汉市第三医院胃肠外科行结直肠癌手术的患者。男5例,女6例,年龄45~66岁,平均年龄54岁。所有标本离体后立即用RNA保存液浸泡,置于4 ℃冰箱过夜,-80 ℃长期保存。经术后病理检查,均为结直肠癌。本研究经医院伦理委员会批准(武三医伦KY2019-012),所有研究对象均签署知情同意书。
1.2 结直肠癌细胞株人结直肠癌细胞株SW480、HCT-116、HCT-8均购自美国典藏细胞库(ATCC)。人原代结肠黏膜上皮细胞(HUM-d010)购自赛百慷(上海)公司。其中SW480细胞用不透气培养瓶及L-15培养基,置于37 ℃培养箱中恒温培养。HCT-116培养于McCOY’5A培养基,HCT-8培养于RIPA 1640培养基,置于37 ℃,体积分数为5%的CO2培养箱中恒温培养。HUM-d010用原代上皮细胞基础培养基培养。所有培养基中均加入质量浓度为100 g/L的胎牛血清及质量浓度为10 g/L的青-链霉素制成的完全培养基。
1.3 主要试剂和仪器L-15培养基、RIPA 1640培养基、McCOY’5A培养基、胎牛血清、胰酶、转染用OPTI-MEM培养基均购自美国Gibco公司;人原代结肠黏膜上皮细胞基础培养基购自赛百慷(上海)公司。miR-574-3p及U6引物、miR-574-3p mimic及相应对照mimic NC均购自锐博(广州)公司;RNA提取试剂TRIzol,转染试剂Lipofectamine3000购自Invitrogen(美国)公司;逆转录试剂盒购自TOYOBO(日本)公司;荧光定量PCR试剂盒购自康为世纪(北京)公司;CCK-8试剂盒购自美仑(大连)公司;EdU-488细胞增殖检测试剂盒购自碧云天(上海)公司;细胞周期和凋亡检测试剂盒购自联科(杭州)公司。荧光定量PCR扩增仪(BIO-RAD)购自美国伯乐公司。荧光倒置显微镜购自日本OLYMPUS公司;流式细胞仪购自美国BD公司。
1.4 检测方法
1.4.1 qRT-PCR检测miR-574-3p的表达:组织及细胞总RNA提取参照TRIzol试剂说明书进行。采用超微量紫外可见分光光度计检测RNA纯度和浓度,确保OD260/280在1.8左右,OD260/230为1.8~2.0,否则视为质量不合格的RNA。将质量合格的总RNA与逆转录试剂及特异性的miR-574-3p逆转录引物(U6作为内参)混合,反应体系如下:1 200 ng RNA用无RNA酶水补足至14 μl,特异性的逆转录引物1 μl,EnzymeMix 1 μl,5×Reaction buffer 4 μl,在20 μl反应体系中,37 ℃ 15 min,100 ℃ 5 min进行逆转。取4 μl逆转录产物cDNA与10 μl UltraSBR Mixture,miR-574-3p引物2 μl,4 μl ddH2O混合,在20 μl反应体系中,95 ℃变性10 min,95 ℃ 15 s,60 ℃ 60 s,40个循环,U6作为内参,miR-574-3p的相对表达量在组织中用2-ΔCt(以癌组织的表达量作为对照)计算,结直肠癌细胞系中用2-ΔΔCt(以HUM-d010细胞的表达量作为对照)计算。
1.4.2 结直肠癌细胞转染效果检测:取对数生长细胞HCT-8和HCT-116进行铺板,待细胞密度达80%融合后,按照Lipofectamine3000说明书将miR-574-3p mimic及相应对照mimic NC分别转染入孔板内,48 h后提取总RNA,进行荧光定量PCR扩增,检测结直肠癌细胞中miR-574-3p的mRNA表达水平。
1.4.3 CCK-8检测:细胞转染24 h后,将孔板内细胞用胰酶消化下来,在倒置显微镜下用细胞计数板进行计数,按6 000个细胞/孔在96孔板中接种细胞悬液(100 μl/孔),每组设5个副孔,24 h后向每孔加入CCK-8溶液10 μl(注意不要在孔内生成气泡),将培养板置于37 ℃,体积分数为5%的CO2培养箱内孵育3 h后,用酶标仪测定在450 nm处的吸光度值,记为第1天,在同一时间连续监测3 d。
1.4.4 EdU检测细胞的增殖能力:细胞转染24 h后,将孔板细胞用胰酶消化下来,按8 000个细胞/孔在96孔板中接种细胞悬液(100 μl/孔),每组设3个副孔。24 h后弃培养基,向每孔加入100 μl 37 ℃预热的2×EdU工作液(20 μm)和培养液的等体积混合液(用细胞完全培养基按500∶1稀释EdU(10 μm)可得2×EdU工作液),将培养板置于培养箱中继续孵育2 h;EdU标记细胞完成后,去除培养液,加入100 μl固定液(4%多聚甲醛),去除固定液,每孔用洗涤液(含3% BSA的PBS)洗涤3次,每次3~5 min,去除洗涤液,每孔用100 μl通透液(含0.3% Triton X-100的PBS),室温孵育10~15 min,去除通透液,每孔用100 μl洗涤液洗涤细胞1~2次,每次3~5 min,按照EdU-488细胞增殖检测试剂盒(上海碧云天)说明书推荐比例配制Click反应液,去除洗涤液,每孔加入Click反应液100 μl,室温避光孵育30 min,吸除Click反应液,洗涤液洗涤3次,每次3~5 min,可于荧光显微镜下观察,增殖细胞被标记了明亮绿色荧光。
1.4.5 克隆形成实验:细胞转染24 h后,将HCT-8和HCT-116两种细胞种植到6孔板中(每孔500个细胞),持续培养14 d,弃上清,将可见克隆用PBS洗涤2次(避免克隆脱落),用4%多聚甲醛(5 ml/孔),固定15 min,然后去除多聚甲醛固定液,适量1%结晶紫染色液染色20 min,结束后,清水洗涤培养板,晾干。肉眼或低倍镜下计数并拍照。
1.4.6 细胞凋亡检测:本实验采用Annexin V-FITC/PI双染色法。将HCT-8和HCT-116两种细胞分别分为NC组和mimic组。细胞转染48 h后,将其用胰酶消化收集至EP管中,800 r/min,离心5 min,收集细胞,弃培养基。用预冷PBS清洗细胞2次,800 r/min,离心5 min,收集细胞,弃上清。将细胞重悬于500 μl 1×Binding Buffer中,加入5 μl Annexin-V FITC和10 μl PI,混匀,室温避光孵育5 min,之后进行流式细胞术检测,1 h内完成上机检测。
1.4.7 细胞周期检测:细胞转染48 h后,收集2×105~1×106个细胞,1 000 r/min离心5 min,弃上清。用PBS洗涤1次,离心弃上清。加入1 ml DNA着色液和10 μl通透液,涡旋振荡5~10 s,混匀。室温避光孵育30 min,之后进行流式细胞术检测,1 h内完成上机检测。

2 结果
2.1 miR-574-3p在结直肠癌组织及结直肠癌细胞系中低表达qRT-PCR结果显示:miR-574-3p在结直肠癌组织中的表达低于配对的癌旁组织(P<0.001)(见图1A)。相较于HUM-d010,miR-574-3p的表达在3种结直肠癌细胞系中均下调(见图1B)(P<0.05)。

注:**P<0.01,***P<0.001。
2.2 结直肠癌细胞的转染效果检测对HCT-116和HCT-8细胞进行转染,转染mimic NC的细胞称为NC组,转染miR-574-3p mimic的细胞称为mimic组。各组均进行qRT-PCR检测,结果显示,miR-574-3p mimic组的miR-574-3p表达水平均高于NC组,其中HCT-8细胞表达水平升高322.8倍(P<0.05)(见图2A),HCT-116细胞的表达水平升高409.2倍(P<0.05)(见图2B)。表明两种结直肠癌细胞转染miR-574-3p mimic后分别显著上调了miR-574-3p的表达水平。

注:*P<0.05。
2.3 miR-574-3p抑制结直肠癌细胞的增殖能力
2.3.1 CCK-8法绘制HCT-116、HCT-8细胞生长曲线:在HCT-116、HCT-8中,miR-574-3p mimic相比于NC组的细胞增殖速度在第2天开始明显减弱,在第3天增殖速度的抑制能力得到增强,增殖能力差异有统计学意义(P<0.05)(见图3)。
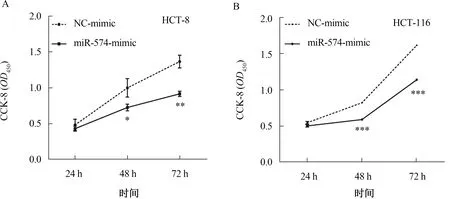
注:*P<0.05,**P<0.01,***P<0.001。
2.3.2 克隆形成实验结果:miR-574-3p mimic组克隆形成数少于NC组(见图4A)。结果表明:在HCT-116、HCT-8中,过表达miR-574-3p mimic的细胞增殖速度减弱,增殖能力差异有统计学意义(P<0.05)(见图4B~4C)。
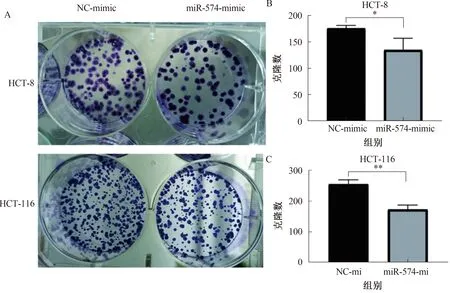
注:*P<0.05,**P<0.01。
2.3.3 EdU细胞成像实验结果:带绿色荧光的为增殖细胞,miR-574-3p mimic组的增殖细胞少于NC组(见图5A),结果表明,在HCT-116、HCT-8中,miR-574-3p mimic组相比于NC组的细胞增殖数量减少,增殖能力差异有统计学意义(P<0.05)(见图5B~5C)。

注:*P<0.05。
2.4 miR-574-3p促进HCT-116、HCT-8细胞凋亡在HCT-116、HCT-8中,miR-574-3p mimic组相比于NC组细胞,细胞凋亡数量增加(P<0.05)(见图6)。提示miR-574-3p可以促进HCT-116和HCT-8细胞凋亡。



注:*P<0.05,***P<0.001。
2.5 miR-574-3p使HCT-116、HCT-8的细胞周期发生变化在HCT-116、HCT-8中,miR-574-3p mimic组相比于NC组细胞,细胞的G0/G1期比例上升,G2期比例下降(P<0.05)(见图7)。提示miR-574-3p可以影响结直肠癌细胞周期,使细胞发生G0/G1期阻滞,G2期减少。

注:*P<0.05,**P<0.01,***P<0.001。
3 讨论
miRNA介导肿瘤的发生过程,包括炎症、细胞周期、分化、凋亡、迁移、侵袭等,其异常表达可能与肿瘤的发生和发展相关。我们的研究显示,miR-574-3p在结直肠癌组织和结直肠癌细胞系中均下调,过表达miR-574-3p可抑制人结直肠癌细胞的体外增殖,促进其凋亡,使其发生G0/G1期阻滞。这表明miR-574-3p可能作为抑癌基因参与结直肠癌的进展。
目前结直肠癌的筛查方法很有限,粪便潜血实验和粪便常规检查对于诊断结直肠癌的癌前病变灵敏性较低,此外,常用于诊断结直肠癌的血清生物标志物是CEA和CA199,其诊断的特异性和灵敏性均较低。由于缺乏理想的无创诊断方法,以及中晚期才出现临床表现,导致许多结直肠癌患者在相对较晚的时间被确诊,这是结直肠癌患者死亡率较高的原因之一。因此,临床上迫切需要发现可用于结直肠癌筛查、诊断和预后判断的分子标志物。结直肠癌患者粪便、血清以及肿瘤样本中的表达异常的miRNA可能作为潜在的无创诊断结直肠癌的分子标志物在结直肠癌筛查诊断、预后判断中发挥作用。Wu等[9]发现,与正常患者相比较,miR-21和miR-92a在结直肠癌患者的粪便中表达上调,在诊断结直肠癌中表现出较好的特异性和灵敏性。Hur等[10]研究发现,结直肠癌患者的血清miR-203水平显著上调且miR-203高表达患者的肿瘤转移率更高、生存率更低,表明miR-203是可用于预后和转移预测的潜在生物标志物。基于以上报道,我们还将进一步研究miR-574-3p在血浆和粪便样本中的表达水平,以及其与结直肠癌肿瘤分期与转移的关系,评估miR-574-3p在诊断和预后判断中的价值,以期为临床诊断和治疗带来新的思路。
综上,本研究发现,miR-574-3p在结直肠癌组织和细胞系中均低表达,过表达miR-574-3p可抑制结直肠癌细胞增殖、促凋亡,使细胞发生G0/G1期阻滞。然而关于miR-574-3p在血清和粪便标本中的表达情况,以及其与肿瘤分期和预后的关系有待进一步研究。
