莪术醇下调FoxD2-AS1逆转胶质瘤细胞替莫唑胺化疗耐药的作用研究
2021-05-11
浙江中医药大学生命科学学院 杭州 310053
胶质瘤是最常见的中枢神经系统(central nervous system,CNS)原发性恶性肿瘤之一,约占所有颅内肿瘤的40%[1]。目前临床上普遍采用肿瘤切除和辅助放化疗的治疗方案。替莫唑胺(Temozolomide,TMZ)是公认的治疗胶质瘤的一线化疗药物,但有相当一部分患者会对TMZ表现出不同程度的原发性和获得性耐药,最终导致化疗失败[2]。
长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200nt的非编码RNA,又称长非编码RNA。研究发现,lncRNA在癌症的多种生物学行为中扮演重要角色,能够影响癌症的发展和走向[3-4]。近年来研究证实,部分lncRNA与胶质瘤的发生发展有关,可发挥抑癌基因的作用[5];还有一些lncRNA的表达与胶质瘤的化疗耐药及预后密切相关[6-7]。相关研究已证实,lncRNA FoxD2-AS1基因参与胶质瘤的发生和发展,以O6-甲基鸟嘌呤-DNA甲基转移酶(methylation ofO6-methylguanine-DNA methyltransferase,MGMT)依赖的方式促进胶质瘤TMZ耐药,可作为胶质瘤的预后因子[8]。
近年来,中药因其不良反应小、疗效明确的优点备受关注。莪术醇(curcumol)是中药莪术挥发油中提取的有效单体成分,具有抗菌、抗炎、抗肿瘤、抗病毒等功效[9-10]。研究证实,莪术醇能够显著抑制胶质瘤细胞生长并促进凋亡[11]。
基于此,本研究在体外培养胶质瘤耐药细胞A172/TMZ和U251/TMZ,探究lncRNA FoxD2-AS1在胶质瘤细胞TMZ耐药过程中的作用,并检测不同浓度莪术醇对耐药细胞内FoxD2-AS1含量的影响,探究莪术醇与胶质瘤TMZ耐药以及FoxD2-AS1表达的相关性。
1 材料和方法
1.1 材料
1.1.1 细胞株和短片断干扰RNA(small interfering RNA,siRNA) 人脑胶质瘤细胞系U251、A172均购于美国模式培养物集存库(American Type Culture Collection,ATCC)。si-FOXD2-AS1由百奥生物技术有限公司合成,siRNA序列:上游5′-GCGAAGAGUACGUUGCUAUTT-3′,下 游5′-AUAGCAACG UACUCUUCGCTT-3′。
1.1.2 主要试剂 替莫唑胺、莪术醇均购于安诺伦生物科技有限公司(货号:HY-17364/CS-0943、HYN0104);Lipofectamine 2000购于美国Invitrogen公司(批号:2067406);噻唑蓝(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,MTT) 粉购于Sigma公司(批号:11465007001);达尔伯克改良伊格尔高糖培养基(Dulbecco's modified eagle medium-high glucose,DMEM-HG)购于天津市灏洋生物制品科技有限公司(批号:TBD10569);新生小牛血清购于浙江天杭生物科技股份有限公司(批号:20170106);青-链霉素溶液购于吉诺生物医药技术有限公司(批号:1812110207);4%多聚甲醛购于广州赛国生物科技有限公司(批号:1807213);TRIzol试剂购于美国Thermo Fisher公司(批号:135404);异丙醇购于上海麦克林生化科技有限公司(批号:M54318067);逆转录试剂盒购于TaKaRa公司(批号:A4301-1);RNaseA、UltraSYBR Mixture均购于北京康为世纪生物科技有限公司(批号:50423、30237);细胞凋亡与坏死检测试剂盒购于上海碧云天生物技术有限公司(批号:C1056);二甲基亚砜(dimethyl sulfoxide,DMSO)购于湖北盛齐安生物科技股份有限公司(批号:1129E036)。
1.1.3 主要仪器 TE2000荧光倒置显微镜为Nikon公司产品;5541R高速冷冻离心机购于德国Eppendorf公司;SW-CJ-2FD双人单面垂直净化工作台购于苏净集团苏州安泰空气技术有限公司;二氧化碳培养箱、流式细胞仪、荧光定量PCR仪、金属浴均购于美国Thermo Fisher公司。
1.2 方法
1.2.1 数据库和生物信息学分析 对来自癌症和肿瘤基因组图谱(cancer genome atlas,TCGA)和中国脑胶质瘤基因组图谱(Chinese glioma genome atlas,CGGA)的胶质瘤基因表达数据进行生物信息学分析,比较FoxD2-AS1在正常胶质细胞与胶质瘤组织中的表达量。采用Kaplan-Meier法计算生存率,以logrank检验生存率差异。
1.2.2 耐药细胞系的建立 经脉冲加药建立A171/TMZ、U251/TMZ耐药细胞系,构建方式采用经典的间歇诱导法[12],以MTT法分别检测U251/TMZ、A172/TMZ及其母本细胞对TMZ的耐药程度,计算TMZ对各细胞系的半数抑制浓度(half inhibitory concentration,IC50)。
1.2.3 脂质体转染 分别用无血清无双抗培养基稀释脂质体和siRNA,轻轻混匀并室温孵育20min后,将混合物加入耐药细胞的培养孔中,于培养箱中培养4~6h后,将培养基换为正常DMEM培养基,将该组别设置为siRNA干扰组。另设置转染阴性对照siRNA的阴性对照组作为对照。
1.2.4 实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,RT-qPCR)检测转染效率 实验分为阴性对照组(转染阴性对照siRNA)、siRNA干扰组(转染FoxD2-AS1基因siRNA)。使用TRIzol提取RNA,检测RNA纯度后,进行逆转录,得到cDNA产物。根据试剂盒说明书进行RT-qPCR反应,以β-actin为内参,测定lncRNA FoxD2-AS1在胶质瘤耐药细胞中的表达水平。反应体系如下:cDNA 1μL,2×UltraSYBR Mixture 12.5μL,正反向引物各1μL,ddH2O 9.5μL,总计50μL。反应条件如下:95°C预变 性 10min;95°C 15s,60°C 1min,35个循环;95°C 15s,60°C 1min,95°C 15s,60°C 15s。采用2-△△Ct法计算FoxD2-AS1表达水平。
1.2.5 流式细胞仪检测细胞凋亡 收集siRNA干扰组和阴性对照组细胞,以5×104个细胞/孔的数量接种于24孔板,分别以0、20、40mg·mL-1的TMZ处理48h。胰酶消化后收集细胞,分别加入碘化丙啶(propidium iodide,PI)/Annexin Ⅴ,室温避光染色15min,流式细胞仪检测细胞凋亡。
1.2.6 流式细胞仪检测细胞周期 收集处于对数生长期的耐药细胞,加入预冷的70%乙醇,4°C固定过夜,弃去上清液,以磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤2次,离心5min,弃去上清液。每管细胞样品分别加入染色缓冲液500μL、1mg·mL-1的RNaseA溶液7.5μL和PI染液3μL后,避光37°C金属浴30min,上机检测A172/TMZ和U251/TMZ耐药细胞的细胞周期分布。
1.2.7 药物相互作用分析 取对数生长期的两种耐药细胞,调整细胞密度为5×104个/mL,吸取100μL细胞至96孔板中,培养6h后,计算TMZ和莪术醇的IC50值,得出TMZ的IC50是69μg·mL-1,莪术醇的IC50是89μg·mL-1,TMZ和莪术醇的浓度设置均为其IC50的0、1/8、1/4、1/2、1。固定TMZ的浓度为0、8.625、17.25、34.5、69μg·mL-1,分别与不同浓度的莪术醇组合处理耐药细胞,每组分别进行3次实验并取平均值,确定量效曲线。采用相互作用指数(combination index,CI)来判断两药联用效果,CI=莪术醇在混合药物中的IC50/莪术醇单独IC50+TMZ在混合药物中的IC50/TMZ单独IC50。若CI>1则说明两药拮抗,若CI=1说明两药相加,若CI<1则说明两药有协同作用。
1.2.8 Hoechst染色观察不同浓度莪术醇和TMZ对两种耐药细胞形态的影响 研究共分6组:A组(空白对照组)为不加药的耐药细胞;B组为10μg·mL-1莪术醇组;C组为40μg·mL-1莪术醇组;D组为40μg·mL-1TMZ组;E组为10μg·mL-1莪术醇和40μg·mL-1TMZ组;F组为40μg·mL-1莪术醇和40μg·mL-1TMZ组。吸尽培养基,加0.5mL固定液固定20min。PBS洗涤2~3次,加入染色液300μL/孔,染色15min,PBS洗涤2~3次,最后在紫外线(ultraviolet,UV)下镜检观察。
1.2.9 RT-qPCR测定莪术醇对耐药细胞的FoxD2-AS1含量的影响 研究分为6组:不加莪术醇的两种胶质瘤耐药细胞作为对照组;不同浓度莪术醇(20、40μg·mL-1)分别处理的U251/TMZ和A172/TMZ耐药细胞,处理24、48、72h后,收集细胞,进行总RNA提取和cDNA合成,根据RT-qPCR试剂盒说明书进行PCR反应,以β-actin为内参,以PCR仪进行定量分析,方法同1.2.4。采用2-△△Ct法计算FoxD2-AS1表达水平。将PCR结果中2-ΔΔCt值>2的组别设为FoxD2-AS1高表达组,而2-ΔΔCt值≤2为非FoxD2-AS1高表达组。
1.3 统计学分析 采用SPSS 22.0统计软件和Graph-Pad Prism 8.0绘图软件进行统计学分析,计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 FoxD2-AS1基因表达与患者预后的关系 通过GraphPad Prism软件对数据进行统计分析发现,与正常胶质细胞比较,FoxD2-AS1在低级别胶质瘤组织中高表达(P<0.01),在多形恶性神经胶质瘤组织中极高表达(P<0.001);与低级别胶质瘤比较,FoxD2-AS1在多形恶性神经胶质瘤组织中高表达(P<0.01)。CGGA库数据分析显示,多形恶性神经胶质瘤FoxD2-AS1表达量显著高于低级别胶质瘤(P<0.001)和血管中心型胶质瘤(P<0.01)。见图1A和B。
CGGA数据进一步分析显示,FoxD2-AS1表达量高的患者总生存率低,FoxD2-AS1表达量低的患者生存率较高。见图1C。RT-qPCR结果表明,胶质瘤细胞中FoxD2-AS1的表达量均高于正常胶质细胞(P<0.05,P<0.01),且耐药细胞中FoxD2-AS1的表达量显著高于母本细胞(P<0.05,P<0.01)。见图1D。以上结果提示,FoxD2-AS1的表达与胶质瘤发病及患者预后密切相关。
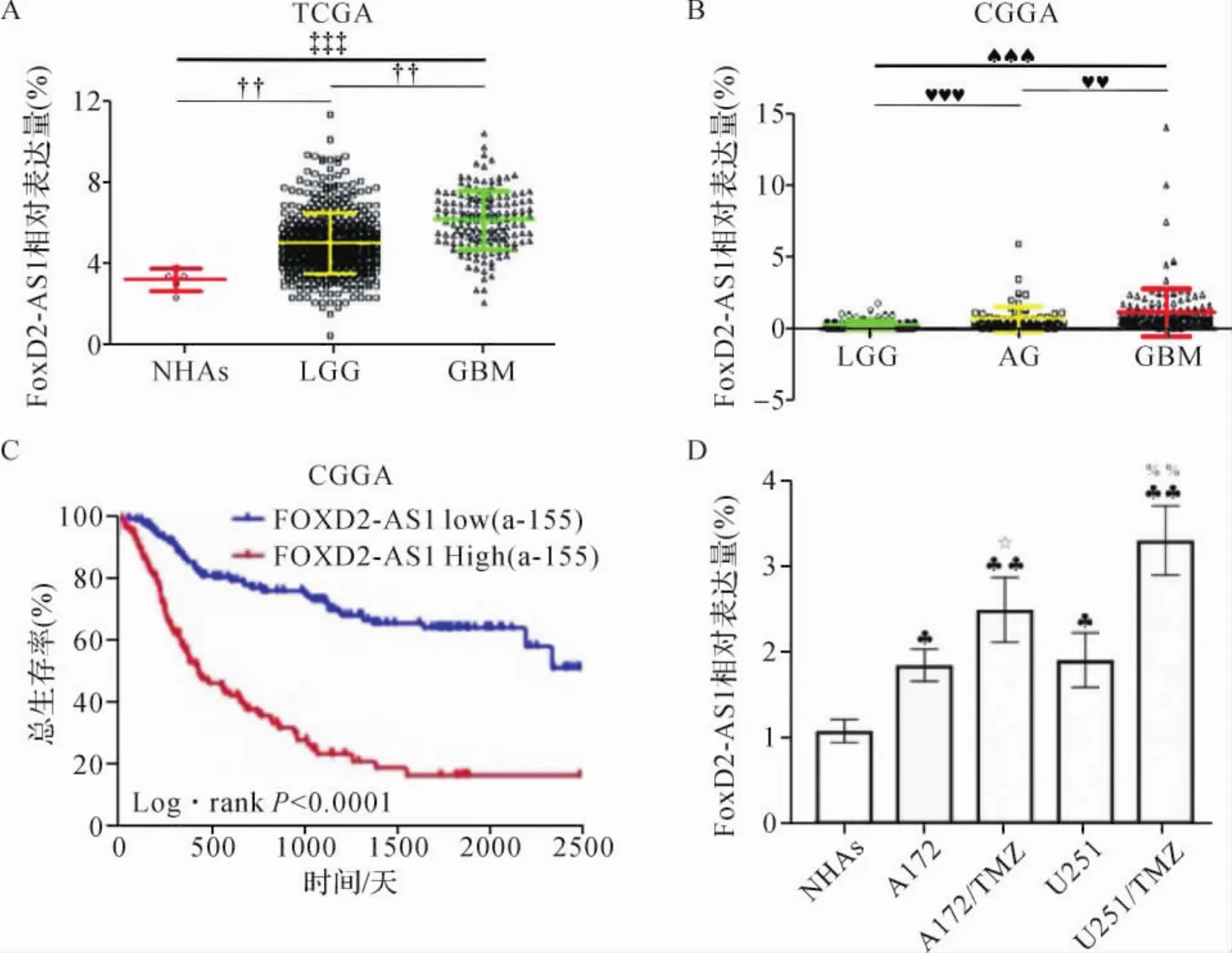
图1 FoxD2-AS1与胶质瘤的关系Fig.1 Relationship between FoxD2-AS1 and glioma
2.2 FoxD2-AS1的表达对胶质瘤细胞TMZ耐药的影响 与同种细胞的阴性对照组比较,20、40μg·mL-1的TMZ诱导后,siRNA干扰组细胞的凋亡率显著提高(P<0.05,P<0.01)。见表1。暗示FoxD2-AS1的表达与胶质瘤细胞TMZ耐药相关。
表1 FoxD2-AS1表达对A172/TMZ和U251/TMZ耐药细胞凋亡的影响(±s,%)Tab.1 Expression of FoxD2-AS1 on apoptosis of A172/TMZ and U251/TMZ cells(±s,%)

表1 FoxD2-AS1表达对A172/TMZ和U251/TMZ耐药细胞凋亡的影响(±s,%)Tab.1 Expression of FoxD2-AS1 on apoptosis of A172/TMZ and U251/TMZ cells(±s,%)
注:与A172/TMZ细胞阴性对照组比较,*P<0.05,**P<0.01;与U251/TMZ细胞阴性对照组比较,△P<0.05Note:Compared with negative control group of A172/TMZ cells,*P<0.05,**P<0.01;compared with negative control group of U251/TMZ cells,△P<0.05
A172/TMZ细胞TMZ 浓度(μg·mL-1)U251/TMZ细胞阴性对照组 siRNA干扰组 阴性对照组 siRNA干扰组0 5.71±0.98 5.58±0.92 5.03±0.97 4.01±1.09△20 7.30±0.48 18.00±2.36* 9.75±1.40 12.71±1.07△40 12.77±1.54 25.20±1.47** 17.54±1.54 20.42±1.01△
A172/TMZ和U251/TMZ细胞siRNA干扰组处于G0/G1期的细胞比例均低于相应的阴性对照组,而处于S期和G2/M期的细胞比例明显高于阴性对照组,差异有统计学意义(P<0.05,P<0.01)。见图2。

图2 A172/TMZ、U251/TMZ阴性对照组和siRNA干扰组细胞周期比较Fig.2 Comparison of cell cycle of A172/TMZ and U251/TMZ cell in negative control group and siRNA interference group
2.3 莪术醇逆转胶质瘤TMZ化疗耐药 联合实验结果表明,莪术醇在0~90μg·mL-1、TMZ在0~69μg·mL-1的剂量范围内,TMZ与莪术醇合用能显著抑制胶质瘤细胞增殖,并呈现一定的剂量依赖关系,两种细胞均有类似现象可初步确定莪术醇和TMZ具有协同作用,提示莪术醇对TMZ耐药的逆转作用。见图3。

图3 莪术醇和TMZ联用的效价图Fig.3 The titer chart of curcumol in conjunction with TMZ
空白对照组细胞经Hoechst染色发出均匀的淡蓝色荧光,细胞核无明显的凋亡形态学变化;用莪术醇处理细胞,可见细胞密度减少,核染色质浓缩聚集、核破碎、核边集,随着莪术醇浓度增加而更加明显。同时发现40μg·mL-1莪术醇+40μg·mL-1TMZ组效果最明显,可见细胞核发出较强的蓝色荧光,内部呈亮白色,表现出细胞凋亡核固缩的典型变化。见图4。
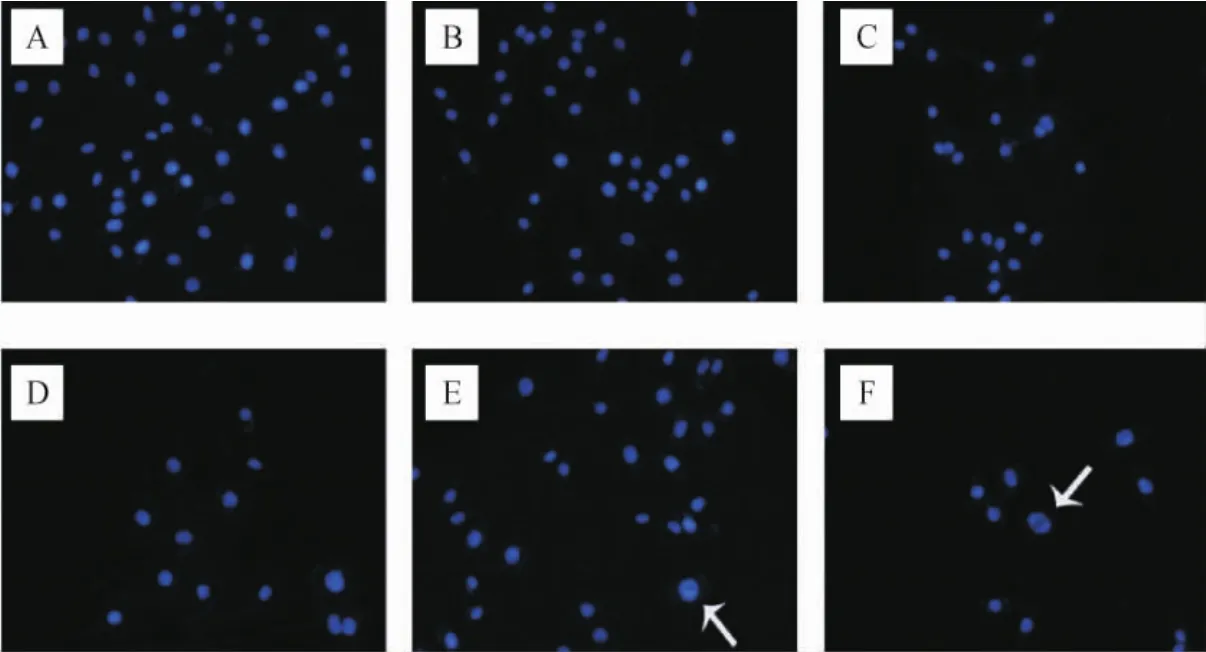
图4 不同浓度药物及联合作用下对A172/TMZ细胞凋亡的影响(Hoechst染色,200×)Fig.4 Effects of different concentrations of drugs and combined uses on A172/TMZ cell apoptosis(Hoechst staining,200×)
2.4 莪术醇对FoxD2-AS1表达的影响 RT-qPCR结果显示,在同一时间段里随着莪术醇浓度的升高,FoxD2-AS1的相对表达量下降,下降程度呈明显剂量依赖性(P<0.05,P<0.01);在同一浓度莪术醇作用下,与培养24h比较,培养48h和72h的细胞FoxD2-AS1的相对表达量下降程度更明显(P<0.05,P<0.01)。见图5。结果表明莪术醇能够抑制胶质瘤A172/TMZ和U251/TMZ耐药细胞中FoxD2-AS1的表达,呈现明显的浓度依赖性,并与作用时间呈正相关性。
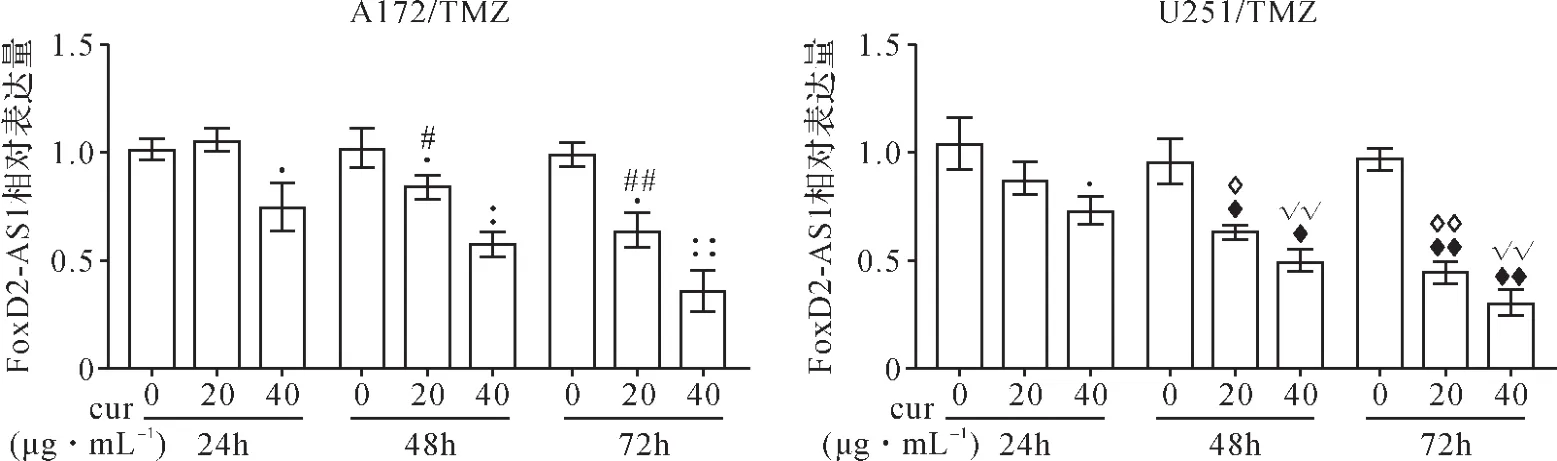
图5 莪术醇处理后耐药细胞内FoxD2-AS1含量的变化Fig.5 Changes of FoxD2-AS1 content in resistant cells treated with curcumol
3 讨论
胶质瘤是中枢神经系统的原发性恶性肿瘤,其发病率、致死率均位于颅内肿瘤榜首,患者预后极差[13]。在胶质瘤的临床治疗过程中,TMZ是公认的一线药物,然而TMZ耐药极大限制了其治疗胶质瘤的疗效。如何降低耐药成为临床治疗亟待解决的问题。本研究通过生物信息学技术手段,发现FoxD2-AS1在多形恶性神经胶质瘤中表达量较高,且高表达FoxD2-AS1的患者总生存率较低,暗示FoxD2-AS1参与不良预后。通过建立TMZ耐药细胞系,本研究发现FoxD2-AS1在TMZ耐药细胞中高表达,提示FoxD2-AS1的表达可能与胶质瘤TMZ耐药相关。
中药是我国传统文化的瑰宝,寻找新型、高效、低毒的中药将成为提高肿瘤治疗疗效的突破口。中医理论认为莪术味辛、苦,性温,具有行气破血、消积止痛的功效,而莪术醇作为莪术挥发油中提取的成分,具有抗病毒、抗菌、抗炎、抗肿瘤等生物活性,且能够对胶质瘤细胞增殖起到抑制作用[14-15]。
而随着高通量技术的不断发展,越来越多的研究证实lncRNA可以在转录、转录后、表观遗传等方面发挥重要的生物学功能,如Gu等[16]报道沉默lncRNA FoxD2-AS1可以通过microRNA-98-5p/胞质聚腺苷化元件结合蛋白4(cytoplasmic polyadenylation element bindingprotein 4,CPEB4)轴促进胶质瘤耐药细胞的凋亡。然而FoxD2-AS1与胶质瘤耐药及莪术醇之间的关系目前尚不明确。本实验结果表明,干扰FoxD2-AS1后,耐药细胞凋亡率增高,细胞周期主要停滞在S期和G2/M期,暗示FoxD2-AS1基因可能通过调控胶质瘤细胞的周期和凋亡过程而参与胶质瘤的发生发展以及TMZ耐药。大量研究表明,胶质瘤TMZ耐药是多分子参与的复杂过程[17],目前研究较多的是DNA损伤修复、多药耐药、凋亡通路异常、胶质瘤干细胞学说等[18]。而本研究的结果提示lncRNA也可能参与了TMZ的耐药过程。
莪术醇是莪术油的抗肿瘤活性成分,在不同肿瘤中均已证实,莪术醇能够抑制肿瘤细胞的增殖,还能够通过激活抑癌基因或抑制原癌基因,抑制肿瘤的发生发展,如通过第10号染色体缺失磷酸酶及张力蛋白同源基因/磷脂酰肌醇3激酶/蛋白激酶B(gene of phosphatase and tension homology deleted on chromsometen/phosphatidylinositol3 kinase/protein kinase B,PTEN/PI3K/Akt)途径降低肿瘤细胞中miR-21的含量,从而起到抑癌作用[19]。莪术醇还能够阻滞细胞周期,抑制肿瘤细胞增殖,如研究证实莪术醇可以通过活性氧和蛋白激酶B/糖原合成酶激酶3β/细胞周期蛋白D1(protein kinase B/glycogen synthase kinase 3β/cyclin D1,Akt/GSK3β/cyclin D1)途径诱导结肠癌细胞的细胞周期停滞[20]。本研究发现,莪术醇处理耐药细胞后,耐药细胞内FoxD2-AS1的含量明显下降,且具有浓度和时间依赖性,提示莪术醇可能通过抑制FoxD2-AS1的表达,从而提高胶质瘤耐药细胞对TMZ的敏感度。实验证明,莪术醇能够抑制不同肿瘤细胞中磷酸化Akt和磷酸化PI3K蛋白的表达[21],由此笔者推测莪术醇也可能通过Akt/PI3K通路诱导胶质瘤细胞凋亡。
综上所述,本研究发现FoxD2-AS1与胶质瘤细胞TMZ化疗耐药有关,干扰FoxD2-AS1后可以诱导耐药细胞周期阻滞,促进细胞凋亡;莪术醇可通过下调耐药细胞中FoxD2-AS1的含量来提高耐药细胞对TMZ的敏感度。这一发现为胶质瘤TMZ耐药的临床治疗提供了新思路。
