苦杏仁苷对肺心病大鼠呼吸衰竭的改善及对EGFR/MAPK信号通路的调控作用
2021-05-11
郑州大学第一附属医院 郑州 450000
肺心病是由于支气管-肺、胸廓或肺动脉病变,引起肺循环阻力增加,导致肺动脉高压和右心室肥大的一种疾病[1]。肺动脉高压引起的肺血管重塑是肺心病发病的主要病理生理基础,发病过程中存在持续性、进展性气流受限,导致患者出现严重通气功能障碍,最终发生呼吸衰竭,严重威胁患者生命[2]。苦杏仁是我国传统中药,具有降气止咳平喘、润肠通便之功效,苦杏仁苷是苦杏仁的有效成分之一,是一种含氰基的糖苷类化合物,广泛存在于桃、李、杏等多种植物的果实和种子中,临床上常用于祛痰止咳及辅助性抗肿瘤治疗[3]。研究显示,苦杏仁苷具有治疗呼吸系统疾病的作用,可改善咳喘、肺纤维化、慢性阻塞性肺病等引起的肺损伤[4]。基于苦杏仁苷的抗肺损伤作用,本研究拟采用苦杏仁苷治疗肺心病大鼠,旨在探讨苦杏仁苷对肺心病大鼠呼吸衰竭的影响并探讨其作用机制,为开发治疗肺心病的药物提供实验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 无特定病原体(specific pathogen free,SPF)级雄性SD大鼠50只,7周龄,平均体质量(200±20)g,购于北京维通利华实验动物技术有限公司[实验动物生产许可证号码:SCXK(京)2016-0006]。大鼠购入后饲养于郑州大学药物研究院[实验动物使用许可证号码:SYXK(豫)2018-0004],保持温度(23±2)℃,湿度(50±5)%,明暗周期12h/12h循环,实验前所有大鼠适应性饲养1周。
1.1.2 药物、主要试剂和仪器 苦杏仁苷购于美国Sigma公司(批号:AS36514);盐酸纳洛酮注射液购于北京凯因科技股份有限公司(剂量:10mL/4mg,国药准字:H20064788);大鼠白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒均购于碧云天生物技术有限公司(批号:170916、171125);兔抗大鼠表皮生长因子受体(epidermal growth factor receptor,EGFR)单抗、磷酸化表皮生长因子受体(phosphorylation-epidermal growth factor receptor,p-EGFR) 多抗、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)多抗、磷酸化p38丝裂原活化蛋白激酶(phosphorylation-p38 mitogen-activated protein kinase,p-p38MAPK)多抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔二抗均购于美国Abcam公司(批号:ab32077、ab227515、ab31828、ab38238、ab6721)。G-100型血气分析仪购于深圳市西尔曼科技有限公司;小动物肺功能检测仪购于北京广源达科技发展有限公司;680型全自动酶标仪购于美国Bio-rad公司;DYCP-31DN型电泳仪购于北京六一仪器厂;自动发光凝胶成像系统购于英国SYNGENE公司。
1.2 方法
1.2.1 建模、分组及干预方法 将50只大鼠随机分为正常对照组、模型组、苦杏仁苷低剂量组、苦杏仁苷高剂量组和阳性对照组,每组各10只。除正常对照组外,其余4组大鼠建立肺心病模型[5]。将大鼠置于常压低氧舱内,通过充入氮气,使舱内氧气浓度保持在8%~11%,以无水氯化钙和碱石灰吸收舱内水分和二氧化碳(carbon dioxide,CO2),使CO2浓度低于3%。4组大鼠每天置于舱内8h,每周6d,共计4周。根据动物与人体等效剂量换算,从入舱第1天开始,模型组、苦杏仁苷低剂量组、苦杏仁苷高剂量组和阳性对照组大鼠每天入舱前半小时分别腹腔注射0.9%氯化钠注射液0.5mL、10mg·kg-1苦杏仁苷、20mg·kg-1苦杏仁苷和1.0mg·kg-1盐酸纳洛酮注射液。正常对照组大鼠不入舱,腹腔注射0.9%氯化钠注射液0.5mL/只,1次/d,每周6d,共计4周。
1.2.2 肺功能相关指标检测 末次干预后12h,使用小动物肺功能检测仪检测各组大鼠肺功能相关指标,记录大鼠呼吸频率、呼气阻力、呼气峰流速值(peak expiratory flow,PEF)和50%肺活量时最大呼气流量(50% forced expiratory flow,FEF50)。
1.2.3 动脉血气相关指标及血清IL-8、TNF-α水平检测 肺功能检测结束后,采用3%戊巴比妥钠40mg·kg-1腹腔注射麻醉大鼠,经股动脉采血,3 500r/min离心10min,离心半径10cm,分离血清,一部分血清使用全自动血气分析仪检测氢离子浓度(potential of hydrogen,pH)、氧分压(partial pressure of oxygen,PaO2)、二氧化碳分压(partial pressure of carbon dioxide,Pa-CO2)。其余血清采用ELISA法检测IL-8、TNF-α水平,反应结束后使用酶标仪于450nm波长读取吸光度值,根据标准曲线计算血清IL-8、TNF-α水平。
1.2.4 血流动力学及右心室肥厚情况检测 采血结束后,将大鼠仰卧固定,颈部备皮后行正中切口,分离颈部右侧皮肤,游离颈外静脉,结扎远心端,行右心室插管术,记录大鼠肺动脉压力和颈总动脉压力波形,检测平均肺动脉压(mean pulmonary artery pressure,mPAP)和平均颈动脉压(mean carotid arterial pressure,mCAP)。检测后处死大鼠,迅速开胸,摘除心脏,以0.9%氯化钠注射液冲洗干净后,分离右心室(right ventricle,RV)和左心室+室间隔(left ventricle+septum,LV+S),分别称重后计算右心指数,右心指数(%)=RV/(LV+S)。
1.2.5 肺组织病理形态学变化观察 处死大鼠,分离肺组织,左肺置于4%多聚甲醛中固定48h,二甲苯脱脂,梯度乙醇脱水,石蜡包埋后行4μm切片,常规苏木精-伊红(hematoxylin-eosin,HE)染色,脱水、透明后中性树胶封片,光镜下观察肺组织病理学变化。
1.2.6 Western blot检测肺组织EGFR、p-EGFR、p38MAPK、p-p38MAPK蛋白相对表达水平 肺组织分离操作同1.2.5,右肺液氮冻存。取液氮冻存的肺组织80mg,加入放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)裂解液,冰上研磨,离心取上清液,以二喹啉甲酸(bicinchoninic acid,BCA)法测定总蛋白浓度,蛋白样品加入上样缓冲液,100℃水浴变性,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),电泳结束后转膜,5%脱脂牛奶封闭2h,加入EGFR、p-EGFR、p38MAPK、p-p38MAPK一抗(稀释比例均为1:2 000),4℃孵育过夜,洗膜后加入HRP标记的IgG二抗(稀释比例:1:5 000),室温孵育2h,洗膜后滴加电化学发光(electrochemiluminescence,ECL)液,显影、定影。采用Image J软件扫描分析各蛋白灰度值,以β-actin为内参基因,计算各组目的蛋白相对表达水平。
1.3 统计学分析 采用SPSS 25.0统计软件进行统计学分析,计量资料以±s表示,多样本计量资料组间比较采用单因素方差分析,两两样本比较采用最小显著差异法(least significant difference,LSD)-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺功能相关指标水平比较 各组间总体比较,呼吸频率、呼气阻力、PEF、FEF50水平差异有统计学意义(P<0.01)。与正常对照组比较,模型组、苦杏仁苷低、高剂量和阳性对照组呼吸频率、PEF、FEF50水平降低,呼气阻力升高(P<0.05)。与模型组比较,苦杏仁苷低、高剂量组和阳性对照组呼吸频率、PEF、FEF50水平升高,呼气阻力降低(P<0.05)。与苦杏仁苷低剂量组比较,苦杏仁苷高剂量组和阳性对照组呼吸频率、PEF、FEF50水平升高,呼气阻力降低(P<0.05)。苦杏仁苷高剂量组与阳性对照组呼吸频率、呼气阻力、PEF、FEF50水平比较,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠肺功能指标水平比较(±s)Tab.1 Comparison of lung function index levels in each group(±s)

表1 各组大鼠肺功能指标水平比较(±s)Tab.1 Comparison of lung function index levels in each group(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦杏仁苷低剂量组比较,△P<0.05Note:Compared with normal control group,*P<0.05;compared with model group,#P<0.05;compared with amygdalin low-dose group,△P<0.05
组别 n 呼吸频率(次/min) 呼气阻力[cmH2O/(L·s)] PEF(L/s) FEF50(L/s)正常对照组 10 93.65±9.31 1.36±0.14 45.26±4.55 42.78±4.26模型组 10 46.23±6.12* 2.12±0.21* 28.51±3.54* 25.64±3.28w苦杏仁苷低剂量组 10 62.48±7.16*# 1.85±0.19*# 34.74±3.65*# 31.71±3.65*#苦杏仁苷高剂量组 10 78.19±8.54*#△ 1.62±0.16*#△ 38.56±4.02*#△ 36.92±3.87*#△阳性对照组 10 80.26±8.49*#△ 1.59±0.17*#△ 39.01±4.11*#△ 37.02±3.96*#△F值 51.881 27.686 17.782 28.564 P 值 <0.01 <0.01 <0.01 <0.01
2.2 各组大鼠动脉血气指标水平比较 各组间总体比较,pH、PaO2、PaCO2水平差异有统计学意义(P<0.01)。与正常对照组比较,模型组、苦杏仁苷低、高剂量和阳性对照组pH、PaO2水平降低,PaCO2水平升高(P<0.05)。与模型组比较,苦杏仁苷低、高剂量组和阳性对照组pH、PaO2水平升高,PaCO2水平降低(P<0.05)。与苦杏仁苷低剂量组比较,苦杏仁苷高剂量组和阳性对照组pH、PaO2水平升高,PaCO2水平降低(P<0.05)。阳性对照组pH、PaO2水平略高于苦杏仁苷高剂量组,PaCO2水平略低于苦杏仁苷高剂量组,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠动脉血气指标水平比较(±s)Tab.2 Comparison of arterial blood gas index levels in each group(±s)

表2 各组大鼠动脉血气指标水平比较(±s)Tab.2 Comparison of arterial blood gas index levels in each group(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦杏仁苷低剂量组比较,△P<0.05Note:Compared with normal control group,*P<0.05;compared with model group,#P<0.05;compared with amygdalin low-dose group,△P<0.05
组别 n pH PaO2(mmHg) PaCO2(mmHg)正常对照组 10 7.37±0.75 126.58±13.14 37.49±4.57模型组 10 5.13±0.68* 67.49±8.57* 61.25±6.26*苦杏仁苷低剂量组 10 5.96±0.65*# 82.23±10.22*# 52.85±5.51*#苦杏仁苷高剂量组 10 6.62±0.69*#△ 103.67±12.28*#△ 43.29±5.14*#△阳性对照组 10 6.63±0.71*#△ 105.91±11.35*#△ 42.58±4.98*#△F值 14.582 41.411 31.752 P 值 <0.01 <0.01 <0.01
2.3 各组大鼠血清IL-8、TNF-α水平比较 各组间总体比较,血清IL-8、TNF-α水平差异有统计学意义(P<0.01)。与正常对照组比较,模型组、苦杏仁苷低、高剂量和阳性对照组血清IL-8、TNF-α水平升高(P<0.05)。与模型组比较,苦杏仁苷低、高剂量组和阳性对照组血清IL-8、TNF-α水平降低(P<0.05)。与苦杏仁苷低剂量组比较,苦杏仁苷高剂量组和阳性对照组血清IL-8、TNF-α水平降低(P<0.05)。苦杏仁苷高剂量组与阳性对照组血清IL-8、TNF-α水平比较,差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清IL-8、TNF-α水平比较(±s,ng·L-1)Tab.3 Comparison of serum levels of IL-8 and TNF-α in each group(±s,ng·L-1)

表3 各组大鼠血清IL-8、TNF-α水平比较(±s,ng·L-1)Tab.3 Comparison of serum levels of IL-8 and TNF-α in each group(±s,ng·L-1)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦杏仁苷低剂量组比较,△P<0.05Note:Compared with normal control group,*P<0.05;compared with model group,#P<0.05;compared with amygdalin low-dose group,△P<0.05
组别正常对照组模型组苦杏仁苷低剂量组苦杏仁苷高剂量组阳性对照组F值P值IL-8 TNF-α 10 8.53±0.96 4.24±0.76 10 15.28±1.52* 7.18±0.72*10 13.14±1.45*# 6.02±0.65*#10 10.27±1.16*#△ 5.17±0.56*#△10 10.18±1.12*#△ 5.13±0.55*#△45.769 28.780<0.01 <0.01 n
2.4 各组大鼠血流动力学及右心指数比较 各组间总体比较,mPAP、右心指数差异有统计学意义(P<0.01)。与正常对照组比较,模型组、苦杏仁苷低、高剂量和阳性对照组mPAP水平、右心指数升高(P<0.05)。与模型组比较,苦杏仁苷低、高剂量组和阳性对照组mPAP水平、右心指数降低(P<0.05)。与苦杏仁苷低剂量组比较,苦杏仁苷高剂量组和阳性对照组mPAP水平、右心指数降低(P<0.05)。苦杏仁苷高剂量组与阳性对照组mPAP水平、右心指数比较,差异无统计学意义(P>0.05)。各组mCAP水平比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠血流动力学及右心指数比较(±s)Tab.4 Comparison of hemodynamics and right heart index in each group(±s)

表4 各组大鼠血流动力学及右心指数比较(±s)Tab.4 Comparison of hemodynamics and right heart index in each group(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦杏仁苷低剂量组比较,△P<0.05Note:Compared with normal control group,*P<0.05;compared with model group,#P<0.05;compared with amygdalin low-dose group,△P<0.05
组别 n mPAP(mmHg) mCAP(mmHg) 右心指数(%)正常对照组 10 14.26±2.15 95.16±9.62 28.15±3.02模型组 10 25.73±2.62* 91.25±9.55 40.13±4.16*苦杏仁苷低剂量组 10 22.28±2.25*# 93.84±9.58 35.84±3.52*#苦杏仁苷高剂量组 10 18.23±2.21*#△ 96.37±9.83 31.76±3.11*#△阳性对照组 10 17.97±1.85*#△ 92.58±9.31 31.85±3.24*#△F值 39.108 0.448 17.757 P值 <0.01 0.773 <0.01
2.5 各组大鼠肺组织病理学变化 HE染色显示,正常对照组大鼠气道黏膜结构清晰,上皮完整,杯状细胞很少,纤毛无粘连、脱落,管腔内无分泌物,管壁平滑肌无断裂、萎缩。模型组气道黏膜上皮增厚,杯状细胞增生明显,纤毛粘连、倒伏,管壁周围炎性细胞浸润,平滑肌断裂、萎缩。苦杏仁苷各剂量组及阳性对照组纤毛脱落、管壁萎缩、平滑肌断裂情况较模型组有所改善,其中苦杏仁苷高剂量组较低剂量组改善明显。见图1。
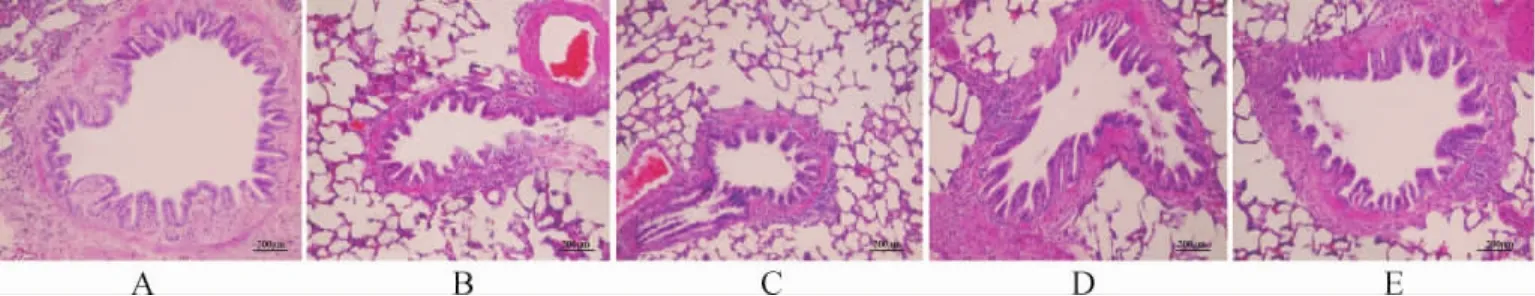
图1 各组大鼠肺组织病理学变化(HE染色,200×)Fig.1 Lung histopathological changes in each group(HE staining,200×)
2.6 各组大鼠肺组织EGFR、p-EGFR、p38MAPK、pp38MAPK蛋白相对表达水平比较 各组间总体比较,肺组织p-EGFR、p-p38MAPK蛋白相对表达水平差异有统计学意义(P<0.01)。与正常对照组比较,模型组、苦杏仁苷低、高剂量组和阳性对照组p-EGFR、p-p38MAPK蛋白相对表达水平升高(P<0.05)。与模型组比较,苦杏仁苷低、高剂量组和阳性对照组p-EGFR、p-p38MAPK蛋白相对表达水平降低(P<0.05)。与苦杏仁苷低剂量组比较,苦杏仁苷高剂量组和阳性对照组p-EGFR、p-p38MAPK蛋白相对表达水平降低(P<0.05)。苦杏仁苷高剂量组与阳性对照组p-EGFR、p-p38MAPK蛋白相对表达水平比较,差异无统计学意义(P>0.05)。各组EGFR、p38MAPK蛋白相对表达水平比较,差异无统计学意义(P>0.05)。见表5、图2。
表5 各组大鼠肺组织EGFR、p-EGFR、p38MAPK、p-p38MAPK蛋白相对表达水平比较(±s)Tab.5 Comparison of relative expression levels of EGFR,p-EGFR,p38MAPK,p-p38MAPK protein in each group(±s)

表5 各组大鼠肺组织EGFR、p-EGFR、p38MAPK、p-p38MAPK蛋白相对表达水平比较(±s)Tab.5 Comparison of relative expression levels of EGFR,p-EGFR,p38MAPK,p-p38MAPK protein in each group(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦杏仁苷低剂量组比较,△P<0.05Note:Compared with normal control group,*P<0.05;compared with model group,#P<0.05;compared with amygdalin low-dose group,△P<0.05
组别 n EGFR p-EGFR p38MAPK p-p38MAPK正常对照组 10 0.98±0.10 0.27±0.04 1.06±0.11 0.31±0.05模型组 10 0.95±0.09 0.73±0.07* 1.03±0.10 0.82±0.08*苦杏仁苷低剂量组 10 0.96±0.11 0.54±0.06*# 1.05±0.12 0.65±0.07*#苦杏仁苷高剂量组 10 1.01±0.12 0.41±0.04*#△ 0.99±0.11 0.51±0.06*#△阳性对照组 10 0.97±0.11 0.40±0.04*#△ 1.02±0.12 0.49±0.05*#△F值 0.467 113.722 0.595 91.407 P值 0.759 <0.01 0.668 <0.01

图2 肺组织EGFR、p-EGFR、p38MAPK、p-p38MAPK蛋白表达Fig.2 Protein expression of EGFR,p-EGFR,p38MAPK,p-p38MAPK in lung tissue
3 讨论
肺心病是临床常见病,多见于吸烟者以及老年人群,病程长,易复发,而且并发症较多。疾病发展后期,患者心肺功能逐渐衰弱,常伴有呼吸衰竭,可出现气喘、紫绀、呼吸困难、血氧饱和度下降等症状,甚至发生休克,严重影响患者生活质量[6]。目前临床上治疗肺心病以保持呼吸道通畅、控制感染和改善心肺功能为主要原则,多采用茶碱类和糖皮质激素类药物改善症状,但由于此类药物作用持续时间短,而且存在较多不良反应,长期使用容易产生药物依赖及耐药性[7]。临床研究表明,七叶皂苷钠、黄芩素等多种中药的有效成分能够控制肺动脉高压、改善肺部微循环,治疗肺心病具有一定疗效,为肺心病的治疗提供了新的选择[8-9]。
肺心病引起肺泡组织空气通过性受限,造成呼吸衰竭,呼吸频率减慢,肺功能指标中PEF能够反映呼吸肌的力量及气道阻塞情况,FEP50反映气道功能。发生呼吸衰竭时,由于缺氧和CO2潴留,引起酸碱失衡,通过动脉血气分析可以判断呼吸衰竭程度及酸碱失衡情况,其中PaO2,PaCO2反映呼吸功能,pH反映酸碱失衡情况[10-11]。肺心病发病过程中TNF-α刺激呼吸道上皮表达IL-8,引起气道炎症反应,进一步导致肺损伤。肺结构和功能发生改变,肺血管重塑,导致肺动脉高压,mPAP升高,引起右心代偿性肥厚,右心指数增加,继而出现右心室重构,影响心功能。本研究采用低氧诱导肺心病大鼠模型,模型组大鼠呼吸频率、PEF、FEF50水平降低,呼气阻力升高,气道明显受损;同时pH、PaO2、水平降低,PaCO2水平升高,呈现出明显呼吸功能障碍;炎症因子水平及mPAP水平、右心指数升高,反映肺动脉高压和右心肥厚;病理切片也显示肺结构明显受损。苦杏仁作为临床治疗肺部疾病的主要中药之一,具有清热化痰、止咳平喘的功效,聂多锐等[12]研究显示,苦杏仁在新安王氏内科肺系疾病用药频次中居第2位,对多种肺部疾病有治疗效果。苦杏仁苷在体内分解为氢氰酸,通过抑制呼吸中枢,发挥镇咳、平喘作用,对小鼠哮喘具有明显治疗作用[13]。Wang等[14]研究显示,苦杏仁苷可缓解慢性阻塞性肺病小鼠气道炎症及气道重塑,减轻肺损伤,改善肺功能。本研究诱导肺心病大鼠模型后,采用不同剂量苦杏仁苷进行治疗,结果显示苦杏仁苷各剂量组呼吸频率、呼气阻力、PEF和PEP50等肺功能相关指标及pH、PaO2和PaCO2等动脉血气指标得到明显改善,炎症因子水平明显下降,同时肺部病理学改变及右心室肥大情况也有一定缓解,提示苦杏仁苷可减轻肺心病大鼠炎症反应,改善肺部损伤,抑制呼吸衰竭。另外,本研究采用临床常用药物盐酸纳洛酮作为阳性对照,结果显示,低剂量苦杏仁苷对肺功能、动脉血气、炎症、血流动力学以及右心肥厚等方面改善作用弱于高剂量苦杏仁苷和盐酸纳洛酮,而高剂量苦杏仁苷对以上指标的改善作用与盐酸纳洛酮相当,提示足够剂量的苦杏仁苷应用于肺心病大鼠,效果与临床常用西药相当。
EGFR属于表皮生长因子家族,是一种跨膜受体糖蛋白,参与细胞增殖、分化和凋亡等重要生物学过程,并与慢性气道性疾病以及肺损伤等多种呼吸系统疾病的发生发展过程密切相关[15]。多种配体与EGFR结合,促进EGFR磷酸化,进而激活包括下游MAPK通路在内的多条通路,发挥相应生物学效应。p38MAPK是MAPK信号通路重要成员之一,参与炎症反应和应激反应的调控。TNF-α可诱导MAPK信号通路,引起一系列炎症因子转录,介导炎症反应。研究发现,EGFR/MAPK信号通路参与PM2.5导致的肺毒性损伤及囊性纤维化肺病等肺损伤过程,通过调控EGFR/MAPK通路可减轻肺损伤炎症反应,改善肺功能[16-17]。本研究中模型组大鼠肺组织p-EGFR、p-p38MAPK蛋白表达水平明显高于正常对照组,而EGFR、p38MAPK蛋白表达水平无明显变化,提示EGFR/MAPK通路在肺心病的病程中被磷酸化激活,活化后的EGFR、p38MAPK参与肺心病进展过程。经不同剂量苦杏仁苷治疗后,p-EGFR、p-p38MAPK蛋白表达水平显著下降,提示苦杏仁苷可能是通过抑制EGFR、p38MAPK磷酸化,阻断EGFR/MAPK信号通路,减轻炎症反应,从而改善肺心病大鼠呼吸衰竭。
综上所述,苦杏仁苷能够抑制肺心病大鼠呼吸衰竭,其作用机制可能是通过调控EGFR/MAPK信号通路相关蛋白表达,减轻炎症反应。本研究结果为临床开发肺心病的治疗药物提供了一定的实验依据,苦杏仁苷治疗呼吸系统疾病是否还有其他机制参与,尚有待进一步研究。
