沉默IGFBP‐1对人胃肠道间质瘤GIST882细胞生长的影响及其作用机制
2021-05-11朱贤章田伟力田培力李涛
朱贤章 田伟力 田培力 李涛
胃肠道间质瘤(gastrointe stinalstromal tumor,GIST)是最常见的消化道间质肿瘤[1],起源于胃肠道壁第四层的Cajal间质细胞,50%~70%发生在胃部,20%~30%发生于小肠[2⁃4]。手术是实现临床治愈的最佳疗法,然而,无论是大范围切除术还是局限性切除术,术后均有复发或转移风险,且GIST从良性转变为恶性过程较快[5⁃6]。此外,GIST的基因突变复杂多样,随着新突变位点的出现和化疗耐药性产生[7],迫切需要新的特异性生物标志物进行临床病理鉴定,建立有效的预防、早期诊断和治疗策略。胰岛素样生长因子结合蛋白1(insulin⁃like growth factor binding protein 1,IGFBP⁃1)是IGFBP家族成员之一,能以高亲和力结合IGF而影响IGF⁃1和IGF⁃2的生物活性[8]。IGFBP⁃1主要由肝细胞合成,然后被分泌到血清中,还可由卵巢颗粒细胞、肾脏和孕妇蜕膜化子宫内膜产生[9]。研究表明,IGFBP⁃1能影响细胞代谢、分化和生长,血清IGFBP⁃1表达水平与多种慢性疾病密切相关,例如糖尿病、心血管疾病和结肠癌等[10⁃12],然而,其在GIST中的研究少有报道。本研究探讨IGFBP⁃1对GIST细胞生物学行为的影响及其可能的作用机制,为GIST寻找新的诊断和治疗靶点
1 材料与方法
1.1 临床资料
选取2018年8月至2019年12月于新疆维吾尔自治区人民医院接受手术切除治疗的GIST患者45例的肿瘤组织及癌旁组织标本(距肿瘤边缘≥5 cm),病理类型均为腺癌,术前均未接受放化疗。危险度分级依据改良美国国立卫生院(NIH)分级标准:极低危险度3例,低危险度12例,中危险度14例,高危险度16例。本研究经新疆维吾尔自治区人民医院伦理委员会批准,患者知情同意。
1.2 主要材料与试剂
GIST882细胞购自上海赛利生物技术有限公司;IGFBP⁃1免疫组化染色试剂、胎牛血清、DMEM培养液以及胰蛋白酶购自美国HyClone公司;LipofectamineTM2000试剂盒购自美国Invitrogen公司;EDU细胞增殖试剂盒购自英国Abcam公司,RNAiso Plus试剂、cDNA合成试剂盒与SYBR®Premix Ex TaqTMⅡ购自日本TaKaRa公司;结晶紫染色液、CCK⁃8试剂盒、Transwell小室与Annexin V⁃FITC试剂盒均购自上海碧云天生物技术有限公司;BCA蛋白测定试剂盒与化学发光液ECL购自北京索莱宝科技有限公司;抗体IGFBP⁃1、p⁃PI3K、PI3K、p⁃AKT、AKT、p⁃mTOR以及mTOR均购自美国SantaCruz Biotech公司;GAPDH与HRP标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司;siRNA⁃IGFBP⁃1、阴性对照siRNA⁃NC以及基因引物序列均交由上海生工生物工程有限公司设计合成;其他试剂均为国产分析纯。
1.3 免疫组化检测IGFBP⁃1表达
组织经固定、脱水、透明、石蜡切片、烘干脱水后,加入枸橼酸缓冲液煮沸进行抗原修复,3% H2O2溶液消除内源性过氧化物酶,山羊血清室温封闭30 min,滴加一抗(1∶200),4℃孵育过夜。次日,滴加二抗(1∶1 000),室温孵育30 min,冲洗后滴加二氨基联苯胺(DAB)显色,苏木素复染,脱水透明,中性树胶封片,电镜下观察并拍照。阳性细胞评分:阳性细胞比例<5%记 0分;5%~25%记1分;26%~50%记2分;51%~75%记3分;>75%记4分。染色强度评分:未着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。两者相加分数<2分判定为阴性,≥2分判定为阳性。
1.4 细胞培养、转染及分组
GIST细胞株GIST882用含10%胎牛血清(FBS),1%双抗(100 U/mL青霉素和100 μg/mL链霉素)的DMEM,置于5% CO2、37℃培养箱中常规传代培养,待细胞生长覆盖至培养基底部80%,使用0.25%胰蛋白酶消化,选择对数生长期的细胞用于后期实验。
GIST882细胞按1×105/孔接种于6孔板中,按照LipofectamineTM2000转染试剂说明书方法,分别转染siRNA⁃NC、siRNA⁃IGFBP⁃1,记为 siRNA⁃NC 组和siRNA⁃IGFBP⁃1组,并设置空白对照组,孵育 4 h后更换为DMEM新鲜培养基。
1.5 qRT⁃PCR检测IGFBP⁃1 mRNA的表达
根据RNAiso Plus试剂说明提取各组GIST882细胞的总RNA,NanoDrop2000紫外分光光度计检测RNA的纯度、浓度。逆转录试剂盒反转录成cDNA,参照SYBR®Premix Ex TaqTMⅡ试剂盒说明,并以cDNA为模板进行qRT⁃PCR实验。扩增条件:95℃5 min,1个循环;95 ℃ 30 s、60 ℃ 30 s、58 ℃ 30 s,40个循环。实验重复 3次。以GAPDH为内参,用2−ΔΔCt法计算基因表达水平。引物序列:IGFBP⁃1上游引物5'⁃TCGATCTT⁃TACCCATCCTTCCT⁃3',下游引物 5'⁃ATCGATATG⁃GAGGACATGACGGTGG⁃3';GAPDH 上游引物 5'⁃GGTGAAGGTCGGTGTGAAC⁃3',下游引物 5'⁃AGAT⁃GGTGATGGGCTGCCC⁃3'。
1.6 Western blot检测蛋白表达水平
RIPA裂解液提取各组细胞总蛋白,BCA法进行蛋白定量后,取25 μg总蛋白上样,10% SDS⁃PAGE分离,转移至PVDF膜。TBST洗涤3次,5%山羊血清封闭 2 h,洗涤并加入一抗 IGFBP⁃1(1∶500),p⁃PI3K、PI3K、p⁃AKT、AKT、p⁃mTOR及mTOR(均1∶1 000),4 ℃孵育过夜。TBST洗膜后,加入HRP标记山羊抗兔IgG(1∶5 000)为二抗,室温孵育2 h。滴加ECL 发光液显影,Image J图像分析软件统计各条带灰度值,并以GAPDH为内参,计算蛋白表达水平。
1.7 CCK⁃8法检测细胞活性
GIST882细胞按1×104/孔接种于96孔板上,置于37℃、5% CO2的细胞培养箱中过夜培养,按照1.4进行细胞转染,每孔设置3个复孔,分别于转染后24 h、48 h和 72 h,每孔加入 10 μL CCK⁃8 试剂继续培养4 h,采用全自动酶标仪检测450 nm处各孔细胞的光密度(OD)值。
1.8 EDU检测细胞增殖能力
将转染后的GIST882细胞以2×105/孔接种在24孔板中,培养12 h,滴加EDU至终浓度为10 μmol/L继续培养2 h,4%多聚甲醛固定15 min,0.5% Triton X⁃100穿透20 min,Apollo567避光染色30 min,滴加DAPI染核5 min。中性树胶封片,在激光共聚焦显微镜下观察细胞,其中蓝色荧光为细胞核,红色荧光为EDU阳性细胞。
1.9 Annexin V⁃FITC/PI染色流式细胞术检测细胞凋亡能力
GIST882细胞转染后,消化离心后将细胞重悬于结合缓冲液中,在细胞悬浮液加入5 μL Annexin V⁃FITC混匀,混匀后再加入10 μL PI染色液,室温下置于黑暗环境温育30 min,上流式细胞仪检测细胞凋亡情况,实验重复3次。
1.10 Transwell检测细胞迁移与侵袭能力
在Transwell小室的上室加50 μL稀释的Matrigel胶,置于37℃培养箱40 min后,将转染后的GIST882细胞调整为 1×106/mL,取 100 μL 细胞悬液加入Transwell上室,下室加入600 μL含10%胎牛血清的DMEM培养液培养至细胞贴壁,换无血清培养液培养12 h,孵育12 h,取出后用4%多聚甲醛固定15 min,0.1%结晶紫染色10 min,PBS洗涤,中性树胶封片,显微镜下拍照并统计细胞数目。迁移实验没有铺Matrigel胶步骤,其他操作均与侵袭实验相同。
1.11 统计学方法
采用SPSS 20.0统计软件对数据分析处理,计量资料均采用均数±标准差(±s)表示,多样本比较采用单因素方差分析,组间样本比较采用LSD⁃t检验;IGFBP⁃1阳性表达率在GIST组织和癌旁组织的比较采用配对χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 IGFBP⁃1在GIST组织和癌旁组织中的表达
免疫组化检测结果显示,GIST组织中IGFBP⁃1阳性表达率高于癌旁组织,差异有统计学意义(86.67%vs11.11%,P<0.05),见图1。
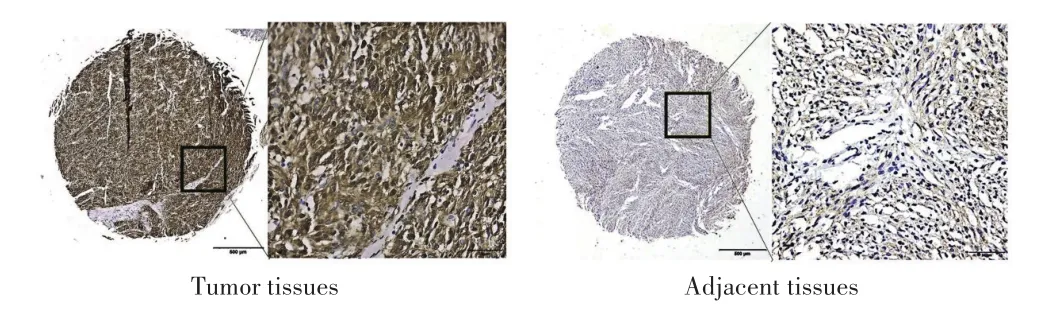
图1 GIST组织和癌旁组织中IGFBP‐1表达(IHC,左40×,右400×)Fig.1 IGFBP‐1 expression in GIST tissues and paracancerous tissues(IHC,Left 40×,Right 400×)
2.2 转染后GIST细胞中IGFBP⁃1的表达
qRT⁃PCR和Western blot检测结果显示,与空白对照组和siRNA⁃NC组比较,siRNA⁃IGFBP⁃1组IGFBP⁃1 mRNA相对表达量和蛋白表达量均显著降低(均P<0.05),见图2。说明细胞转染成功。
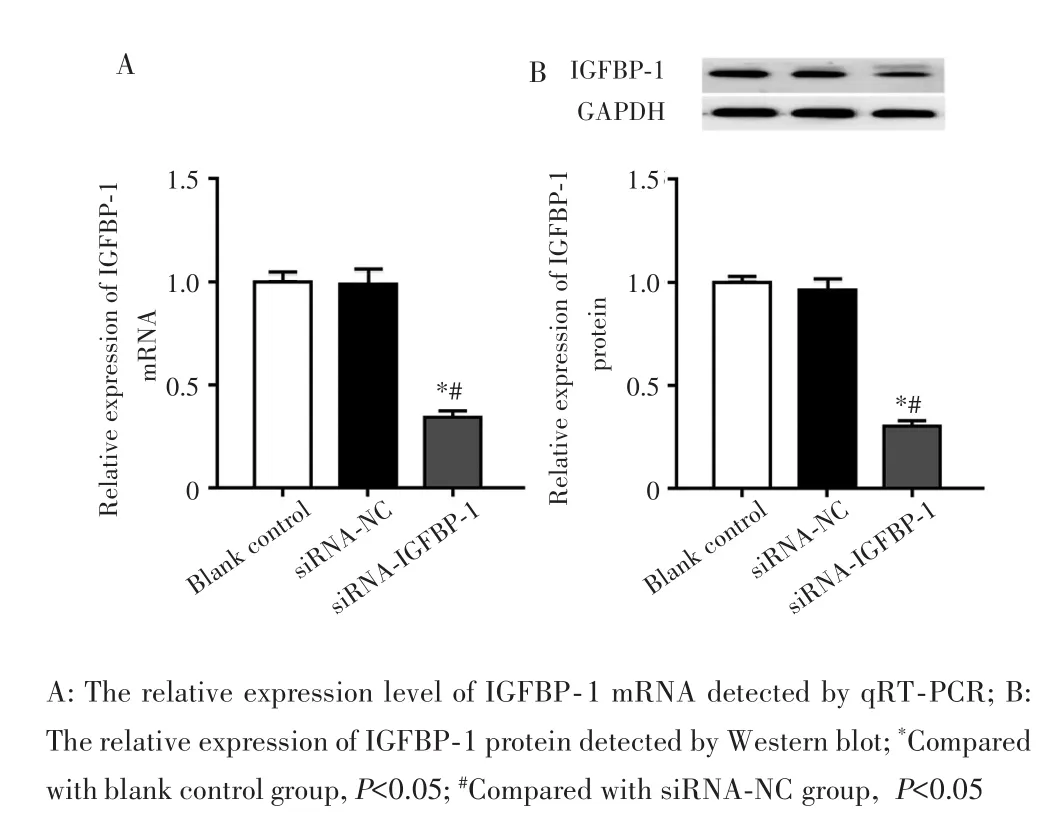
图2 GIST细胞中IGFBP‐1的表达Fig.2 Expression of IGFBP‐1 in GIST cells
2.3 沉默IGFBP⁃1对GIST细胞增殖活性的影响
CCK⁃8法检测结果显示,转染24 h、48 h、72 h后,与空白对照组和siRNA⁃NC组比较,siRNA⁃IGFBP⁃1组细胞增殖活性均显著下降(P<0.05),见图3。EDU染色结果显示,siRNA⁃IGFBP⁃1组细胞中EDU阳性细胞率[(38.25±3.15)%]较空白对照组[(69.42±6.11)%]和 siRNA⁃NC组[(71.56±7.04)%]均显著降低(均P<0.05),见图4。
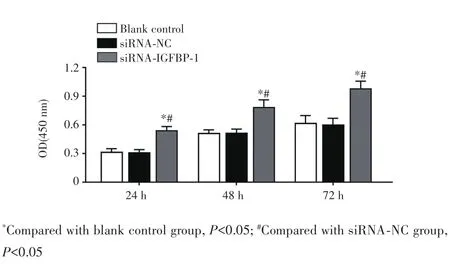
图3 GIST细胞不同时间点的细胞增殖活性Fig.3 Proliferative activity of GIST cells at different time points
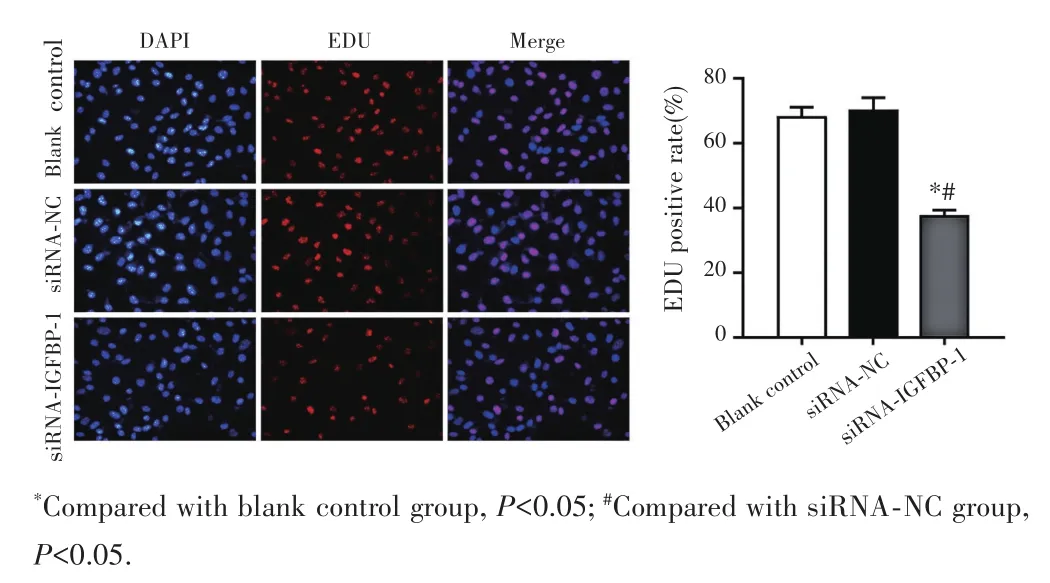
图4 EDU染色检测GIST细胞增殖情况(100×)Fig.4 Proliferation of GIST cells detected by EDU staining(100×)
2.4 沉默IGFBP⁃1对GIST细胞凋亡的影响
流式细胞术检测结果显示,与空白对照组[(4.79±0.41)%]和siRNA⁃NC组[(4.20±0.39)%]比较,siRNA⁃IGFBP⁃1组细胞凋亡率显著增加[(24.12±2.03)%](均P<0.05),见图5。
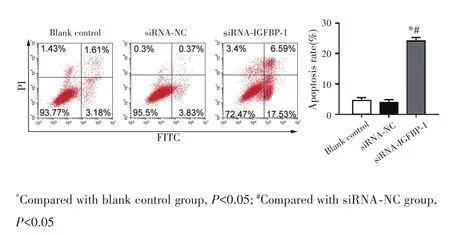
图5 流式细胞术检测GIST细胞凋亡情况Fig.5 Apoptosis of GIST cells detected by flow cytometry
2.5沉默IGFBP⁃1对GIST细胞迁移与侵袭能力的影响
Transwell小室实验结果显示,与空白对照组和siRNA⁃NC组比较,siRNA⁃IGFBP⁃1组细胞迁移数目和侵袭数目均显著减少(均P<0.05),见图6。
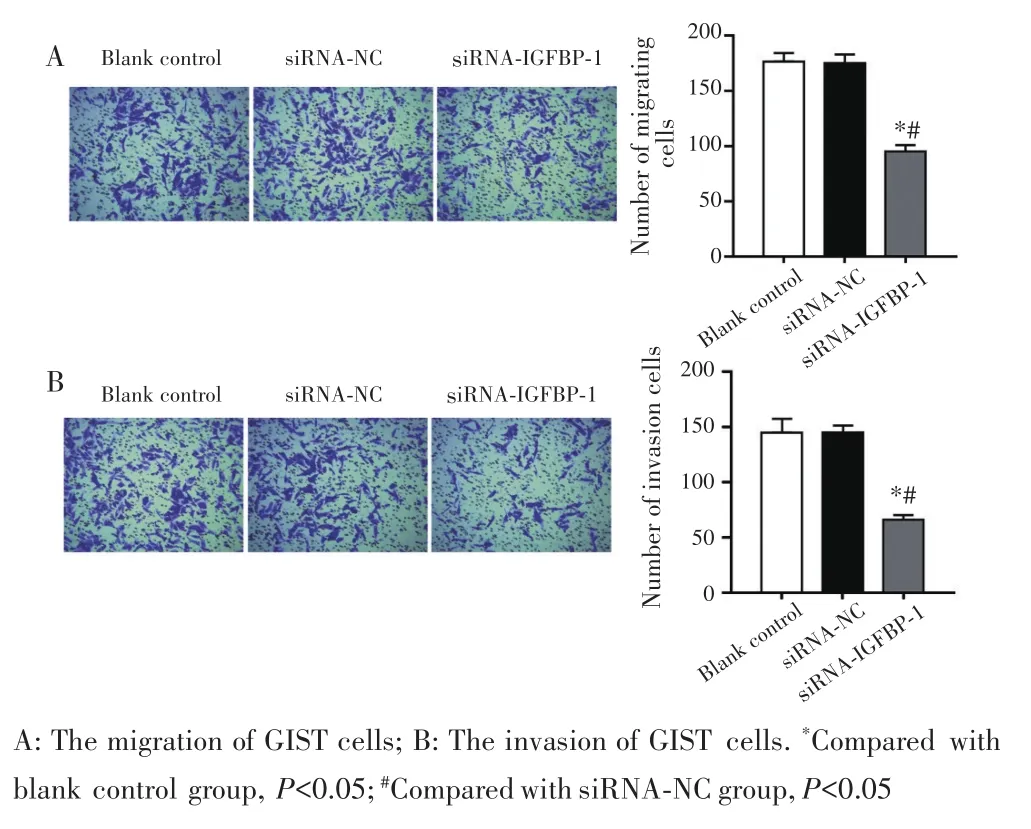
图6 Transwell实验检测GIST细胞迁移与侵袭能力Fig.6 The migration and invasion of GIST cells detected by Transwell assay
2.6 沉默IGFBP⁃1对GIST细胞中PI3K/AKT/mTOR信号通路相关蛋白表达的影响
Western blot检测结果显示,siRNA⁃IGFBP⁃1组细胞中p⁃PI3K/PI3K、p⁃AKT/AKT及p⁃mTOR/mTOR的比值较空白对照组和siRNA⁃NC组显著下降(均P<0.05),而空白对照组与siRNA⁃NC组细胞中p⁃PI3K/PI3K、p⁃AKT/AKT及p⁃mTOR/mTOR的比值比较差异无统计学意义(均P>0.05),见图7。
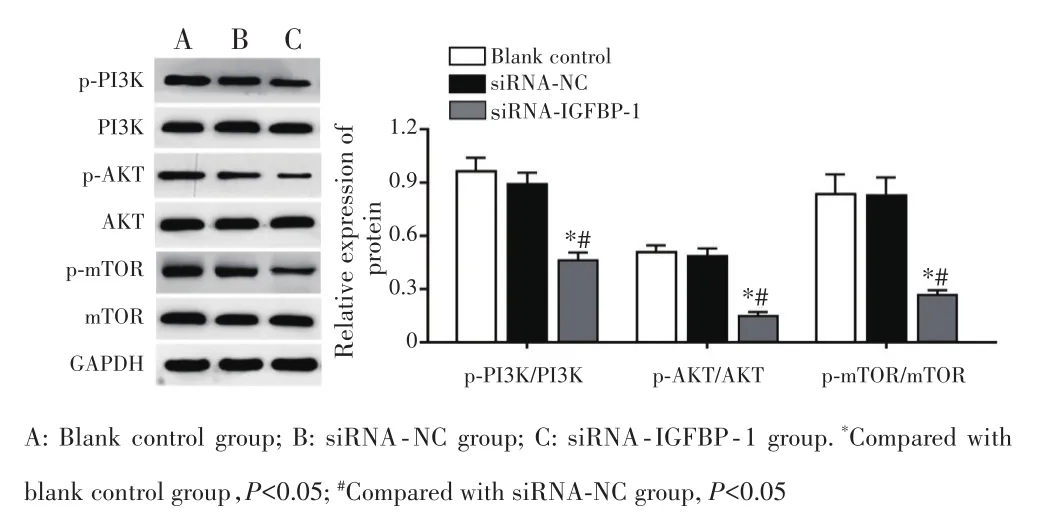
图7 Western blot检测GIST细胞中PI3K/AKT/mTOR信号通路相关蛋白的表达Fig.7 The expression of PI3K/AKT/mTOR signaling pathway related proteins in GIST cells detected by Western blot
3 讨论
GFBPs作为一种分泌蛋白,最初研究表明其通过隔离血清和细胞外液中的IGFs而发挥IGF信号调节剂作用[8]。近年来,随着研究不断深入,在一些疾病和肿瘤组织或血清中也检测到IGFBP表达,例如乳腺癌组织中IGFBP表达高于邻近正常组织,且IGFBP在乳腺癌组织的恶性转化中发挥一定作用[13]。卵巢癌组织和血清中也检测到较高水平的IGFBP⁃1表达,且晚期患者中IGFBP⁃1水平更高,IGFBP⁃1还在卵巢透明细胞腺癌中特异性表达[14⁃15]。本研究也发现 IGFBP⁃1在GIST组织中呈高表达,由此推测IGFBP⁃1可能参与GIST的发生发展过程。多项研究还报道IGFBP⁃1通过与细胞表面分子相互作用而调节细胞增殖、黏附、凋亡、迁移和侵袭过程[16⁃20]。本研究进一步通过转染siRNA⁃IGFBP⁃1沉默GIST细胞中IGFBP⁃1表达,结果发现沉默后细胞增殖、迁移及侵袭能力下降,并促进细胞凋亡,说明沉默IGFBP⁃1表达对GIST细胞生长具有抑制作用。
PI3K/AKT/mTOR信号通路参与多种细胞活动,与细胞周期、细胞增殖及凋亡等密切相关。既往研究发现,在恶性肿瘤中PI3K/AKT/mTOR信号通路的异常激活可增强肿瘤细胞活性,促进细胞生长和蛋白质合成,从而促进癌症的发展,而抑制此信号通路激活可产生相反作用[21⁃22]。在 GIST 组织中,研究发现PI3K和AKT高表达,且随着GIST恶性程度加重而表达增加[23]。本研究检测GIST细胞中PI3K/AKT/mTOR信号通路相关蛋白的表达,发现沉默IGFBP⁃1表达后,细胞中PI3K、AKT、mTOR蛋白的磷酸化水平明显下降,说明在GIST细胞中下调IGFBP⁃1表达可阻碍PI3K/AKT/mTOR信号通路激活,从而抑制肿瘤细胞的恶性生物学行为,阻止肿瘤发展与恶化。
综上所述,GIST组织中IGFBP⁃1高表达,沉默IGFBP⁃1表达可抑制GIST细胞增殖、侵袭与迁移,并诱导细胞凋亡,其机制可能与抑制PI3K/AKT/mTOR信号通路激活有关,本研究结果为GIST治疗提供了新的靶点和思路。
