转录因子Yin Yang 1 在肿瘤中的研究进展
2021-05-11王婷郭倩倩杨月郑禄枫奚涛
王婷,郭倩倩,杨月,郑禄枫*,奚涛**
(1.中国药科大学生命科学与技术学院,江苏 南京 210009;2.郑州大学附属肿瘤医院,河南 郑州 450000)
转录因子Yin Yang 1(YY1)属于锌指类转录因子家族成员,其通过激活或抑制基因转录而广泛参与各种细胞生物学过程,包括细胞分化、DNA 修复、自噬、细胞凋亡及增殖等[1-2]。YY1 对基因的调控依赖于自身的多功能结构域,如YY1 依赖DNA结合结构域与Surf-1启动子[3]、Hoxa5启动子[4]及人乳头瘤病毒(HPV)早期启动子p97[5]结合,调控基因转录过程;YY1 也可以通过其蛋白结构域与蛋白间相互作用,调控靶蛋白对下游基因的转录活性,如YY1 通过与鼠双微粒体-2(MDM2)结合,促进p53 蛋白泛素化降解,进而抑制p53 对下游靶基因p21的转录激活[6]。YY1 在大多数肿瘤中扮演着促癌基因的角色,仅在少数肿瘤如胰腺癌和食管癌中为抑癌基因[7]。
正常的代谢通路无法满足肿瘤细胞快速增殖对能量和生物大分子的需求。因此为了满足自身需求,肿瘤细胞根据周围环境选择适合自己的代谢方式,即代谢重编程[8-9]。越来越多的研究表明,在肿瘤发生发展过程中伴随各种代谢通路的紊乱,如糖酵解[10]、脂肪酸代谢[11]和氨基酸代谢[12]等。随着对肿瘤代谢通路不断深入研究,研究者发现许多被YY1 调控的基因在肿瘤代谢过程中发挥重要作用[13-15],而YY1 本身与肿瘤代谢之间的研究比较少。因此研究YY1 在肿瘤发生发展及肿瘤代谢中的作用机制,有助于寻找基于YY1 的肿瘤诊断和预后标志物。本文就YY1 与肿瘤发生发展及肿瘤代谢的关系作简要综述。
1 转录因子YY1 结构
YY1 是具有多功能结构域的DNA 结合蛋白[16],由414 个氨基酸组成(见图1),N 端为转录激活结构域,主要由3 个区域组成:连续11 个酸性氨基酸(参与转录激活)、连续11 个组氨酸(参与核定位)以及连接上述两者间的一段富含甘氨酸的区域。结构特性使得YY1 容易和带正电荷的蛋白如组蛋白等发生静电作用[2]。中间区域主要负责参与蛋白间相互作用,包含2 个结构域:富含甘氨酸和赖氨酸的抑制域(170 — 200 位),与羧基末端的氨基酸(295 — 347 位)共同参与转录抑制[17],可以与p300、组蛋白去乙酰化酶(HDAC)及p53等蛋白相互作用[18];癌基因蛋白结合域(OPB)常与MDM2、组蛋白-赖氨酸N-甲基转移酶(Ezh2)和腺病毒早期基因(E1A)等癌蛋白相互作用[19]。而C 端含有4 个C2H2 型锌指结构(295 — 397),第一个和第二个锌指结构参与抑制域(170 — 200 位)的转录抑制,第三个和第四个锌指结构主要负责与DNA 结合[16]。
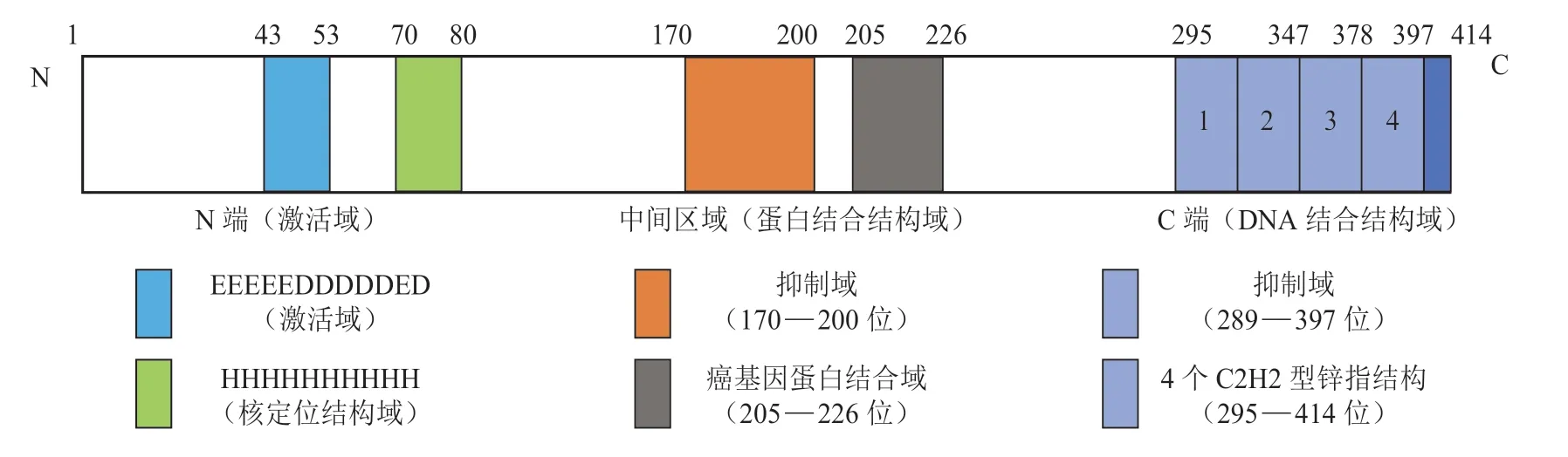
图1 转录因子Yin Yang 1 的结构Figure 1 Structure of transcription factor Yin Yang 1
2 转录因子YY1 与转录调控
YY1 在人类组织中广泛表达,并通过调控基因的转录在各种细胞生物学进程中发挥重要作用[20-21]。YY1 对基因的转录调控离不开与各种蛋白之间的相互作用,包括通用转录因子[如TATA 结合蛋白(TBP)、转录起始因子IIB(TFIIB)、RNA 聚合酶II 等]、具有特异性DNA 结合位点的转录激活因子[如特异性蛋白转录因子1(Sp1)、人核内转录因子(C/EBP)、c-MYC 等]以及转录共调控因子[如E1A、p300、磷腺苷效应元件结合蛋白(CREB)、HDAC1 等]等[18,22]。
2.1 转录因子Yin Yang 1 与转录激活
YY1 可通过直接或间接的方式调控靶基因转录激活:1)直接结合或与其他转录因子竞争结合靶基因启动子区DNA 结合位点,促进靶基因转录,如YY1 在转录因子Kruppel 样因子4(Kruppel-like factor 4,KLF4)启动子区有2 个DNA 结合位点,YY1 通过结合DNA 结合位点激活KLF4转录[23];YY1 与转录因子REX1 在非编码RNAXist启动子区域的DNA 结合位点重合,YY1 通过与REX1竞争Xist启动子DNA 结合位点,激活Xist转录[24]。2)通过蛋白-蛋白间相互作用,调控靶蛋白激活下游基因转录,如在前列腺癌细胞中,YY1 与雄激素受体(AR)结合,通过增强AR 与雄激素应答元件相互作用,促进AR 对前列腺特异性抗原(PSA)基因转录的激活作用[25]。
2.2 转录因子Yin Yang 1 与转录抑制
YY1 调控基因转录抑制的机制主要包括:1)直接结合或与其他转录因子竞争结合靶基因启动子的DNA 结合位点,抑制靶基因转录,如HPV16早期启动子p97同时存在YY1 和转录因子Sp1 的DNA 结合位点,且结合位点重合,YY1 通过与Sp1竞争结合p97启动子的DNA 结合位点,抑制p97转录激活[5]。2)作为转录共抑制因子,通过蛋白与蛋白间的相互作用抑制靶蛋白对下游基因转录的活性,如YY1 与乙酰化转移酶p300 和p53 复合物结合,通过干扰p53 的乙酰化过程,抑制p53 对靶基因p21转录的激活作用[26]。
2.3 转录因子Yin Yang 1 的双重作用
研究发现YY1 对一些基因的调控存在双重作用,即对同一个基因既能转录激活,也能阻遏基因转录,如在没有腺病毒E1A 蛋白时,YY1 作为转录抑制因子,抑制腺病毒p5启动子转录;而当E1A蛋白存在时,YY1 可激活p5启动子转录[27]。但E1A 蛋白对YY1转录作用的调控机制目前尚不清楚。
3 转录因子Yin Yang 1 与肿瘤的关系
YY1 在大多数肿瘤中高表达,且表达水平与肿瘤的形成、转移、耐药及不良预后相关[28]。YY1 通过激活/抑制多种基因的转录参与肿瘤的发生与发展。目前研究表明YY1 可通过促进有氧糖酵解及磷酸戊糖途径(PPP)促进肿瘤的发生发展[29-30]。基于YY1 在肿瘤进展中具有不同的调控机制并参与多种生物学过程,因此总结了YY1 在各种肿瘤中的表达情况以及发挥的生物学功能(见表1)。通过全面系统地阐述YY1 与肿瘤的关系,有助于为基于YY1 的临床诊断、治疗及预后标志物的筛选提供更可靠的理论依据。

表1 转录因子Yin Yang 1 在肿瘤中的表达水平及功能Table 1 Expression level and function of transcription factor Yin Yang 1 in tumor
3.1 促进肿瘤进展
研究表明,YY1 在大多数肿瘤中均高表达,且促进肿瘤的发生及发展过程。但YY1 在不同肿瘤中促进肿瘤进展的作用机制并非一致,主要因为YY1调控的靶基因在肿瘤中参与不同的生物学过程。以下根据肿瘤类型,阐述YY1 促进肿瘤发生发展的作用及机制。
3.1.1 胶质母细胞瘤 YY1 在GBM 中高表达,且YY1 过表达可促进GBM 细胞增殖、迁移和侵袭等过程[60]。研究发现敲减YY1 水平可显著抑制GBM进展;miR-218通过与YY1 结合,抑制YY1 表达,进而抑制GBM 增殖、迁移和侵袭[31]。GBM 中长链非编码RNASNHG5也高表达,可通过激活p38/丝裂原活化蛋白激酶(MAPK)信号通路促进GBM增殖并抑制细胞凋亡;进一步研究发现YY1 可以与SNHG5启动子结合并促进SNHG5转录,进而激活p38/MAPK 信号通路,促进GBM 发生与发展[33]。此外,YY1 与细胞的耐药性也相关,研究发现YY1在顺铂耐药细胞株U87MG 中高表达,而在敏感细胞株LN-229 中低表达,且过表达YY1 能够显著增加LN-229 细胞对顺铂的耐药性;同时miR-186能通过靶向抑制YY1 表达逆转细胞对顺铂的耐药性,并抑制GBM 起始细胞的形成[32]。以上研究表明YY1可促进GBM 细胞增殖、迁移及侵袭过程,并增加GBM 细胞对化疗药物的耐药性。
3.1.2 黑色素瘤 研究人员通过临床样本分析发现黑色素瘤中YY1 高表达,且YY1 的表达水平与黑色素瘤的转移及肿瘤分期呈正相关[34]。miR-9是黑色素瘤细胞中的抑癌基因,通过下调NF-κB-Snail 信号轴抑制黑色素瘤发生与发展。YY1 可下调miR-9表达,进一步激活NF-κB-Snail 信号轴从而促进黑色素瘤细胞增殖和转移[34-35]。另外,miR-625通过负向调控YY1 表达抑制黑色素瘤细胞增殖、迁移及侵袭。而环状RNAcirc0016418可像“海绵”一样“吸附”miR-625,干扰miR-625对YY1 表达的抑制作用,从而促进黑色素瘤发生发展[61]。转录因子EB(transcription factor EB,TFEB)是自噬和溶酶体相关基因的转录调节因子,YY1 作为TFEB 转录辅因子,协同参与TFEB 激活自噬和溶酶体生物合成相关基因转录的过程[36]。研究发现敲低黑色素瘤细胞中YY1 的水平,能显著增加细胞对抗癌药物维拉菲尼的敏感性。虽然没有直接证明自噬与肿瘤细胞的耐药性相关,但是当抑制自噬过程时,肿瘤细胞对维拉菲尼的敏感性也显著增强,这表明YY1 可能通过促进自噬过程以降低肿瘤细胞对维拉菲尼的敏感性[37]。
3.1.3 血液恶性肿瘤 血液肿瘤主要包括各类白血病、多发性骨髓瘤(MM)以及恶性淋巴瘤(ML)[62]。YY1 在血液恶性肿瘤中普遍高表达,并促进恶性肿瘤的发生发展[63]。例如YY1 在MM 中高表达,且与不良预后相关[64]。研究发现,转录因子p65 一方面扮演着促凋亡基因Bim转录激活因子的角色;另一方面,当p65 与YY1 形成络合物后转变为转录抑制因子,通过阻碍Bim转录激活进而抑制MM 细胞凋亡并促进细胞生长[38]。YY1 在MM 耐药细胞中也高表达,敲低YY1 表达后可显著降低耐药细胞株对化疗药物硼替佐米的耐药性[65]。虽然YY1 在MM 细胞中参与形成YY1-p65 复合体,但该信号传导途径及复合物在其他肿瘤模型中是否同样促进肿瘤发生发展,目前尚不清楚。因此了解YY1-p65 复合物与其他肿瘤间的关系将有助于发现新颖且有效的治疗方法。
伯基特淋巴瘤(BL)和弥漫性大B 细胞淋巴瘤(DLBCL)中,YY1 高表达并在肿瘤发生发展中发挥重要作用[63]。有研究发现在滤泡性淋巴瘤(FL)细胞中,Polo 样激酶1(PLK1)可通过激活YY1促进肿瘤细胞增殖[66]。在急性髓系白血病(AML)中,SDF-1a/CXCR4 信号轴通过上调YY1 表达,促进肿瘤细胞生长[39]。此外,YY1 也与急性淋巴细胞白血病(ALL)的化疗耐药相关。YY1 以及多重耐药基因1(MDR1)在ALL 中高表达,且MDR1可通过编码多药耐药P 糖蛋白(P-gp),使细胞对化疗药物产生耐药性;MDR1是YY1 的靶基因,YY1通过激活MDR1转录增加肿瘤细胞对化疗药物的耐药性[40]。以上研究表明在血液恶性肿瘤中,YY1 促进肿瘤进展并增加细胞对化疗药物的耐药性,探究YY1 在肿瘤中的调控机制和耐药机制有利于为药物研发提供新的思路。
3.1.4 乳腺癌 研究表明在原发性乳腺癌组织和乳腺癌细胞中YY1 均高表达,且YY1 可促进细胞增殖、迁移和上皮-间充质转化(EMT)进程[41,43-44]。p27是细胞周期蛋白激酶抑制因子,YY1 可通过招募S期激酶相关蛋白2(Skp2)诱导p27 蛋白泛素化降解,进而促进乳腺癌细胞增殖[43]。此外,YY1 作为衔接蛋白(AP-2)转录辅因子,协同并参与AP-2激活人表皮生长因子受体-2(HER2)转录的过程,进而促进肿瘤侵袭过程[41-42]。序列相似家族3 成员C(FAM3C)参与转化生长因子-β(TGF-β)介导的EMT 进程,并在乳腺癌细胞中高表达;YY1 能激活热休克转录因子1(HSF1)/AKT/细胞周期蛋白D1(CyclinD1)信号途径进而促进乳腺癌细胞增殖、迁移和EMT,而FAM3C 可以与YY1 结合,并通过形成FAM3C/YY1/HSF1 轴促进乳腺癌进展[44]。另外,干扰FAM3C/YY1/HSF1 轴能够显著抑制TGF-β对乳腺癌细胞增殖、迁移及侵袭的诱导作用,因此FAM3C/YY1/HSF1 信号轴可能是治疗乳腺癌的潜在药物靶点。长链非编码RNALINC00673也在乳腺癌组织中高表达,并与乳腺癌患者不良预后相关[45]。LINC00673能够激活MARK4/Hippo 信号通路,促进乳腺癌细胞增殖,且LINC00673为YY1 下游靶基因,可以被YY1 转录激活。因此YY1 可通过促进LINC00673转录,进一步激活MARK4/Hippo 信号通路,从而促进乳腺癌的发生与发展。三阴性乳腺癌(TNBC)细胞和组织中miR-5590-3p低表达,且miR-5590-3p过表达可抑制TNBC 细胞增殖、迁移及EMT 过程[46];YY1 与miR-5590-3p启动子结合后,通过抑制miR-5590-3p转录,促进TNBC 细胞增殖、迁移及EMT 进程;同时,YY1 又作为miR-5590-3p下游靶基因被miR-5590-3p负调控,该研究表明在TNBC 中存在YY1/miR-5590-3p反馈环,且抑制该反馈环可显著抑制TNBC 细胞增殖和迁移及EMT 进程[46],因此YY1/miR-5590-3p反馈环可能是治疗TNBC 的潜在靶点。探究YY1 在乳腺癌中的增殖及转移机制,对乳腺癌临床诊断、预后标志物及潜在治疗药物的筛选具有重要意义。
3.1.5 宫颈癌 人乳头瘤病毒感染是宫颈上皮内瘤变(CIN)和宫颈癌的主要病因[67]。YY1 在HPV18及HPV16 感染的样本中高表达,这表明YY1 可作为宫颈癌治疗潜在的药物靶点及宫颈细胞恶性转化相关诊断指标[68]。研究发现宫颈癌中miR-181与YY1 间存在负反馈调节,YY1 可通过抑制miR-181表达促进宫颈癌进展,相反miR-181也可以通过靶向YY1 抑制宫颈癌进展[47]。YY1 也能促进癌基因E6 并抑制抑癌基因E-Cadherin 表达,进而促进宫颈癌生长和转移[48]。此外,抗宫颈癌药物三氧化二砷(As2O3)可通过降低YY1 表达,诱导抑癌基因p53表达进而促进HeLa 细胞凋亡[49]。因此YY1 不仅可以作为宫颈癌筛查的指标,还可以作为宫颈癌治疗的潜在靶点。
3.1.6 肝癌 HCC 组织中YY1 表达水平与微血管密度(MVD)及预后不良呈正相关[50,69]。HCC 是典型的多血管实体瘤,HCC 的转移和复发需要新生血管来提供充足氧气和营养物质,MVD 可作为血管生成的标记,且血管内皮生长因子(VEGF)在血管生成中发挥重要作用[70]。YY1 可通过增强VEGF转录活性,促进血管的形成、肿瘤细胞迁移及侵袭。此外过表达YY1 可显著增加HCC 细胞对贝伐珠单抗的耐药性[50]。这些研究结果表明YY1 在HCC 血管生成、细胞迁移、侵袭以及贝伐珠单抗耐药中发挥重要作用。组蛋白去乙酰化酶抑制剂(HDACi)能够抑制肿瘤细胞增殖并促进其凋亡[71]。HCC 细胞中YY1 与HDAC表达呈正相关,YY1 可通过结合HDAC1启动子并诱导其表达,导致细胞对HDACi的敏感性降低[71]。此外,选择性剪切因子QKI 高表达与HCC 生存时间短、肿瘤转移和临床分期有关,QKI 可在EMT 过程中调节circRNA的形成,并增加肿瘤细胞的侵袭能力[72]。随后发现YY1 以YY1/p65/p300 复合物形式与QKI基因结合,并通过激活QKI转录进而促进HCC 进展[51],其中YY1 与QKI的超级增强子和启动子结合,p65 与启动子结合,p300 发挥稳定复合物的作用。通过虚拟筛选及抗肿瘤活性分析发现,植物来源的黄酮醇苷类化合物金丝桃苷能通过靶向YY1/p65/p300 复合物抑制QKI的表达,从而发挥其抗肿瘤活性,该研究提示YY1/p65/p300 复合物或可作为HCC 的潜在治疗靶点。
3.2 转录因子Yin Yang 1 抑制肿瘤进展
虽然YY1 在大多数肿瘤中促进肿瘤进展,但在某些肿瘤中发挥抑癌功能,且不同肿瘤类型中YY1抑制肿瘤机制也不一致。以下主要阐述YY1 抑制不同肿瘤进展的作用机制。
3.2.1 胰腺癌 研究发现YY1 能够显著抑制胰腺癌进展,胰腺癌中YY1 表达水平比较低,且高水平的YY1 有更好的生存期[7]。体内外实验也证实YY1过表达能显著抑制胰腺癌进展[52]。猫肉瘤相关蛋白(Feline sarcoma-related,FER)可通过激活STAT3/MMP2 通路促进肿瘤生长;YY1 与FER启动子结合并抑制其转录激活,通过阻断FER/STAT3/MMP2通路抑制胰腺癌生长[52]。此外,YY1 与胰腺癌细胞增殖及浸润也有关,如YY1 与周期素依赖性激酶抑制因子3(CDKN3)启动子结合并抑制其表达,通过干扰CDKN3/MDM2/p53 复合物的形成并阻断复合物对细胞周期蛋白激酶抑制因子p21 的抑制作用,进而抑制胰腺癌的进展,即YY1 通过促进p21表达,抑制胰腺癌细胞增殖和浸润[6]。YY1 也与胰腺癌自噬过程相关,YY1 可通过抑制miR-30a转录,进而抑制miR-30a介导的自噬过程从而抑制胰腺癌生长[55]。另外,YY1 还通过抑制lncRNASOX2OT转录,下调肿瘤干细胞标志物SOX2 表达,从而抑制胰腺癌进展;研究还显示SOX2OT表达水平与胰腺癌预后呈负相关[54]。除了转录抑制功能,YY1 还可以作为转录激活因子抑制胰腺癌进展。促微管蛋白聚合蛋白(TPPP)在胰腺癌组织中低表达,并且与血管浸润相关;TPPP 在YY1 诱导下转录激活,TPPP 过表达后可通过抑制p38/MAPK 和PI3K/AKT 信号通路进而抑制胰腺癌迁移、侵袭和血管生成[53]。YY1还通过诱导促凋亡基因Bax表达并将其定位于线粒体中,进而加速胰腺癌细胞的凋亡并抑制胰腺癌进展[56]。虽然胰腺癌中YY1 在很大程度上发挥抑癌作用,但YY1 在胰腺癌中维持较低水平的分子机制目前尚不清楚。
3.2.2 食管癌 食管癌分为食管鳞状细胞癌(ESCC)和食管腺癌(EADC),其中ESCC 占食管癌的90%。ESCC 组织中YY1 高表达,并抑制肿瘤的发生与发展[73]。不同于其他肿瘤,ESCC 细胞中p53 突变后引起p53 蛋白在细胞内累积,因无法调控细胞周期蛋白激酶抑制因子p21,导致肿瘤细胞增殖失控[74]。研究发现YY1 可通过调控细胞周期复合物的形成抑制ESCC 细胞增殖,即YY1 通过干扰Sp1 与p21启动子结合抑制p21转录激活,并阻碍p21/Cyclin D/细胞周期蛋白依赖性激酶4(CDK4)复合物的形成,进而抑制ESCC 细胞增殖;同时研究也指出YY1 还能通过促进血红素加氧酶-1(hemeoxygenase,HO-1)表达,抑制细胞生长[75]。以上研究结果提示YY1、p21 及HO-1 或可作为ESCC 治疗的潜在药物作用靶点。
3.3 转录因子Yin Yang 1 与肿瘤代谢
研究发现被YY1 调控的某些基因在肿瘤代谢中发挥重要作用,如c-MYC 参与谷氨酰胺代谢,通过上调谷氨酰胺酶促进肿瘤发生发展[76];p53 可抑制尿素循环代谢酶,导致氨在细胞中积累,进而抑制肿瘤的生长[77]。YY1 是否通过调控这些基因参与肿瘤代谢,目前尚不清楚。研究表明YY1 可以通过促进糖酵解和戊糖磷酸途径,以肿瘤代谢方式促进肿瘤进展。因此研究YY1 与肿瘤代谢之间的联系,可为寻找潜在抗肿瘤代谢的药物靶点提供新思路。以下主要介绍YY1 与肿瘤代谢研究的最新进展。
3.3.1 转录因子Yin Yang 1 与有氧糖酵解 肿瘤细胞即使在氧气充足时也依赖于糖酵解途径提供能量,即有氧糖酵解[78]。己糖激酶2(HK2)和磷酸甘油酸激酶1(PGK1)是糖酵解途径中的限速酶。在神经母细胞瘤(NB)中转录因子髓锌指基因1(MZF1)可通过激活HK2和PGK1转录促进糖酵解过程[58]。MZF1是YY1 的靶基因,过表达YY1 能显著激活MZF1转录并增加其转录活性,进而上调HK2和PGK1表达,加快糖酵解速率,从而促进NB 生长和转移。MZF1-uPEP 为转录因子MZF1上游开放阅读框的衍生肽,MZF1-uPEP 与YY1 结合后显著降低YY1 的表达,并通过抑制YY1-MZF1轴转录激活,降低糖酵解速率并抑制NB 进展[58]。葡萄糖转运蛋白3(GLUT3)是GLUT 家族成员,促进肿瘤细胞摄取葡萄糖及乳酸堆积。YY1 直接与GLUT3启动子结合并激活GLUT3转录,导致细胞代谢速率加快,从而促进细胞增殖和肿瘤发生发展[59]。肿瘤细胞中糖酵解速率的加快,为肿瘤细胞快速增殖提供能量物质和用于细胞合成所需的生物大分子。因此YY1和GLUT3 或可成为抗肿瘤代谢药物潜在靶点。
3.3.2 转录因子Yin Yang 1 与磷酸戊糖途径 PPP 是除糖酵解和三羧酸(TCA)循环外另一种葡萄糖氧化方式[79]。肿瘤细胞内PPP 相关蛋白表达升高,流向PPP 的葡萄糖通量显著升高,是肿瘤细胞区别于正常细胞的显著特征[80]。葡萄糖-6-磷酸脱氢酶(G6PD)是PPP 途径中的限速酶,YY1 与G6PD启动子结合并激活其转录,通过改变肿瘤代谢,如催化6-磷酸葡萄糖氧化产生5-磷酸核糖用于核苷酸的从头合成,并产生还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)以清除细胞内活性氧簇(ROS),从而促进肿瘤细胞增殖和迁移[30]。
4 结语与展望
YY1 在大多数癌症中主要发挥促癌作用,是一个非常有吸引力的药物靶点。有些药物可直接作用于YY1 以阻止其与相互作用的靶分子结合,有些药物则通过降低YY1 的表达间接发挥作用,如临床药物奥沙利铂直接通过阻断YY1-GLUT3轴抑制结肠癌细胞增殖[59];利妥昔单抗和加妥昔单抗则通过抑制NF-κB 信号通路下调YY1 表达发挥其抗肿瘤作用[81-82]。同时YY1 高表达与耐药相关,例如YY1 高表达使GBM 对顺铂产生耐药性[32]、使黑色素瘤对维拉菲尼耐药[37]以及使HCC 对贝伐珠单抗耐药[50]等。YY1 在不同癌症中的耐药机制需要进一步研究,从而为个体化治疗及联合用药提供新的思路。
虽然YY1 在基因调控和癌症中的作用被广泛研究,但YY1 促进/抑制肿瘤机制在不同癌症中并非一致。虽然大多数癌症中YY1 发挥促癌作用,但在胰腺癌和食管癌中YY1 抑制肿瘤进展。胰腺癌和食管癌中YY1 相互作用的对象与其他癌症中是否有显著差异仍需进一步探索。肿瘤是基因突变逐渐累积的过程,所以YY1 对肿瘤的双重功能,可能是因为与YY1 相互作用的靶基因启动子或特定的蛋白质在不同的癌症患者中缺失或过度表达。因此,从不同癌症模型中获得与YY1 相互作用的关键分子将有助于更全面了解YY1 在癌症中的生物学作用,为寻找基于YY1 的肿瘤诊断和预后标志物,以及新型癌症治疗策略提供理论依据。
近年来,肿瘤被认为是代谢性疾病,代谢重编程是肿瘤区别于正常细胞的一大特征:为满足自身生长需求,根据周围微环境选择适合自己的代谢方式[83]。首款真正意义上的抗肿瘤代谢药物恩西地平,是靶向异柠檬酸脱氢酶2(IDH2)抑制剂[84],它的上市使抗肿瘤代谢成为抗肿瘤药物研发的热点。许多以肿瘤代谢为靶点设计的药物也处于临床研究阶段,如谷氨酰胺酶-1 抑制剂telaglenastat(CB-839)[85]和脂肪酸合成酶抑制剂TVB-2640[11]等。目前研究表明,YY1 通过调控糖酵解和磷酸戊糖途径,在肿瘤进展中发挥重要作用。因此深入研究YY1 在肿瘤中的作用机制,进一步了解YY1 和肿瘤代谢间的关系,有助于开发出更有效的抗肿瘤代谢药物。
