肝纤维化的发病机制及其治疗药物研究进展
2021-05-11司晶唐露李臣诚徐寒梅
司晶,唐露,李臣诚,徐寒梅*
(1.中国药科大学,江苏 南京 211198;2.南京安吉生物科技有限公司,江苏 南京 210046)
肝纤维化(hepatic fibrosis,HF)是多种损伤因子持续作用下的创面愈合反应,以细胞外基质(extracellular matrix,ECM)的累积以及瘢痕的形成为特征[1]。如果不及时治疗,HF 可发展为肝硬化,并伴有一系列致命并发症,如功能性肝功能衰竭、门脉高压、腹水、肝性脑病,甚至肝细胞癌等[2]。目前尚无有效治疗HF 的药物获批上市,唯一可行的治疗方法是消除慢性应激和肝移植[3]。近年来,越来越多的抗HF 药物逐步进入临床研究阶段。本文对HF 机制的最新研究以及抗HF 药物的研发现状进行概括和总结,希望能为今后HF 发病机制研究及相关药物研发提供思路。
1 肝纤维化的发病机制
1.1 炎症
炎症反应参与大多数肝脏疾病的发病过程,包括病毒感染、化学性肝损伤、创伤和自身免疫性肝病[4]。炎症反应一开始旨在保护肝脏免受进一步损害,但长期的炎症是HF 形成和发展的重要驱动因素[5]。HF 过程中有许多炎症相关通路被激活,导致肝星状细胞(hepatic stellate cell,HSC)活化和肝内胶原沉积[5]。
损伤相关的分子模式(damage associated molecular pattern,DAMP)是健康细胞中涉及多种细胞功能的内源性因子。当肝脏受到刺激、损伤,诱导肝细胞凋亡或坏死时,DAMP 被释放到细胞外介质中,可诱导无菌性炎症[6]。尤其是肝细胞坏死,它包含一系列线粒体退化、膜电位损失和ATP 耗尽的过程,其特征是细胞肿胀、细胞质凝固和细胞膜破裂,然后在细胞外环境中释放细胞内容物,相比凋亡可产生更多的炎症信号[7]。释放到细胞外的DAMP 在HF 中发挥作用的方式复杂多样。首先,DAMP 可以直接激活肝巨噬细胞(Kupffer 细胞,KC),也可以通过诱导炎症细胞因子和趋化因子的释放间接作用于肝细胞、HSC 以及DAMP 自身,来进一步诱导HF 的形成和发展;其次,DAMP 可以促进HSC 产生ECM、Ⅰ型胶原蛋白(Col Ⅰ)、纤维连接蛋白、基质金属蛋白酶(MMP)-9 和-13、金属蛋白酶组织抑制因子(TIMP)-1 等纤维化相关物质,进一步激活HSC[6]。
1.2 细胞因子
多种细胞因子通过激活HSC 诱导肌成纤维细胞产生ECM 来参与HF 的形成。如转化生长因子(TGF)-β1、肿瘤坏死因子(TNF)-α、白细胞介素(IL)、血小板衍生生长因子(PDGF)、肿瘤坏死因子(TNF)等,其中发挥关键作用的细胞因子主要是TGF-β1、PDGF 和IL。
1.2.1 转化生长因子 TGF-β1 是迄今为止发现的最有效的促纤维化细胞因子[8],几乎涉及HF 的所有关键环节。TGF-β1 主要通过3 种机制促进肝纤维的形成:1)TGF-β1 通过抑制MMP 以及促进TIMP 的活性来抑制ECM 降解;2)TGF-β1 通过上皮细胞-间充质转化(EMT)诱导肌成纤维细胞的形成;3)TGF-β1 通过Smad 通路依赖性和非依赖性相关机制诱导ECM 的生成[9]。TGF-β1 对HSC 的主要作用是通过上调Notch 通路和α-平滑肌肌动蛋白(α-SMA)的表达刺激静止HSC 向活化的肌成纤维细胞转化,促进HSC 合成过量的基质蛋白,如纤连蛋白和Col Ⅰ、Col Ⅲ、Col Ⅳ[10]。TGF-β1 还 可 通 过HSC的AGAP2 因子介导来诱导PDGF 转录水平升高,促进PDGF 表达,从而间接促进HSC 的增殖[11]。
1.2.2 血小板衍生生长因子 PDGF 是HF 进展中的关键分子之一。在肝损伤期间,肝窦内皮细胞(liver sinusoidal endothelial cell,LSEC)、肝巨噬细胞(Kupffer Cell,KC)和活化的HSC 均能表达PDGF[12]。PDGF 受体(PDGFR)在HSC 膜上表达,通过自分泌机制刺激HSC 的活化[13]。PDGF 结合在相应的受体上,诱导受体二聚和磷酸化,进而磷酸化细胞内不同底物上的酪氨酸残基。PDGFR 的刺激可激活多种信号通路,包括Ras/Raf 系统、磷脂酶C γ(PLCγ)、磷脂酰肌醇-3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(Akt)通路以及Janus 激酶/信号转导与转录激活子(JAK/STAT)通路。这些下游信号调节相关促纤维化因子的表达水平,如Col Ⅰ、MMP、TIMP 以及凋亡调节因子Bcl-2,从而促进HSC 的增殖和存活[14]。
1.2.3 白细胞介素 IL 在HF 中发挥的作用主要分为促炎和抗炎两部分。IL-1 和IL-17 家族是重要的促炎因子。IL-1 包含IL-1α、IL-1β 等18 个成员,主要通过上调MMP9、MMP13 和TIMP-1 来促进HSC的成纤维特性。IL-1α 和IL-1β 协同促进HF。有研究证明,阻断这两者的表达可以缓解大鼠的HF[15]。IL-17 通过2 种不同的机制发挥其促纤维化作用:1)IL-17 可以诱导KC 和其他巨噬细胞表达IL-6、IL-1β、TNF-α 和TGF-β1,间接激活HSC;2)IL-17也可以通过促进HSC 中Col Ⅰ的沉积及α-SMA和TGF-β1 等纤维化相关标记物的表达来直接激活HSC[16]。
IL-10 和IL-22 在HF 中发挥抗炎作用[17]。在最近的一项研究中,IL-10 被证明可通过上调p53 和p21 的表达来诱导活化的HSC 死亡[18]。另一种抗炎细胞因子IL-22 激活HSC 中的信号转导及转录活化因子3(STAT3),促进HSC 衰老,诱导其死亡。同时,IL-22 通过抑制HSC 中的TGF-β1/Notch 信号通路来抑制HSC 的活化[19]。
IL-6 是一种多效性细胞因子,主要由KC 产生,在急性和慢性炎症中发挥的作用相反,即促炎或抗炎。IL-6 是STAT3 的主要激活因子,IL-6/STAT3 信号通路与HF 的形成和HSC 的活化相关[20]。
1.3 整合素
整合素(integrin)是由α 和β 2 个亚基以非共价连接形成的一个跨膜异二聚体蛋白家族,通过细胞膜传递双向信号,是ECM 成分的主要受体[21]。整合素参与细胞黏附和维持组织完整性,在细胞存活、增殖、分化、迁移等生物学过程中也发挥重要作用[22]。在HF 进程中,整合素主要与ECM 蛋白结合,激活下游信号通路中的相关成员:1)生长因子受体,如表皮生长因子受体(EGFR)、PDGF;2)细胞因子受体,如影响细胞行为的IL-3;3)细胞内相应配体,如p130Cas、Grb2;4)胞质酪氨酸激酶,如Src 家族激酶(SFK)及黏着斑激酶(FAK)[23]。这些被激活的受体、细胞因子直接或间接地激活HSC 以及其他成纤维细胞增殖分化为肌成纤维细胞,促进炎症因子以及ECM 释放,加快HF 的发生发展。
整合素家族由18 个α 亚基和8 个β 亚基通过不同的组合方式组成,已有24 种组合形式被发现[22]。正常组织中,TGF-β1 与潜在相关肽(LAP)以1∶1 结合成复合物的形式储存在ECM 中,没有活性[23]。这些整合素能够识别并结合TGF-β1 上的精氨酸-甘氨酸-天冬氨酸(RGD)序列,从而激活TGF-β1,发挥促纤维化的作用[24]。成纤维细胞主要表达4 种包含av 亚单位的整合素:avβ1、avβ3、avβ5 和avβ8。研究发现,使活化的成纤维细胞丢失所有的含av 亚单位整合素,可以保护小鼠包括肝脏在内的多个器官免受纤维化,并且这种作用与组织中TGF-β1 信号的减少有关[23]。其中,avβ1 由于难以制备抗体,其功能一直被忽略。Reed 等[24]通过特殊方式制备avβ1 抑制剂,研究证明avβ1 是几种原代成纤维细胞上的主要整合素,在HF 进程中TGF-β1 的活化步骤发挥重要作用。通过抑制avβ1可以很好地治疗博来霉素诱导的小鼠肺纤维化以及四氯化碳诱导的小鼠HF。这项研究提示,除了avβ3、avβ5 和avβ8 之外,avβ1 也是治疗HF 的关键靶点。
1.4 以肝星状细胞为中心的各类型细胞在肝纤维化中的作用
HF 的形成原因复杂多样,发病机制目前尚不明确。随着对HF 的研究深入,不断有新的参与HF的细胞、因子、蛋白、信号通路等被研究发现。但自1971 年HSC 与HF 的关系被发现以来,其在HF中的主角地位从未被撼动。大多数HF 是由HSC 的激活驱动的。HSC 又称Ito 细胞、肝脏贮脂细胞,位于肝窦内皮细胞与肝细胞之间的窦周(Disse)间隙内,约占肝脏细胞的10%[25]。生理状态下,HSC表现为非增殖的静止表型,细胞质富含维生素A 脂滴[26]。受到外界刺激时,HSC 从静止向具有高增殖、成纤维性和收缩性的肌成纤维细胞表型转化,同时降低储存维生素A 的能力。激活的HSC 转化为的肌成纤维细胞是肝纤维化中肌成纤维细胞的主要来源,约占各种慢性肝病中肌成纤维细胞的82% ~96%[27]。HSC 活化后分泌大量的ECM 蛋白,释放一系列促炎因子(如IL-6 等)以及促纤维化因子(如TGF-β1)[28],并高表达α-SMA、胶原蛋白、波形蛋白、骨桥蛋白、赖氨酰氧化酶(lysyl oxidase,LOX)以及TIMP-1[29]。因此,活化的HSC 一直被看作治疗HF 的主要靶点。
1.4.1 肝星状细胞的活化 一般情况下,HSC 活化分为2 个阶段:初始活化和永久活化。如果诱导纤维化的因素消失,活化的HSC 可能会发展到第3 阶段:消退。在此阶段它们可能会发生凋亡、衰老或恢复到静态表型[26]。在起始阶段,HSC 接收分泌成纤维细胞因子和生长因子的邻近细胞发出的分子信号,增强HSC 向肌成纤维细胞转化以及分泌促纤维化因子的特性。活化后,HSC 不断增殖并大量分泌ECM 蛋白,导致ECM 积累以及瘢痕形成。这个过程是永久且难以逆转的[26]。
HF 中发生的几乎所有变化都会影响HSC 的行为,诱导HSC 活化。HSC 与肝细胞、LSEC、肝巨噬细胞、自然杀伤细胞(NK)、胆道上皮细胞(BEC)、肝祖细胞(HPC)以及血小板等形成一个相互影响的细胞网络[30]。某个细胞一旦发生变化,释放的趋化因子和分子信号便会直接或间接影响HSC 的状态,通过抑制或激活HSC 调节HF 的进展。因此,理解HSC 与其他细胞之间的相互作用,阐明它们在HF 进程的不同阶段的相互影响,对于HF 的治疗至关重要[26]。
1.4.2 肝细胞对肝星状细胞活化的影响 肝细胞是肝脏最丰富的细胞类型,易受各种有害物质的损害,如酒精、病毒感染、有毒化合物等,诱导肝细胞释放一系列炎症因子,如活性氧(ROS)[31]、Hedgehog(Hh)[32]、核苷酸、DAMP[6]等,直接或间接促进HSC 的活化。HSC 能够吞噬肝细胞凋亡小体,诱导HSC 向肌成纤维细胞转化[26]。受损肝细胞的外泌体可介导Toll 样受体3(TLR3)的激活,增强HSC 中IL-1 和IL-23 的表达。此外,肝细胞中脾脏酪氨酸激酶(SYK)和PDGFRα 的上调可直接改变这两者在HSC 中的表达,调节HSC 的活化和增殖[32]。
1.4.3 肝窦内皮细胞在肝星状细胞活化及肝纤维化发展中的作用 LSEC 是肝脏非实质细胞的主要细胞群,约占肝细胞的15% ~ 20%[33]。肝实质由LSEC 排列形成的高效血管网络支持。LSEC 表型的改变,包括LSEC 窗口缺失、毛细血管化和形成有组织的基底膜,已被证明是HF 形成的先兆[34]。LSEC 与肝细胞、HSC 相互作用,促进蛋白、脂质和糖代谢[35]。在正常肝脏中,肝细胞和HSC 旁分泌的血管内皮生长因子(VEGF)刺激的一氧化氮(NO)依赖性途径和NO 非依赖性途径都是维持LSEC 分化表型所必需的[36]。肝损伤后,LSEC 释放不同的血管分泌信号来平衡肝脏再生和纤维化,最终维持肝脏稳态。LSEC 的成纤维细胞生长因子受体(FGFR)-1 受到肝脏慢性损伤因素的激活而驱动纤维血管的形成,从而促进HF 的发生和发展[37]。受损的LSEC 逐渐毛细血管化,失去基底膜的窗孔。毛细血管化的LSEC 失去保护肝组织和灭活HSC 的能力,促进肝内血管收缩和HF 的形成[35]。而活化的HSC 分泌过多的ECM,导致内皮开窗功能丧失和LSEC 功能障碍,进一步促进HF。鉴于LSEC 在HF 中发挥的作用,保护LSEC 可能是减轻HF 的有效策略。
1.4.4 肝巨噬细胞对肝纤维化的双重作用 KC 具有促进或抑制HF 的双重功能。KC附着在窦状内皮层,可被血液循环的多种刺激激活,并分泌多种细胞因子,包括TGF-β1、TNF-α、MCP-1、趋化因子(如CCL3 和CCL5)和其他可溶性介质,对其他肝细胞产生影响[38]。KC 双向调控HSC 的激活。一方面,KC 通过分泌IL-1 和TNF-α 作用于核转录因子-κB(NF-κB)信号通路来促进HSC 的活化。用柳氮磺胺吡啶诱导HSC 凋亡来抑制NF-κB 通路,可以发挥抗纤维化的作用[39]。抑制巨噬细胞浸润可以直接抑制HSC 的活化和HF 的发生[40]。另一方面,KC 可以通过H2O2-IL-6 机制负向调控HSC 的成纤维性反应,还可以通过分泌MMP 来限制HF[41]。基于目前的研究,尚不清楚为何KC 对HSC 有2种相反的作用。进一步阐明KC 与HSC 激活之间的关键触发机制,将有利于精准干预KC 对HF 的作用。
还有很多其他细胞可对HSC 的活化和HF 的形成产生影响。研究表明,NK 细胞通过杀死活化的HSC 并产生干扰素(IFN)-γ 发挥抗纤维化的作用[42],NK 外泌体可抑制TGF-β1 诱导的HSC 的增殖和活化;胆管细胞(BEC)通过产生Hh 配体调节EMT,直接促进肌成纤维细胞的生长[43]。BEC 的增殖和旁分泌可以促进HSC 的活化和增殖。此外,BEC 自身可在TGF-β1 的诱导下向间充质转化,导致胆管纤维化[44]。
2 肝纤维化相关治疗药物
在我国,肝病是常见病和多发病,主要包括乙型肝炎、丙型肝炎、酒精性脂肪性肝病、非酒精性脂肪性肝病(NAFLD)。HF 是慢性肝病发展到肝硬化的必经阶段,然而目前尚无有效治疗药物获批。处于Ⅱ期和Ⅲ期临床研究阶段的HF 治疗药物有20 多种,包括吡非尼酮、CsA-TAC、Candesartan等(见表1)。截至目前,已有三家公司公布关键Ⅲ期研究结果:Intercept 公司的法尼醇X 受体激动剂奥贝胆酸(商品名:Ocaliva)获得成功,FDA 已接受新药上市申请(NDA),并授予优先审评资格;吉利德的凋亡信号调节激酶1(ASK1)抑制剂selonsertib 的两项关键Ⅲ期研究被宣告失败;2020年5 月11 日,Genfit 公司宣布在治疗非酒精性脂肪性肝炎(NASH)的Ⅲ期研究中,elafibranor 较安慰剂未能显著改善患者NASH 组织学症状和减缓不断加剧的肝脏纤维化,以失败告终。
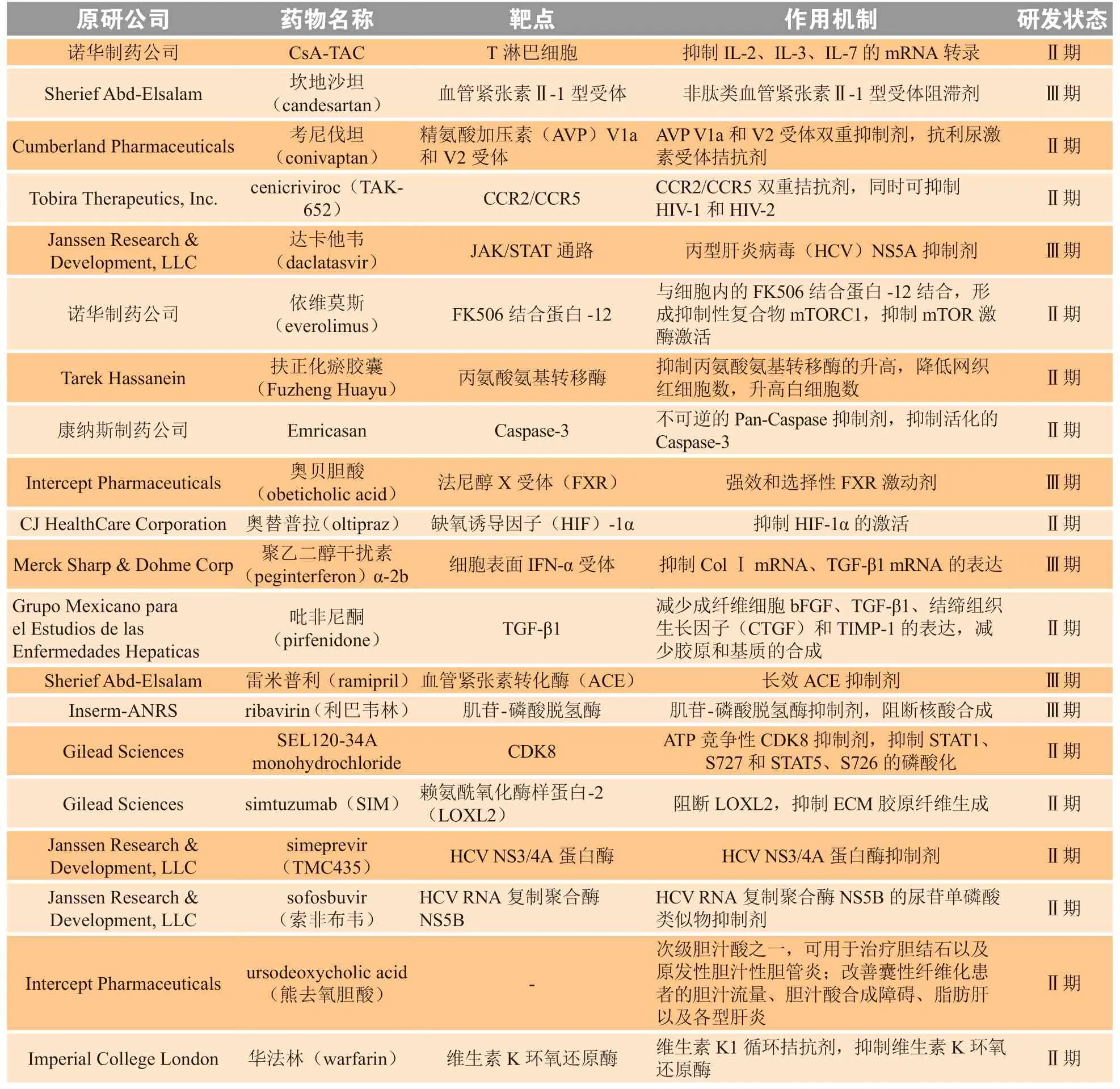
表1 肝纤维化治疗药物临床研究情况Table 1 Clinical study of drugs for the treatment of liver fibrosis
3 结语
HF 是一个复杂的过程,各种细胞、趋化因子、分子信号等相互作用,形成一个庞大的互相影响、互相反馈的网络。其中HSC 的激活是各种相互作用的最终结果。因此,研究HF 的发病机制归根结底是研究HSC 的活化机制。近几年新发现,miRNA、长链非编码RNA(LncRNA)和外泌体等也参与HSC 的活化。正是由于HF 的发病机制错综复杂,靶向其中的某一个靶点或某一环很难有效发挥抗HF作用。因此,解密HSC 活化过程中细胞、因子、信号通路间相互作用的特殊机制,对于HF 的治疗干预至关重要。
